修回日期: 2010-02-01
接受日期: 2010-02-01
在线出版日期: 2010-03-18
目的: 探讨拉米夫定(LAM)耐药后序贯治疗中HBV准种的演变特点.
方法: 收集7例拉米夫定耐药患者序贯治疗中的血清, 对HBV聚合酶基因逆转录酶区进行PCR扩增克隆并测序, 结合临床用药分析序列突变, 探讨其演变特征.
结果: 患者1、4、5在序贯治疗中LAM耐药变异株一直存在, 主要以M204I+L80I、M204I+L80I+L180M、M204V+ L180M+G173L、M204V+L180M为主, 所占比例在不断发生变化. 患者2、3在序贯治疗中检测出野生株, 但患者2在后续治疗中又选择出LAM耐药变异株. 患者6在ADV联合ETV治疗时、患者7在单用ADV治疗时测时分别测出双重耐药株M204V+L180M+G173L+T184A和M204V+L180M+G173L+236D.
结论: 拉米夫定耐药后序贯治疗中原耐药突变不易消失, 且容易在此基础上筛选出交叉耐药株或多重耐药株, 他的出现影响序贯治疗的应答甚至导致序贯治疗的失败.
引文著录: 吴珍萍, 韩涛, 高英堂, 李莹, 刘彤, 景丽, 刘磊, 杜智. 拉米夫定耐药后序贯治疗中HBV准种的演变. 世界华人消化杂志 2010; 18(8): 779-785
Revised: February 1, 2010
Accepted: February 1, 2010
Published online: March 18, 2010
AIM: To investigate the evolution characteristics of hepatitis B virus (HBV) quasispecies during sequential therapy in patients with lamivudine-resistant HBV infection.
METHODS: Serum samples were collected from seven patients with lamivudine-resistant HBV infection during sequential therapy. The reverse-transcriptase (RT) region of the HBV polymerase gene was amplified, cloned and sequenced. Sequence mutations were analyzed to characterize the evolution of HBV quasispecies.
RESULTS: Lamivudine-resistant strains were persistently present in the serum of patients 1, 4 and 5. The main mutation patterns were M204I+L80I, M204I+L80I+L180M, M204V+L180M+G173L, and M204V+L180M. The proportion of these mutant strains changed constantly. The wild-type strain was detected in patients 2 and 3. However, lamivudine-resistant strains were detected in patient 2 during following therapy. Double-resistant mutant strains M204V+L180M+G173L+T184A and M204V+L180M+G173L+N236D were detected in patient 6, who underwent combination therapy with adefovir dipivoxil and lamivudine, and in patient 7, who underwent adefovir dipivoxil monotherapy.
CONCLUSION: Lamivudine-resistant mutant strains in the serum of patients with HBV infection do not easily disappear during sequential therapy. Cross-resistant or multi-resistant strains of HBV quasispecies are often present during sequential therapy and affect the response to the therapy, thereby resulting in therapeutic failure.
- Citation: Wu ZP, Han T, Gao YT, Li Y, Liu T, Jing L, Liu L, Du Z. Evolution of hepatitis B virus quasispecies during sequential therapy in patients with lamivudine-resistant hepatitis B virus infection. Shijie Huaren Xiaohua Zazhi 2010; 18(8): 779-785
- URL: https://www.wjgnet.com/1009-3079/full/v18/i8/779.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i8.779
拉米夫定(LAM)、阿德福韦酯(ADV)、恩替卡韦(ETV)、替比夫定(LdT)等核苷(酸)类似物(nucleotide/side analogs, NAs)被广泛用于抗乙型肝炎病毒(HBV)治疗, 但长期服用NAs易使HBV聚合酶基因发生选择性耐药突变. 拉米夫定能够快速抑制HBV的复制, 但耐药发生率很高, 针对这些LAM耐药患者, 目前常用的有效补救治疗方案是联合ADV或换用ETV治疗[1,2]. 在长期应用LAM治疗过程中HBV聚合酶基因会连续变异产生不同类型的耐药位点[3]. 那么LAM耐药后的序贯治疗中HBV聚合酶基因耐药突变如何演变? 值得进一步深入研究, 本研究主要探讨7例LAM耐药患者序贯治疗中HBV准种的演变特征.
选取7名2003-2008年间在天津市第三中心医院肝胆内科就诊的HBV患者, 这些患者LAM耐药后接受NAs序贯治疗. 每例患者选取3-4份不同时间点的血清进行HBV聚合酶基因的序列分析. 7例患者基本特征及临床用药见表1. 此研究经本院医学伦理委员会批准, 患者签署知情同意书.
| 患者 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| 诊断 | CR | CR | HCC | HCC | HCC | CHB | CHB |
| 年龄/性别 | 36/男 | 55/男 | 58/女 | 70/男 | 51/男 | 22/男 | 34/女 |
| HBeAg/HBeAb | +/- | +/- | -/+ | +/+ | +/- | +/- | +/- |
| 基因分型 | C型 | C型 | C型 | C型 | C型 | C型 | C型 |
| 初始治疗药物 | LAM | LAM | LAM | LAM | LAM | LAM | LAM |
| 用药时间(wk) | 40 | 139 | 62 | 28 | 48 | 48 | 40 |
| 第2次序贯用药 | LAM+ADV | LAM+ADV | LAM+ADV | LAM | LAM | LAM | ETV |
| 用药时间(wk) | 22 | 119 | 88 | 60 | 40 | 48 | 12 |
| 第3次序贯用药 | LdT | ETV 1 mg/d | LAM+ADV | LAM+ETV 0.5 mg/d | ADV | ADV | |
| 用药时间(wk) | 10 | 55 | 22 | 8 | 70 | 48 | |
| 第4次序贯用药 | ETV 0.5 mg/d | ETV 1 mg/d | ETV 1 mg/d | ADV+ETV 0.5 mg/d | |||
| 用药时间(wk) | 45 | 44 | 20 | 28 | |||
| 第5次序贯用药 | ADV+ETV 0.5 mg/d | ||||||
| 用药时间(wk) | 36 |
1.2.1 HBV DNA的定量: 采用上海科华生物工程公司生产的HBV核酸扩增(PCR)荧光定量检测试剂盒(S200359), 检测下限为500拷贝/mL, 本研究中将低于检测下限定为阴性.
1.2.2 巢式PCR扩增: 用上述试剂盒处理的血清样品进行巢式PCR扩增, 扩增区域为聚合酶基因的逆转录酶区(A-F, rt40-rt280). 应用Primer Express 2.0软件设计引物, 上游引物1为5'-GAGTCTAGACTCGTGGTGGAC-3', 下游引物2为5'-GGGTCTTTTGGGCTTTGCTGCC-3', 下游引物3为5'-TGATTGGAAAGTATGTCAGAGAC-3'. 一次PCR反应体系包括: 5 μL 10×PCR缓冲液(含Mg2+)、4 μL dNTP(各1.25 mmol/L)、引物1/2各1、2 μL Taq酶(1 U/μL)、4 μL模板, 加超纯水至50 μL 反应条件: 预变性94 ℃, 2 min; 变性94 ℃, 1 min; 复性60 ℃, 45 s; 延伸72 ℃, 45 s; 35个循环, 延长72 ℃, 5 min. 二次PCR反应体系同前, 引物为1/3, 模板为一次PCR产物.
1.2.3 克隆及测序: 将二次PCR产物电泳、纯化回收后克隆到PMD18-T载体中, 每个样本挑选5-12个重组克隆送上海英俊生物技术有限公司测序, 序列峰图应用Chromas(V1.62)分析, 序列比对采用BioEdit(V7.0.4)软件, 选用的GenBank序列包括M57663(A基因型)、D00329(B型)、X01587/X75656/X75665(C型)、X02496(D型)、X75657(E型)、X69798(F型)、AF160501(G型), 患者HBV序列均与X01587相似性最高, 为C基因型.
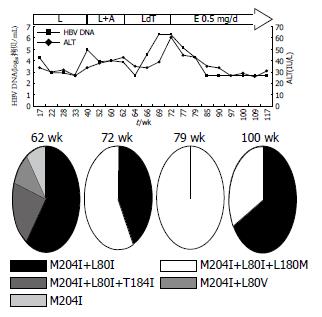
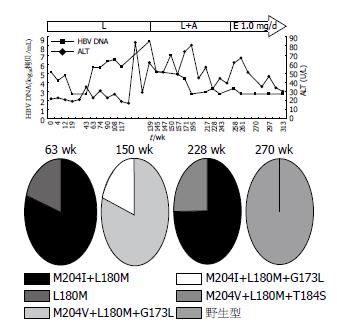
患者1、2、5用药过程中HBV DNA(以下简称DNA)和ALT的动态演变分别见图1-3. 患者1开始服LAM时Child-Pugh分级为A级, 在LAM耐药后联合ADV治疗22 wk, 由于DNA持续阳性而换用LdT, 10 wk后DNA反弹至6.32log10拷贝/mL, 同时出现ALT反弹, 故换用ETV 0.5 mg/d, 13 wk后DNA持续阴性, ALT亦恢复正常, 患者病程中未出现任何并发症. 患者2开始服LAM时已并发腹水、胸水, Child-Pugh分级为B级, 服LAM 63 wk时出现DNA反弹至5.64log10拷贝/mL, 继续服LAM仍维持在5-7log10拷贝/mL, 132 wk后ALT反复异常, 139 wk时DNA反弹至8.53log10拷贝/mL, 后联合ADV治疗, 56 wk后DNA基本维持阴性, 但ALT仍异常, 且119 wk时患者出现肾损害, 故换用ETV 1 mg/d, 同时予胸腺肽调节免疫, DNA仍维持阴性, 26 wk后ALT正常, 该患者病程中反复出现腹水、胸水及食管胃底静脉曲张出血, 予保肝、利尿、补充白蛋白、间断放腹水、胸水治疗, 食管胃底静脉曲张予套扎治疗, 病情稳定. 患者5开始服LAM时Child-Pugh分级为A级, 停药24 wk后再服LAM, 32-40 wk DNA在4-5log10拷贝/mL波动, 联合ETV 0.5 mg/d治疗, 8 wk后DNA仍为4.75log10拷贝/mL, 换用ETV 1 mg/d, DNA从第6周开始持续阴性, 治疗期间ALT基本维持正常, 在此期间先后行8次TACE治疗, 84 wk时ALT的反弹可能由于在此期间接受了TACE治疗, 病程中病情稳定未出现并发症.
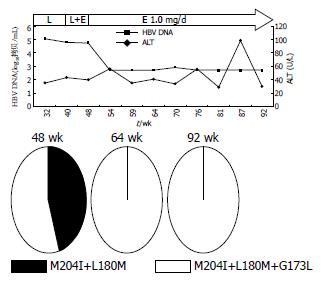
患者3开始服LAM时Child-Pugh分级为A级, 在LAM耐药后联合ADV治疗, 28 wk后DNA持续阴性, 在此期间先后行5次TACE治疗, 并出现食管胃底静脉曲张出血给予套扎治疗, 病情稳定. 患者4开始服LAM时Child-Pugh分级为A级, 停药4 wk后DNA为4.89log10拷贝/mL, YMDD为野生型, 再次服LAM 60 wk时DNA反弹至6.69log10拷贝/mL, 联合ADV治疗12 wk时DNA转阴, 但22 wk时又升至3.25log10拷贝/mL, 在此期间先后4次行TACE治疗, 病情稳定未出现并发症. 患者6停药64 wk后, 再次服LAM 48 wk时DNA反弹, 换用ADV 70 wk时DNA再次反弹, 后换服ETV 1 mg/d 20 wk, DNA仍阳性; 又换成ADV联合ETV 0.5 mg/d治疗, 16 wk时DNA为5.49log10拷贝/mL, 36 wk时下降到3.72log10拷贝/mL, 目前仍在随访中. 患者7服LAM 40 wk时发生耐药, DNA为6.63 log10拷贝/mL, 换用ETV 0.5 mg/d治疗12 wk降至5.72log10拷贝/mL, 后因经济原因换用ADV 48 wk, DNA持续在4-5 log10拷贝/mL波动, 改ADV联合ETV 0.5 mg/d治疗, 28 wk后DNA转阴, 目前仍在随访中.
每例患者选取3-4份不同时间点的血清进行克隆测序做准种分析, 研究耐药株聚合酶基因的序列变化, 总克隆数为225个(表2). 患者1、2、5的耐药突变模式及克隆数见表3, 值得注意的是患者1联合ADV治疗22 wk时, 有20%(2/10)的克隆出现T184I, 在LdT 10 wk时57%(4/7)的克隆出现L180M, 同时出现DNA及ALT反弹, ETV 21 wk时虽然DNA为阴性, 但采用巢式PCR扩增, 克隆测序发现仍存在LAM耐药突变M204I+L80I约67%(8/12)和M204I+L180M+L80I约33%(4/12). 患者2经联合ADV治疗11 wk后, 在原耐药突变基础上选择出100%(10/10)的G173L及20%(2/10)的M204I, 但89 wk时G173L及M204I突变消失, 25%(2/8)的耐药株上出现T184S, 换用ETV 1 mg/d, 12 wk时均为野生型(10/10). 患者5在ETV 1 mg/d序贯治疗6 wk后虽然DNA持续阴性, 但16、44 wk时仍检测到M204V+L180M+G173L(10/10、7/7).
| 各患者在不同时间点的HBV聚合酶基因与参考序列X01857C比对的全部氨基酸替代位点 | |
| 患者1 | |
| LAM+ADV 22 wk | (G0173V10M0204I10C0256S10L180I8/V1E1263D9D5131N5H655Q4H794R3T8184I2S9117P1R9120K1N9139S1S9246P1)10 |
| LdT 10 wk | (H055Q7L080I7G0173V7M0204I7C0256S7E0263D7V3112A4L3180M4)7 |
| ETV 7 wk | (H055Q5L080I5V0112A5G0173V5L0180M5M0204I5C0256S5E0263D5)5 |
| ETV 21 wk | (H055Q12L080I12G0173V12M0204I12C0256S12E0263D12V8112A4L8180M4F1046L2D10131G2S10143P2)12 |
| 患者2 | |
| LAM 60 wk | (G0173V10L0180M10M0204V8/A2L5231S5S857T2S9116A1F9249L1)10 |
| LAM+ADV 11 wk | (G0173L10L0180M10M0204V8/I2C0256S10L0267Q10V8207A2F8249S2)10 |
| LAM+ADV 89 wk | (G0173V8L0180M8M0204V8S0223A8I0224V8C0256S8N665D2L672P2K6168R2F6178S2L6229F2R6280S2)8 |
| ETV 1 mg/d, 12 wk | (R0153W10G0173V10L0267Q10M8129V2S8223P2)10 |
| 患者5 | |
| 再服LAM 40 wk | (N0139K11G0173L6/V5L0180M11M0204V11S0213T11I0224V11C0256S11D2134N9L8229F3S9116P2R9120G2F9227S2P9237H2S10137P1L10144P1G10165X1)11 |
| ETV 1 mg/d, 16 wk | (D0134N10N0139K10G0173L10L0180M10M0204V10S0213T10I0224V10C0256S10L877S2S8185G2Y9245H1)10 |
| ETV 1 mg/d, 44 wk | (D0134N7N0139K7G0173L7L0180M7M0204V7S0213T7I0224V7C0256S7A686T1)7 |
| 用药时间(wk) | 耐药突变模式 | 克隆数(总) | |
| 患者1 | LAM+ADV 22 | M204I+L80I | 6 |
| M204I+L80I+T184I | 2 | ||
| M204I+L80V | 1 | ||
| M204I | 1(10) | ||
| LdT 10 | M204I+L180M+L80I | 4 | |
| M204I+L80I | 3(7) | ||
| ETV 7 | M204I+L180M+L80I | 5(5) | |
| ETV 21 | M204I+L80I | 8 | |
| M204I+L180M+L80I | 4(12) | ||
| 患者2 | LAM 63 | M204V+L180M | 8 |
| L180M | 2(10) | ||
| LAM+ADV 11 | M204V+L180M+G173L | 8 | |
| M204I+L180M+G173L | 2(10) | ||
| LAM+ADV 89 | M204V+L180M | 6 | |
| M204V+L180M+T184S | 2(8) | ||
| ETV 1 mg/d, 12 | 无耐药突变 | 10(10) | |
| 患者5 | LAM+ETV 0.5 mg/d, 8 | M204V+L180M+G173L | 6 |
| M204V+L180M | 5(11) | ||
| ETV 1 mg/d, 16 | M204V+L180M+G173L | 10(10) | |
| ETV 1 mg/d, 44 | M204V+L180M+G173L | 7(7) |
患者3在LAM 62 wk时出现DNA反弹, 检测均为M204I+L80I(10/10)突变, 联合ADV治疗20 wk时恢复野生型(9/9), 虽然28 wk后DNA持续阴性, 但36、54 wk时仍检测到M204I+L80I(11/11)、M204V+L180M(10/10). 患者4停药4 wk时均为野生型(10/10), 再服LAM出现DNA反弹时以M204I为优势株(90%, 9/10), 联合ADV治疗22 wk时选择出M204I+L180M+L80I约56%(5/9)和M204I+L80I约44%(4/9). 患者6再次服LAM 48 wk时均为M204V+L180M+G173L(6/6), 换用ADV 70 wk后DNA反弹, 仍为M204V+L180M+G173L(10/10), 在ADV联合ETV 0.5 mg/d治疗36 wk时出现双重耐药株M204V+L180M+G173L+T184A(10%, 1/10). 患者7在LAM耐药时均为M204V+L180M+G173L(10/10), 在ADV治疗15 wk时出现10%(1/10)双重耐药株M204V+L180M+G173L+N236D, 48 wk时出现40%(4/10)的M204V+L180V+G173L.
HBV耐药是乙肝患者抗病毒治疗过程中最棘手的问题之一. HBV耐药的根源在于: HBV复制水平很高, 但由于其聚合酶缺乏校正功能, 因而复制过程中很容易参入错误碱基形成变异株. 这些变异株的特点各不相同, 在一个HBV感染者体内常形成以某一个优势株为主的相关突变株组成的病毒群称为准种, 他是一个不断变化的病毒群.
本研究除了患者2和3在LAM耐药后的序贯治疗过程中选择出野生株为优势株外, 其余5名患者仍以LAM耐药株为优势株, 且L180M与L80I分别伴随M204V及M204I出现, G173L多在M204V/I+L180M的基础上发生. 患者3联合ADV治疗后短期内恢复为野生株, 但随着用药时间的延长, LAM耐药株将再次被筛选出来, 并且呈动态演变, 36 wk时为M204I+L80I, 54 wk时为M204V+L180M. 患者1换用ETV后虽然DNA阴性, 但通过巢式PCR提高扩增效率, 仍检测到M204I+L180M+L80I和M204I+L80I耐药株. 患者5换用ETV治疗, 在DNA阴性后亦发现M204V+L180M+G173L耐药株, ETV耐药主要发生在LAM耐药基础上, M204V+L180M+G173L的存在增加了ETV耐药风险[4]. 这些耐药株影响HBV复制能力及对NAs的敏感性, 此3例患者虽然在目前随访中DNA仍保持阴性, 但从准种角度讲, 序贯治疗仍具有潜在的耐药风险, 对于这类患者将考虑从免疫学等角度进行综合治疗.
患者1、2、5在LAM耐药后最终都采用ETV治疗, 经ETV治疗后患者1和5仍能检测出LAM耐药株, 而患者2中M204V+L180M+T184S和M204V+L180M突变株则全部演变为野生型. 推测这可能与不同的变异株的复制性、对ETV的敏感性及宿主的免疫有关. 突变株M204V+L180M+T184S对ETV耐药, 但患者2经ETV治疗后病毒株却全部演变为野生型, 这提示ETV加倍剂量同时给予胸腺肽调节免疫治疗能更有效地抑制耐药病毒株的复制.
患者6在ADV联合ETV治疗、患者7在单用ADV序贯治疗过程中分别出现双重耐药株M204V+L180M+G173L+T184A和M204V+ L180M+G173L+N236D, N236D与ADV的耐药相关, 这与Yim等报道相似[5,6]. 这种双重耐药变异株可能导致HBV复制能力增强及对NAs敏感性降低, 容易导致序贯治疗的失败[7].
准种分析揭示了HBV以群体、动态的形式存在, 很多位点的改变是DNA复制过程中非特异的变异, 受内源(宿主免疫)和外源性(NAs)因素的影响, HBV的变异位点众多, 文中列出患者1、2、5的HBV逆转录酶区域与参考序列比对的所有不同"变异", 从中可发现患者1在联合ADV治疗时并无L180M变异, 但在换用LdT后57%的克隆上出现L180M, 目前尚无报道此位点与LdT耐药直接相关, 但是LdT与LAM同属左旋类核苷酸类似物, 所以在其作用下是否更容易筛选出L180M值得进一步观察. T184S/I与ETV耐药相关, 患者1和2在LAM联合ADV后分别出现T184I和T184S变异, 同样, 患者5在LAM耐药时11份克隆里有2份出现P237H, 有报道Q215H、P237H、N236D与ADV的耐药有关[5,8]. 推测这些患者在体内HBV仍复制的情况下, 药物作用更容易筛选出对其他NA耐药的突变, Gerolami等亦报道服用LAM时出现ADV耐药株A181V[9]. 另外患者2在LAM耐药时20%克隆为M204A, 推测可能是HBV复制过程的非特异突变, 与LAM耐药无关, 他不影响HBV复制能力及对NAs的敏感性, 因而在联合ADV治疗过程中能被完全抑制, 故联合治疗后M204A消失, 而只检测到M204V/I耐药突变. 患者7在ADV治疗48 wk时40%的突变株出现L180V, 他是否与耐药相关有待进一步实验验证. 另外, 从结果中可看出H55Q、C256S、E263D、S223A、I224V等位点突变率较高, 这些突变的临床意义还需要做体外表型实验来检测其对HBV复制能力及对NAs敏感性的影响[10].
总之, 本研究分析了7例LAM耐药患者序贯治疗后HBV准种的演变特点, 结果显示部分患者即使采用ADV、ETV等序贯治疗, LAM耐药突变仍不易消失, 即使DNA检测为阴性, 提高扩增效率仍可检测到耐药变异株, 即使短时间内HBV野生株恢复为优势株, 但随着用药时间的延长, 原耐药变异株仍然会被筛选出来, 甚至在此基础上筛选出交叉耐药株或多重耐药株. 因此, 一旦发生耐药, 将对序贯治疗产生持续的影响, 因而进一步说明对需抗病毒治疗的HBV感染者, 初始治疗尽可能选耐药率低的NAs.
拉米夫定(LAM)、阿德福韦酯(ADV)、恩替卡韦(ETV)、替比夫定(LdT)等核苷(酸)类似物(NAs)被广泛用于抗乙型肝炎病毒(HBV)治疗, 但长期服用NAs易使HBV聚合酶基因发生选择性耐药突变. 拉米夫定能够快速抑制HBV的复制, 但耐药发生率很高, 针对这些LAM耐药患者, 目前常用的有效补救治疗方案是联合ADV或换用ETV治疗. 在长期应用LAM治疗过程中HBV聚合酶基因会连续变异产生不同类型的耐药位点. 那么LAM耐药后的序贯治疗中HBV聚合酶基因耐药突变如何演变? 值得进一步深入研究.
王凯, 教授, 山东大学齐鲁医院肝病科
Gerolami等报道服用LAM时出现ADV耐药株A181V.
本文借鉴瘢痕研究中的凋亡增殖平衡观, 并结合胆道自身环境, 引入目前研究热点之一的炎症关键性核转录因子NF-κB, 取其下游凋亡因子, 从凋亡角度对胆道损伤愈合的独特性有了较为新颖的认识. 本文虽然没有花哨的检测手段, 但从实用角度讲, 免疫组织化学因其独到的组织定位以及节约标本量的优点而非常适合本实验. 另外, 文中所提出的ASBT对NF-κB信号通路的影响也是一大亮点. 这是作者总结大量相关文献后所提炼的一个非常值得探究的新课题.
对需抗病毒治疗的HBV感染者, 初始治疗尽可能选耐药率低的NAs.
本文选题明确, 具有一定的创新性, 方法简单可靠, 可重复性强, 较准确反映了研究工作的科学问题和特定内容.
编辑: 李瑞敏 电编:何基才
| 1. | Yim HJ. [Management of antiviral-resistant chronic hepatitis B virus infection]. Korean J Gastroenterol. 2008;51:346-359. [PubMed] |
| 2. | Yuen MF, Fung J, Wong DK, Lai CL. Prevention and management of drug resistance for antihepatitis B treatment. Lancet Infect Dis. 2009;9:256-264. [PubMed] [DOI] |
| 3. | Natsuizaka M, Hige S, Ono Y, Ogawa K, Nakanishi M, Chuma M, Yoshida S, Asaka M. Long-term follow-up of chronic hepatitis B after the emergence of mutations in the hepatitis B virus polymerase region. J Viral Hepat. 2005;12:154-159. [PubMed] [DOI] |
| 4. | Choe WH, Hong SP, Kim BK, Ko SY, Jung YK, Kim JH, Yeon JE, Byun KS, Kim KH, Ji SI. Evolution of hepatitis B virus mutation during entecavir rescue therapy in patients with antiviral resistance to lamivudine and adefovir. Antivir Ther. 2009;14:985-993. [PubMed] [DOI] |
| 5. | Bartholomeusz A, Locarnini SA, Ayres A, Thompson G, Sozzi V, Angus P. Molecular modelling of hepatitis Bvirus polymerase and adefovir resistance dentifies three clusters of mutations. Hepatology. 2004;40:246A. |
| 6. | Yim HJ, Hussain M, Liu Y, Wong SN, Fung SK, Lok AS. Evolution of multi-drug resistant hepatitis B virus during sequential therapy. Hepatology. 2006;44:703-712. [PubMed] [DOI] |
| 7. | Brunelle MN, Jacquard AC, Pichoud C, Durantel D, Carrouée-Durantel S, Villeneuve JP, Trépo C, Zoulim F. Susceptibility to antivirals of a human HBV strain with mutations conferring resistance to both lamivudine and adefovir. Hepatology. 2005;41:1391-1398. [PubMed] [DOI] |
| 8. | Bartholomeusz A, Locarnini SA. Antiviral drug resistance: clinical consequences and molecular aspects. Semin Liver Dis. 2006;26:162-170. [PubMed] [DOI] |
| 9. | Gerolami R, Bourliere M, Colson P, Halfon P, Borentain P, Henry M, Botta D, Thibault V, Khiri H, Tamalet C. Unusual selection of rtA181V HBV mutants cross-resistant to adefovir following prolonged lamivudine monotherapy: report of two cases. Antivir Ther. 2006;11:1103-1106. [PubMed] |
| 10. | Durantel D, Carrouée-Durantel S, Werle-Lapostolle B, Brunelle MN, Pichoud C, Trépo C, Zoulim F. A new strategy for studying in vitro the drug susceptibility of clinical isolates of human hepatitis B virus. Hepatology. 2004;40:855-864. [PubMed] |