修回日期: 2010-01-04
接受日期: 2010-01-04
在线出版日期: 2010-03-08
目的: 研究肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)诱导肝干细胞(WB细胞)凋亡及其信号转导机制.
方法: WB细胞经TNF-α诱导不同时间, 用流式细胞术(FCS)检测细胞凋亡及细胞周期改变; 用核酸提取及电泳技术检测细胞DNA的变化; 经Western blot检测TNF-α诱导WB细胞与凋亡有关分子的改变.
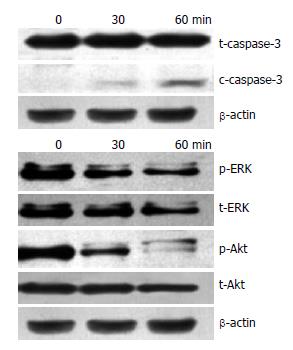
结果: TNF-α诱导WB细胞24 h, FCS发现51%细胞凋亡, 核酸电泳出现DNA "ladder"现象; 同时与细胞凋亡相关的转录因子NF-κB核内转移, 活化的凋亡蛋白酶caspase-3增多, 而与细胞增殖相关的信号转导途径被阻断-磷酸化的Erk/Akt水平下调.
结论: 经TNF-α诱导, 与凋亡相关的信号分子caspases-3被激活, 而与细胞增殖有关的信号途径被阻断(p-Erk/Akt)下调, 导致细胞可能发生增殖阻滞而凋亡.
引文著录: 余科科, 汪思应. TNF-α诱导肝干细胞凋亡及信号转导途径的改变. 世界华人消化杂志 2010; 18(7): 707-710
Revised: January 4, 2010
Accepted: January 4, 2010
Published online: March 8, 2010
AIM: To investigate the apoptosis-inducing effect of tumor necrosis factor-α (TNF-α) on hepatic stem cells (WB cells) and to elucidate the molecular mechanisms involved.
METHODS: After WB cells were incubated with TNF-α for different durations, cell apoptosis and cell cycle alterations were analyzed by flow cytometry; DNA alterations were tested by agarose gel electrophoresis; and signaling molecules related to cell proliferation and apoptosis were analyzed by Western blot and electrophoretic mobility shift assay (EMSA).
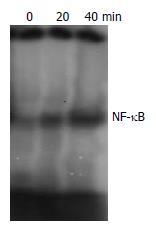
RESULTS: After treatment with TNF-α for 24 h, apoptosis was induced in 51% of WB cells, and the DNA was broken down into 180-200 bp fragments. Of all growth or apoptosis regulatory proteins examined, the levels of caspase-3 and activated NF-κB were found to be up-regulated after TNF-α treatment. Furthermore, TNF-α treatment could also induce Erk/Akt hypophosphorylation.
CONCLUSION: TNF-α induces growth inhibition and apoptosis of WB cells perhaps by up-regulating caspase-3 and activated NF-κB and inducing Erk/Akt hypophosphorylation.
- Citation: Yu KK, Wang SY. Tumor necrosis factor-α induces the apoptosis of hepatic stem cells by altering multiple signaling pathways. Shijie Huaren Xiaohua Zazhi 2010; 18(7): 707-710
- URL: https://www.wjgnet.com/1009-3079/full/v18/i7/707.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i7.707
病毒性肝炎是我国一个高发性传染病, 随着病程可发展为肝硬化、重症肝坏死、肝功能衰竭. 其病理特点是大块或亚大块肝细胞坏死, 残存肝细胞的增殖受多种因素的影响, 故依赖病变肝脏自身的能力引发肝再生有很大困难, 而传统的抗病毒及支持对症治疗无法使患者痊愈. 原位肝移植由于供肝缺乏、费用昂贵、可能存在免疫排斥问题等使临床受益者极少. 肝细胞移植及生物人工肝是治疗严重肝病的有效手段, 但自体肝细胞获取困难、增殖性差、细胞长期培养困难等又极大地制约了他们在临床的应用. 而干细胞具有向成熟肝细胞分化的潜能, 并参与肝功能重建[1,2], 即可以利用干细胞作为组织工程的启动细胞进行治疗性克隆扩增, 在肝脏结构与功能重建中发挥治疗作用, 这将给肝病治疗提供新的措施. 调查发现, 肝硬化、重症肝坏死患者血清TNF-α水平均有不同程度的升高并与病情呈正相关, 提示TNF-α含量与肝细胞坏死程度密切相关. TNF-α是否能诱导肝干细胞凋亡导致坏死的肝脏再生障碍而加重病情甚至导致患者死亡? 为明确TNF-α升高与肝干细胞凋亡之间的关系及可能的分子机制, 我们采用流式细胞术(flow cytometry, FCS)及Western blot、凝胶阻滞实验(electrophoretic mobility shift assay, EMSA)等实验方法检测细胞凋亡及凋亡相关途径的变化.
肝干细胞株(WB细胞)[3]我室保存. 培养条件为DMEM、100 mL/L胎牛血清, 50 mL/L CO2、37 ℃环境下培养. DMEM、胰酶为Gibco公司产品; 胎牛血清为Life Technologies公司产品; DNA提取试剂盒为Promega公司产品; TNF-α为Sigma公司产品; 抗体、HRP-羊抗鼠及羊抗兔IgG、ECL检测系统为Santa Cruz产品. [γ-32P]ATP购自北京亚辉生物医学工程公司, NF-κB双链寡核苷酸探针(由Promega公司提供)序列如下5'-AGT TGA GGG GAC TTT CCC AGG C-3', 3'-TCA ACT CCG CTG AAA GGG TCC G-5'.
1.2.1 TNF-α诱导细胞凋亡: WB细胞以1×108个/L培养于培养瓶, 细胞贴壁后, 换加入放线菌素(ActD)15 µg/L无血清培养液处理细胞30 min, 用20、40、80、100 µg/L TNF-α, 经不同时相(8、18、24 h)处理WB细胞, 对照组加等量生理盐水.
1.2.2 FCS检测细胞凋亡: 离心收集经TNF-α诱导的WB细胞1×106个, PBS洗2次, 用700 mL/L乙醇4 ℃固定细胞24 h, PBS洗2次, RNA酶消化, 37 ℃ 30 min, 加入PI染色, 4 ℃ 30 min流式细胞仪测定.
1.2.3 凋亡细胞的核酸电泳检测: 取经TNF-α诱导的WB细胞2×106个, 用含2 mmol/L EDTA、pH7.5的PBS离心洗2次(1 200 r/min), 弃上清, 加400 μL TBE(临用时加0.25% NP40), 10 μL RNase至1 g/L, 37 ℃, 30 min, 加蛋白酶K(1 g/L) 10 μL, 37 ℃, 30 min. 14 000 r/min, 4 ℃离心15 min, 收集上清(-70 ℃), 取上清50 μL, 加上样缓冲液5 μL, 1.5%琼脂糖凝胶电泳30 min, 紫外线透视仪下观察, 凋亡细胞出现DNA ladder.
1.2.4 EMSA: 细胞用预冷的PBS洗2次, 提取核蛋白液. NF-κB寡核苷酸(1.75 μmol/L)2 μL加10×T4多核苷酸激酶缓冲液1 μL, [γ-32P]ATP(111 TBq/mmol)1 μL, 无菌水5 μL, 最后加T4多核苷酸激酶(5-10 U/μL)1 μL, 37 ℃保温10 min, 再向反应体系中加入1 μL 0.5 mol/L EDTA终止反应. 核蛋白在DNA结合液(20 mmol/L Hepes pH7.9, 100 mmol/L KCl, 20% glycerol, 0.2 mmol/L EDTA, 0.5 mmol/L DTT, 0.5 mmol/L PMSF)与1 μL 32P标记的NF-κB寡核苷酸探针4 ℃反应20 min. 电泳、显影、定影、水洗、晾干.
1.2.5 Western blot: 提取细胞总蛋白, 100 μg蛋白经SDS-PAGE电泳, 电转至PVDF膜后浸入含50 g/L脱脂奶粉的TBST 4 ℃过夜, 加一抗(caspases-3/8、p-Akt/p-ERK)室温1 h, TBST洗4×10 min, 加HRP标记的相应二抗(1:5 000), 室温1 h, TBST洗4×10 min. ECL系统A、B液等体积混合, 均匀涂在PVDF膜上, 再将PVDF膜转移到保鲜膜并包裹好, X线片压片, 曝光60 s, 显影1 min, 定影5 min.
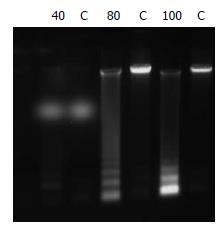
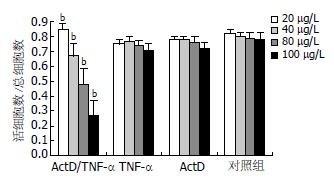
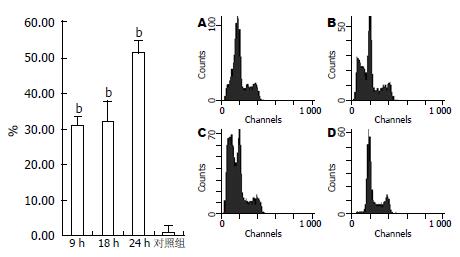
经ActD诱导, TNF-α为80、100 μg/L时细胞出现凋亡典型的DNA ladder, 即核酸经琼脂糖凝胶电泳呈现180-200 bp或其整倍数的"梯带"现象(图1), 当TNF-α为80 μg/L时凋亡率超过50%, 而对照组胞凋亡率低(图2). 80 μg/L TNF-α诱导WB细胞9、18、24 h, 凋亡细胞比例为31%、32%、51%, 对照组0.89%(图3).
干细胞分化发育的特异性是其自身特性和生存微环境联合作用的结果, 其中微环境起重要作用. 近期研究结果显示, 肝干细胞具有在组织器官中自我修复及再生能力, 在细胞活性因子如HGF[4,5]、TGF-α、EGF诱导下可以增生、定向分化为成熟肝实质细胞, 即细胞活性因子可能是调控肝干细胞分化的主要因素; 有研究发现干细胞表达TGF-α、aFGF、HGF、SCF的受体,表明生长因子可能通过自分泌和旁分泌方式调控他们的生长. 故我们认为肝脏微环境是调控肝干细胞生长发育的关键, 似乎只要给予肝脏再生的微环境, 干细胞就可以在体内分化成肝细胞. 因此, 模拟特定细胞分化的体内环境是诱导肝干细胞定向分化的关键所在.
在肝脏再生机制的研究中显示, 肝干细胞只有在肝脏严重损伤的病理情况下才产生应答并大量增殖, 参与肝脏的修复[6]. TNF-α是一种促炎性细胞因子, 在肝脏主要由激活的Kupffer细胞产生, 既能直接损伤肝细胞, 又能参与肝脏炎症、肝细胞再生等, 适量表达可激活NF-κB启动肝细胞增殖[7]; 如大量持续表达, 则会引起细胞凋亡, 延缓肝细胞再生[8,9]. 近年来研究发现TNF-α能引起肝细胞凋亡, 在暴发性肝衰竭中, TNF-α介导的肝细胞凋亡起很重要的作用. Takei等研究证实, TNF-α抗体可阻止半乳糖胺引起的肝细胞凋亡, 防止暴发性肝衰竭发生[10,11]. 持续升高的TNF-α是否也能诱导肝干细胞凋亡导致肝再生障碍? 通常肝细胞对TNF-α耐受, 在某些毒性因子致敏后, TNF-α则对肝细胞产生毒性作用. 本研究结果显示: 在给予放线菌素(ActD)一种人称"转录捕获"的RNA合成抑制剂的刺激后, TNF-α表现出细胞毒作用, 肝干细胞对刺激变得敏感导致凋亡. 通过对TNF-α不同剂量、不同时相诱导的WB细胞, 用流式细胞术(FCS)检测发现G2+M期细胞比例明显减少, 说明细胞增殖性减弱; 核酸电泳出现DNA ladder说明DNA被激活的核酸内切酶切割成180-200 bp或其整倍数的片段即凋亡信号途径被激活; 我们进一步采用Western blot在蛋白水平检测与细胞凋亡相关的信号转导途径的改变, 结果显示凋亡相关的caspase-3表达上调, 而与细胞增殖相关的MAPK、PI3K[12]信号途径中关键分子Erk和Akt的磷酸化水平下调, 导致细胞增殖阻滞, 发生凋亡. 另外, TNF-α还可激活NF-κB[13], 这是一种在调控细胞的生存和凋亡中起关键作用的调控因子. 我们的研究结果显示经TNF-α诱导的WB细胞20 min后即出现NF-κB核内转移. 而NF-κB持续活化可能促进细胞凋亡. 因此我们推测这些可能是导致坏死的肝脏再生障碍而加重病情甚至导致患者死亡的重要机制.
病毒性肝炎、肝硬化是临床常见病, 约10%的患者最终死于肝功能衰竭, 肝干细胞的生存和凋亡对肝损伤的修复及再生有重要意义[14,15], 肝干细胞移植将是解决供体肝脏严重缺乏的重要途径之一; 另外, 自体的肝干细胞移植能有效地避免排斥反应. 而合适的生长微环境或细胞因子对肝干细胞的自我更新和增殖有重要作用, 我们的研究结果提示对肝衰竭患者若辅以抗TNF-α治疗, 可能通过减少细胞凋亡, 提高细胞增生能力来增强肝再生.
肝功能衰竭目前还没有特效的治疗措施, 肝移植由于供体、价格等因素使其应用受到限制, 最近研究显示肝干细胞可能在肝脏结构与功能重建中发挥治疗作用.
洪天配, 教授, 北京大学第三医院内分泌科.
细胞因子作为炎症反应的重要载体与肝脏疾病的进展密切相关, 探索细胞因子在肝脏疾病发展以及干细胞移植治疗肝脏疾病是该研究领域的热点.
2007年Nguyen等报道肝细胞损害的反应中, 肝脏启动免疫应答机制, 分泌一系列细胞因子包括HGF、EGF等刺激卵圆细胞的增殖分化, 参与肝损伤的修复及肝细胞再生.
本文论述了研究TNF-α诱导肝干细胞(WB细胞)凋亡及其信号转导机制. 阐述细胞因子与肝干细胞的关系, 提出对肝衰竭患者若辅以抗TNF-α治疗, 可能通过减少细胞凋亡, 提高细胞增生能力增强肝再生.
本文选题尚可, 设计基本合理, 结果可信, 具有一定学术价值.
编辑: 李军亮 电编:何基才
| 1. | Abdel Aziz MT, Atta HM, Mahfouz S, Fouad HH, Roshdy NK, Ahmed HH, Rashed LA, Sabry D, Hassouna AA, Hasan NM. Therapeutic potential of bone marrow-derived mesenchymal stem cells on experimental liver fibrosis. Clin Biochem. 2007;40:893-899. [PubMed] [DOI] |
| 2. | Suzuki A, Zheng YW, Kaneko S, Onodera M, Fukao K, Nakauchi H, Taniguchi H. Clonal identification and characterization of self-renewing pluripotent stem cells in the developing liver. J Cell Biol. 2002;156:173-184. [PubMed] [DOI] |
| 3. | Presnell SC, Hooth MJ, Borchert KM, Coleman WB, Grisham JW, Smith GJ. Establishment of a functional HGF/C-MET autocrine loop in spontaneous transformants of WB-F344 rat liver stem-like cells. Hepatology. 1998;28:1253-1259. [PubMed] [DOI] |
| 4. | Li H, Jiang T, Lin Y, Zhao Z, Zhang N. HGF protects rat mesangial cells from high-glucose-mediated oxidative stress. Am J Nephrol. 2006;26:519-530. [PubMed] [DOI] |
| 5. | Fausto N, Campbell JS, Riehle KJ. Liver regeneration. Hepatology. 2006;43:S45-S53. [PubMed] [DOI] |
| 6. | Sell S. Heterogeneity and plasticity of hepatocyte lineage cells. Hepatology. 2001;33:738-750. [PubMed] [DOI] |
| 7. | Watanabe T, Jono H, Han J, Lim DJ, Li JD. Synergistic activation of NF-kappaB by nontypeable Haemophilus influenzae and tumor necrosis factor alpha. Proc Natl Acad Sci U S A. 2004;101:3563-3568. [PubMed] [DOI] |
| 10. | Takei Y, Okumura S, Nagal H. TNF-α induced apoptosis of hepatocyte precedes massive hepatic necrosis during the cause of acute hepatitis failure. Hepatology. 1995;22:380-390. [PubMed] [DOI] |
| 11. | Menon KV, Stadheim L, Kamath PS, Wiesner RH, Gores GJ, Peine CJ, Shah V. A pilot study of the safety and tolerability of etanercept in patients with alcoholic hepatitis. Am J Gastroenterol. 2004;99:255-260. [PubMed] [DOI] |
| 12. | Qiao L, Yacoub A, Studer E, Gupta S, Pei XY, Grant S, Hylemon PB, Dent P. Inhibition of the MAPK and PI3K pathways enhances UDCA-induced apoptosis in primary rodent hepatocytes. Hepatology. 2002;35:779-789. [PubMed] [DOI] |
| 13. | Basak S, Hoffmann A. Crosstalk via the NF-kappaB signaling system. Cytokine Growth Factor Rev. 2008;19:187-197. |