修回日期: 2010-02-01
接受日期: 2010-02-09
在线出版日期: 2010-03-08
目的: 探讨MIP-3α及其受体CCR6在实验性小鼠溃疡性结肠炎(UC)发病中的作用, 并分析Met-RANTES疗效机制.
方法: 用葡聚糖硫酸钠(DSS)诱导建立结肠炎小鼠模型, 观察Met-RANTES对小鼠结肠炎病活动指数(DAI)、大体形态评分(GMS)、结肠组织学病理评分(HPS)的影响; 并通过RT-PCR检测其对小鼠结肠组织MIP-3α、CCR6 mRNA的表达变化及Western blot和免疫组织化学方法检测其小鼠结肠组织MIP-3α、CCR6的蛋白表达变化.
结果: DAI、GMS和HPS在DSS模型组和生理盐水治疗组中高于空白对照组, MIP-3α和CCR6在小鼠溃疡性结肠炎中表达上调, 在小鼠空白对照组中不表达或弱阳性表达, 差异有统计学意义(P<0.01); 与DSS模型组和生理盐水治疗组相比, Met-RANTES治疗组小鼠DAI、GMS和HPS降低, MIP-3α和CCR6表达下调(mRNA: 0.21±0.08 vs 1.09±0.08, 1.08±0.07; 0.25±0.08 vs1.11±0.07, 1.05±0.08, P<0.01; 蛋白: 0.28±0.08 vs 0.98±0.07, 1.05±0.06; 0.25±0.07 vs 1.19±0.07, 1.15±0.06, P<0.01); 生理盐水治疗组小鼠DAI、GMS和HPS以及MIP-3α和CCR6表达与DSS模型组相比表达无明显差异(P>0.05).
结论: MIP-3α与CCR6参与了小鼠UC的发生、发展; Met-RANTES能下调MIP-3α及CCR6的表达, 并能减轻炎症损伤; 针对MIP-3α或CCR6的靶向治疗可能是UC一种有效的治疗方法.
引文著录: 张海峰, 钟万锷, 周国雄, 丁晓凌, 黄华. Met-RANTES干预实验性小鼠溃疡性结肠炎对MIP-3α及其受体CCR6的影响. 世界华人消化杂志 2010; 18(7): 657-663
Revised: February 1, 2010
Accepted: February 9, 2010
Published online: March 8, 2010
AIM: To investigate the role of macrophage inflammatory protein-3α (MIP-3α) and chemokine receptor 6 (CCR6) in the pathogenesis of ulcerative colitis (UC) and to explore the mechanism of therapeutic effect of Met-RANTES against UC.
METHODS: Forty mice were randomly and equally divided into four groups: blank control group, model control group, normal saline group, and Met-RANTES treatment group. Ulcerative colitis was induced in mice by giving dextran sodium sulfate (DSS). The impact of Met-RANTES on disease activity index (DAI), gross morphological score (GMS) and histopathological score (HPS) in UC was then evaluated. The expression of MIP-3α and CCR6 mRNAs was measured by reverse transcription-polymerase chain reaction (RT-PCR). The expression of MIP-3α and CCR6 proteins was examined by Western blot and immunohistochemistry.
RESULTS: The DAI, GMS and HPS were higher in the model control group and the normal saline group than in the blank control group. The expression levels of MIP-3α and CCR6 mRNAs and proteins in UC were significantly higher in the model control group and the normal saline group than in the blank control group (all P < 0.01). The DAI, GMS and HPS as well as the expression levels of MIP-3α and CCR6 mRNAs and proteins in the Met-RANTES treatment group were significantly lower than those in the model control group and the normal saline group (mRNA: 0.21 ± 0.08 vs 1.09 ± 0.08 and 1.08 ± 0.07, and 0.25 ± 0.08 vs 1.11 ± 0.07 and 1.05 ± 0.08; protein: 0.28 ± 0.08 vs 0.98 ± 0.07 and 1.05 ± 0.06, and 0.25 ± 0.07 vs 1.19 ± 0.07 and 1.15 ± 0.06; all P < 0.01). In contrast, no statistical differences were noted in DAI, GMS and HPS as well as the expression levels of MIP-3α and CCR6 mRNAs and proteins between the model control group and the normal saline group (all P > 0.05).
CONCLUSION: The expression of MIP-3α and its receptor CCR6 is up-regulated in UC, which is closely related with the development and progression of UC. Met-RANTES can down-regulate the expression of MIP-3α and CCR6 and ameliorate inflammatory damage in mice with UC. MIP-3α and CCR6 may represent novel pharmacological targets for treatment of UC.
- Citation: Zhang HF, Zhong WE, Zhou GX, Ding XL, Huang H. Met-RANTES down-regulates the expression of MIP-3α and CCR6 in the colon of mice with experimental ulcerative colitis. Shijie Huaren Xiaohua Zazhi 2010; 18(7): 657-663
- URL: https://www.wjgnet.com/1009-3079/full/v18/i7/657.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i7.657
溃疡性结肠炎(ulcerative colitis, UC)是一种病因和发病机制不明的炎症性肠病(inflammatory bowel disease, IBD). 目前认为其发病可能与遗传、免疫、感染及精神等多因素相互作用有关, 而免疫学因素是UC研究中的热点. UC在欧美国家较多见, 近年来我国发病率不断上升[1]. 在治疗上, 除传统的水杨酸类、糖皮质激素和免疫抑制剂药物以外, 新的治疗方法包括生物制剂不断出现, 但未能取得突破性进展, 很多方法还停留在实验室阶段. 通过阻断有关趋化因子或(和)阻断趋化因子受体来间接阻断趋化因子从而阻止炎症细胞募集到炎症部位是一种新的抗炎策略[2-8]. 我们以趋化因子拮抗剂Met-RANTES干预葡聚糖硫酸钠(DSS)诱导的小鼠UC, 探索MIP-3α及其受体CCR6在UC中的作用, 并探讨Met-RANTES疗效可能机制.
Balb/c小鼠, ♀, 40只, 周龄4-6 wk, 体质量14-20 g, 购自南通大学动物实验中心(屏障环境); Met-RANTES, R&D公司提供.
1.2.1 UC模型建立: 造模前小鼠在动物房屏障环境饲养1 wk, 按Stevceva等[9]的方法, 将40只Balb/c小鼠随机分为空白对照组、DSS模型对照组、生理盐水治疗组和Met-RANTES治疗组. 空白对照组饮用蒸馏水饮7 d. DSS模型对照组、生理盐水治疗组和Met-RANTES治疗组饮用50 g/L DSS溶液(5 mg DSS溶于100 mL蒸馏水)7 d, 建立急性期UC模型; DSS模型对照组未给予任何治疗; 趋化因子拮抗剂Met-RANTES治疗组从给DSS第3天开始给予Met-RANTES(20 μg溶于0.5 mL PBS中, ip, qd), 共5 d; 生理盐水治疗组小鼠从给DSS第3天开始给予生理盐水(0.5 mL, ip, qd), 共5 d. 第8天用颈椎脱臼法处死所有小鼠. 采集小鼠结肠标本备检.
1.2.2 症状体征观察及评分: 造模过程中每日观察小鼠体质量变化、大便性状、便血等情况. 参照Murano等[10]所列标准进行评分, 疾病活动指数(DAI) = (体质量下降分数+大便性状分数+便血分数)/3. DAI评分标准: 无体质量下降、大便性状正常、无便血分别记为0分; 体质量下降1%-5%记为1分; 体质量下降5%-10%、半稀便、大便隐血(+)分别记为2分; 体质量下降10%-15%记为3分; 体质量下降>15%、稀便、便血分别记为4分.
1.2.3 大体形态评分: 小鼠以颈椎脱臼法处死后, 立即开腹分离结肠, 沿肠系膜剪开肠腔, 祛除大便, 生理盐水冲洗数次, 观察大体形态改变, 参照下列标准进行评分: 无损伤为0分; 黏膜充血为1分; 溃疡面积<受损面积的25%为2分; 溃疡面积 = 受损面积的25%-50%为3分; 溃疡面积>受损面积的50%为4分.
1.2.4 组织学评分: 取病变明显处组织, 常规石蜡包埋、切片、HE染色, 观察组织学改变, 参照Boirivant[11]所列标准进行盲法评分: 正常记为0分; 极低白细胞浸润, <10% hpf记为1分; 少量白细胞浸润, 10%-25% hpf记为2分; 中量白细胞浸润, 25%-50% hpf, 同时伴血管密集和肠壁增厚记为3分; 大量白细胞浸润, >50% hpf, 血管高度密集, 隐窝变形、扭曲, 肠壁肿胀伴溃疡记为4分.
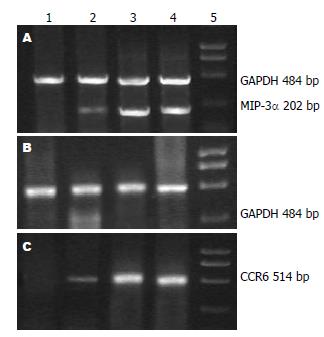
1.2.5 逆转录-聚合酶链反应(RT-PCR)测定MIP-3α、CCR6: 提取总RNA然后逆转录反应合成cDNA, 取5 μL cDNA用于PCR扩增. 以GAPDH为内参照. GAPDH、MIP-3α和CCR6引物由上海生工生物科技公司设计并合成. GAPDH引物系列如下: 上游引物为5'-ATG GGA AGC TGG TCA TCA AC-3', 下游引物为5'TTC AGC TCT GGG ATG ACC TT-3', 扩增长度484 bp. MIP-3Α上游引物为5'-AGC AGC AAG CAA CTA CGA CT-3', 下游引物为5'-TCT TAG GCT GAG GAG GTT CA-3', 扩增长度202 bp. CCR6上游引物为5'-GGT CAA CTT TAA CTG TGG GAT G-3', 下游引物为5'-GGT GTA GGC GAG GAC TTT CT-3', 扩增长度514 bp. MIP-3α 94 ℃预变性3 min, 94 ℃变性30 s, 56 ℃退火30 s, 72 ℃延伸40 s, 循环34次, 72 ℃延伸7 min. CCR6和GAPDH扩增反应步骤同上, 58 ℃退火30 s. 扩增后取PCR产物作1.5 g/L琼脂糖凝胶电泳. 用"凝胶分析系统"对条带作半定量分析, 读取其积分吸光度值(IA值), 以MIP-3α及CCR6平均IA值/GAPDH平均IA值来表示MIP-3α及CCR6相对表达强度.
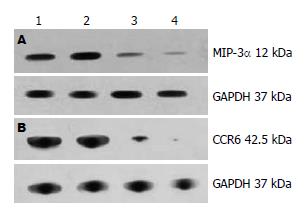
1.2.6 Western blot检测MIP-3α、CCR6蛋白表达: 提取总蛋白, 紫外分光光度法测定总蛋白浓度, 制备10 g/L十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE), 蛋白上样量每孔20 μL, 在垂直电泳槽中电泳后转膜至硝酸纤维素膜上, 5% TBST封闭4 h, 加入稀释的MIP-3α、CCR6一抗(工作浓度1:300)4 ℃孵育过夜. TBST洗膜10 min×3次, 加入稀释的二抗(工作浓度1:15 000)孵育3 h, ECL荧光试剂显影. 以GAPDH为内参照, 凝胶成像分析系统处理数据, 以MIP-3α或CCR6与内参照的灰度比值作为MIP-3α或CCR6蛋白的相对表达量.
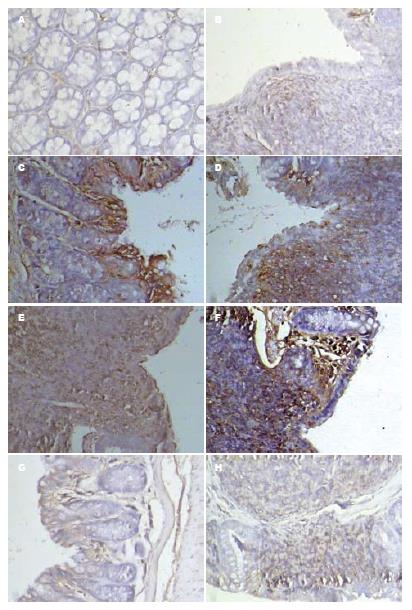
1.2.7 免疫组织化学法检测MIP-3α、CCR6蛋白表达: 采用Elivison二步法. MIP-3α工作浓度15 mg/L, CCR6工作浓度1:300, 二抗工作浓度1:500, 具体步骤参照试剂盒说明书, 光学显微镜下观察蛋白表达. 结果判断[12]: 胞膜或胞质中呈棕黄色或褐色颗粒状物者为阳性细胞. 每张切片随机选取4个高倍视野, 分别根据染色强度和阳性细胞比例进行评分, 总分为两者之积. 染色强度: 0分, 无棕黄色颗粒; 1分, 淡黄色颗粒; 2分, 深棕色颗粒; 3分, 大量深棕色或褐色颗粒. 阳性细胞比例: 0分, 阴性; l分, 1%-25%; 2分: 26%-50%; 3分, 51%-75%; 4, 76%-100%.
统计学处理 数据以mean±SD表示, 用STATA10.0统计软件进行t检验, 方差分析, P<0.05有统计学意义.
空白对照组小鼠饮食、活动及大便性状正常, 毛色光泽, 体质量略有增加. 各造模组小鼠造模后第1天开始出现厌食、活动减少、坚毛、大便表现为稀便或半成形不黏肛便, 体质量减轻; 第3天开始出现便血或大便隐血[(+)-(++)]; 体质量减轻更加明显; 趋化因子拮抗剂Met-RANTES治疗组, 给药后饮食、体质量逐渐增加、毛色逐渐恢复光泽, 便血或大便隐血逐渐减少至消失或隐血(±-+), DSS模型对照组和生理盐水治疗组与空白对照组相比, DAI评分明显增高, 差异有统计学意义(均P<0.01); 生理盐水治疗组小鼠与DSS模型对照组小鼠DAI评分差异无统计学意义(P>0.05); 趋化因子拮抗剂Met-RANTES治疗组与DSS模型对照组和生理盐水治疗组对比, DAI明显下降, 差异有统计学意义(均P<0.01); Met-RANTES治疗组与空白对照组相比, 差异有统计学意义(P<0.05, 表1).
空白对照组小鼠结肠黏膜无充血水肿、糜烂及溃疡形成, 两只远端结肠黏膜轻度充血. DSS模型对照组, 生理盐水治疗组小鼠结肠黏膜充血水肿、糜烂及少许浅表溃疡形成, 病变连续存在. Met-RANTES治疗组结肠黏膜轻度充血水肿, 无糜烂及溃疡形成(表1).
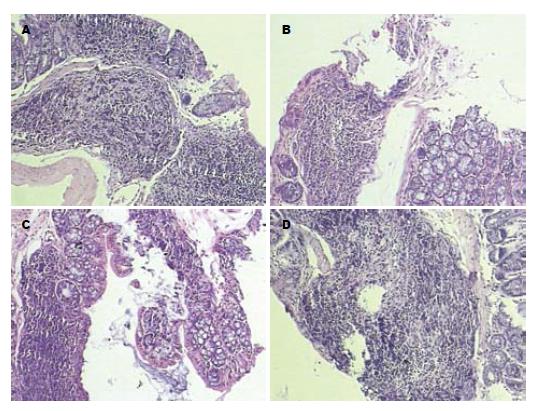
空白对照组小鼠结肠黏膜上皮完整, 固有层腺体形态正常、排列整齐, 黏膜及黏膜下层可见少量炎症细胞浸润, 未见糜烂及溃疡(图1A). DSS模型对照组, 生理盐水治疗组小鼠结肠黏膜上皮损伤、缺失、糜烂及溃疡形成, 固有层腺体变形、排列紊乱, 黏膜及黏膜下层可见密集分布的淋巴细胞和单核细胞浸润, 亦可见少量中性中性粒细胞浸润, 偶见淋巴滤泡形成(图1B, C). Met-RANTES治疗组结肠黏膜可见炎症细胞浸润, 程度较DSS模型组和生理盐水治疗组轻, 未见明显糜烂及溃疡(图1D, 表1).
空白对照组MIP-3α、CCR6 mRNA微弱表达; DSS模型对照组和生理盐水治疗组MIP-3α、CCR6 mRNA表达上调, 明显高于空白对照组(P<0.01); RANTES治疗组MIP-3α、CCR6 mRNA表达上调, 幅度较DSS模型组和生理盐水治疗组明显降低, 与空白对照组、DSS模型组及生理盐水治疗组相比差异有统计学意义(P<0.05或0.01, 表2, 图2).
| 分组 | mRNA | 蛋白 | 免疫组织化学评分(分) | |||
| MIP-3α | CCR6 | MIP-3α | CCR6 | MIP-3α | CCR6 | |
| 空白对照组 | 0.09±0.06 | 0.11±0.06 | 0.08±0.06 | 0.07±0.06 | 0.51±0.38 | 0.61±0.47 |
| DSS模型对照组 | 1.09±0.08bd | 1.11±0.07bd | 0.98±0.07bd | 1.19±0.07bd | 4.17±0.46bd | 5.01±1.05bd |
| 生理盐水治疗组 | 1.08±0.07bd | 1.05±0.08bd | 1.05±0.06bd | 1.15±0.06bd | 4.37±0.76bd | 5.05±1.09bd |
| met-RATES治疗组 | 0.21±0.08ad | 0.25±0.08ad | 0.28±0.08ad | 0.25±0.07ad | 2.65±0.32ad | 2.62±0.48ad |
空白对照组MIP-3α、CCR6蛋白微弱表达; DSS模型对照组和生理盐水治疗组MIP-3α、CCR6蛋白表达上调, 明显高于空白对照组(P<0.01); Met-RANTES治疗组MIP-3α、CCR6蛋白表达上调, 幅度较DSS模型组和生理盐水治疗组明显降低, 与DSS模型对照组和生理盐水治疗组比较(P<0.01); Met-RANTES治疗组MIP-3α、CCR6蛋白表达与空白对照组相比(P<0.05, 表2, 图3).
对照组MIP-3α、CCR6不表达或仅弱阳性表达; DSS模型组和生理盐水治疗组MIP-3α、CCR6表达上调, 明显高于对照组(均P<0.01); Met-RANTES治疗组MIP-3α、CCR6表达上调, 幅度较DSS模型组和生理盐水治疗组明显降低(均P<0.01); Met-RANTES治疗组MIP-3α、CCR6蛋白表达与对照组相比有明显差异(均P<0.05, 表2, 图4).
趋化因子是一类促炎细胞因子, 趋化因子通过其相应受体对多种细胞如淋巴细胞、中性粒细胞、单核细胞、树突状细胞(DC)等的趋化作用而在多种疾病的免疫反应和炎症损伤中发挥重要作用. MIP-3α通过其受体CCR6的作用趋化未成熟树突状细胞进入结肠黏膜, 同时活化和趋化淋巴细胞[13,14]. 在UC中, 肠上皮细胞能吸引中性粒细胞和淋巴细胞等炎症细胞到受累肠黏膜表面, 并释放细胞因子, 在细胞因子IL-1α、TNF-α等的作用下NF-κB表达上调, NF-κB进一步上调MIP-3α以及CCR6的表达[15]. 从而使更多的imDC和趋化淋巴细胞聚集于受累肠壁, 使炎症进一步加重. DC是一类专职抗原呈递细胞, 具有强大的抗原呈递和处理功能. 成熟树突状细胞可以激活T淋巴细胞发生免疫反应并表达重要的共剌激分子如CD80、CD86、CD83、CD54和CD40等[16]. 尽管产生炎症的原因各不相同, 但最终导致炎症的途径是由CD4 T细胞分化的辅助性T细胞1(Th1)或Th2所介导. UC通常被认为是Th2介导的肠道黏膜炎症.
Met-RANTES是CC亚族趋化因子拮抗剂, 通过重组人RANTES(regulated on activation, normal T-cell expressed and secreted), 在RANTES的NH2端加上蛋氨酸(met)修饰后得到RANTES的类似物Met-RANTES(me-thionylated RANTES). 研究发现, Met-RANTES是人CCR1的有效拮抗剂, 同时也具有拮抗CCR5的作用[17-20], 可以竞争性结合趋化因子受体而抑制RANTES和MIP-1α的趋化作用, 特异性抑制其对单核细胞, 嗜酸性粒细胞和T细胞趋化作用. Uchida等[21]在小鼠气管移植实验中发现, 给予Met-RANTES能减轻气道闭塞和下调细胞外信号调节酶的表达. Bhatia等[22]研究发现在蛙皮素诱导的急性胰腺炎模型中给予Met-RANTES可以明显减轻肺损害. 均提示Met-RANTES具有广泛的生物学作用.
在一些慢性炎症性疾病中, 趋化因子靶向治疗逐渐被学术界关注, 许多趋化因子和他们的受体已被成功地作为靶向治疗干预. Hyun等[23]在小鼠大肠炎动物模型研究表明: 在大肠炎的发展阶段, 给予IP-10单克隆抗体能减轻临床症状和组织损伤、减少IP-10 mRNA的表达以及减少单核细胞在淋巴结和结肠的累积. Rivera-Nieves等[24]通过自发鼠类动物模型研究发现, 在慢性回肠炎早期CCR9表达增多; CCL25, 即胸腺表达的趋化因子(TECK), 表达局限于小肠; 给予抗体阻断CCL25/CCR9能减轻早期慢性鼠类回肠炎, 而在后期阶段由于CCR9表达下降, 治疗效果不佳. Kucuk等[25]研究表明在小鼠实验性结肠炎模型中给予Met-RANTES治疗可以明显减少结肠黏膜的损害同时可以抑制肠道内细菌的移位. 我们的研究发现, 在DSS诱导的小鼠结肠炎模型中, MIP-3α及其受体CCR6表达明显上调, 在空白对照组小鼠不表达或弱阳性表达. 在DSS诱导的小鼠结肠炎模型中通过给予趋化因子拮抗剂Met-RANTES, 小鼠临床症状较DSS模型对照组和生理盐水治疗组明显减轻, MIP-3α与CCR6表达显著下调. CCR6作为MIP-3α的受体, 其表达情况与MIP-3α的表达情况相一致, 提示MIP-3α和CCR6在UC的发病中扮演重要作用, 且Met-RANTES对UC有治疗作用, 其机制可能是通过拮抗MIP-3α和CCR6来实现的. 但Met-RANTES治疗组小鼠和正常空白对照组相比, MIP-3α、CCR6的表达是上调的, 差异有统计学意义, 推测其原因可能为在给予Met-RANTES时候, 同时也在给予DSS; 其次, Met-RANTES不是MIP-3α和CCR6的特异拮抗剂; Met-RANTES的给予剂量也有待进一步探索. Met-RANTES在UC中的作用还不完全清楚, 深入研究Met-RANTES在UC中的作用以及其与MIP-3α、CCR6的相互关系将给UC治疗带来希望.
我们认为, MIP-3α、CCR6在UC的发病发展中起着重要作用, Met-RANTES具有拮抗MIP-3α、CCR6的活性并对UC有治疗作用. 因此, 通过拮抗炎症因子的活性来减轻炎症损伤并达到治疗目的, 是一种可行的UC治疗方法, 但是寻找安全有效的炎症因子拮抗剂, 仍需要进一步研究.
随着我国人民经济、生活水平的提高, 其生活方式、饮食结构发生巨大变化, 因此我国炎症性肠病特别是UC的发病率明显上升. 但UC的病因和发病机制尚不清楚, 故迫切需要对其进行相关研究.
邵先玉, 主任医师, 泰山医学院附属医院消化内科.
目前认为细胞因子网络调控的失衡可能是导致肠黏膜多种病理改变的关键, 在UC发病发展中起着重要作用. 以趋化因子及其受体分子为控制靶点, 通过激活或拮抗趋化因子受体的信号传导来调控趋化因子系统的功能, 从而探索治疗UC的方法已逐渐为学术界所关注.
Bhatia等研究发现在蛙皮素诱导的急性胰腺炎模型中给予Met-RANTES可以明显减轻肺损害. 均提示Met-RANTES具有广泛的生物学作用.
本研究通过Met-RANTES阻断MIP-3α及其受体CCR6从而阻止炎症细胞募集到炎症部位, 是一种新的抗炎策略, 以探索细胞因子在UC中的作用, 并探讨Met-RANTES疗效可能机制.
MIP-3α与CCR6参与了小鼠UC的发生、发展; Met-RANTES能下调MIP-3α及CCR6的表达, 并能减轻炎症损伤; 针对MIP-3α或CCR6的靶向治疗可能是UC一种有效的治疗方法.
本文探索MIP-3α及其受体CCR6 在UC中的作用, 并探讨Met-RANTES疗效机制, 有一定的科研和临床意义.
编辑: 李瑞敏 电编:吴鹏朕
| 1. | Jiang XL, Cui HF. An analysis of 10218 ulcerative colitis cases in China. World J Gastroenterol. 2002;8:158-161. [PubMed] |
| 2. | Autschbach F, Giese T, Gassler N, Sido B, Heuschen G, Heuschen U, Zuna I, Schulz P, Weckauf H, Berger I. Cytokine/chemokine messenger-RNA expression profiles in ulcerative colitis and Crohn's disease. Virchows Arch. 2002;441:500-513. [PubMed] [DOI] |
| 3. | Pannellini T, Iezzi M, Di Carlo E, Eleuterio E, Coletti A, Modesti A, Rosini S, Neri M, Musiani P. The expression of LEC/CCL16, a powerful inflammatory chemokine, is upregulated in ulcerative colitis. Int J Immunopathol Pharmacol. 2004;17:171-180. [PubMed] |
| 4. | Carlsen HS, Baekkevold ES, Morton HC, Haraldsen G, Brandtzaeg P. Monocyte-like and mature macrophages produce CXCL13 (B cell-attracting chemokine 1) in inflammatory lesions with lymphoid neogenesis. Blood. 2004;104:3021-3027. [PubMed] [DOI] |
| 5. | Yang SK, Choi MS, Kim OH, Myung SJ, Jung HY, Hong WS, Kim JH, Min YI. The increased expression of an array of C-X-C and C-C chemokines in the colonic mucosa of patients with ulcerative colitis: regulation by corticosteroids. Am J Gastroenterol. 2002;97:126-132. [PubMed] [DOI] |
| 6. | Papadakis KA, Prehn J, Zhu D, Landers C, Gaiennie J, Fleshner PR, Targan SR. Expression and regulation of the chemokine receptor CXCR3 on lymphocytes from normal and inflammatory bowel disease mucosa. Inflamm Bowel Dis. 2004;10:778-788. [PubMed] [DOI] |
| 7. | Buanne P, Di Carlo E, Caputi L, Brandolini L, Mosca M, Cattani F, Pellegrini L, Biordi L, Coletti G, Sorrentino C. Crucial pathophysiological role of CXCR2 in experimental ulcerative colitis in mice. J LeukocBiol. 2007;82:1239-1246. [PubMed] [DOI] |
| 8. | Fernandez EJ, Lolis E. Structure, function, and inhibition of chemokines. Annu Rev Pharmacol Toxicol. 2002;42:469-499. [PubMed] [DOI] |
| 9. | Stevceva L, Pavli P, Husband AJ, Doe WF. The inflammatory infiltrate in the acute stage of the dextran sulphate sodium induced colitis: B cell response differs depending on the percentage of DSS used to induce it. BMC Clin Pathol. 2001;1:3. [PubMed] [DOI] |
| 10. | Murano M, Maemura K, Hirata I, Toshina K, Nishikawa T, Hamamoto N, Sasaki S, Saitoh O, Katsu K. Therapeutic effect of intracolonically administered nuclear factor kappa B (p65) antisense oligonucleotide on mouse dextran sulphate sodium (DSS)-induced colitis. Clin Exp Immunol. 2000;120:51-58. [PubMed] [DOI] |
| 11. | Boirivant M, Fuss IJ, Ferroni L, De Pascale M, Strober W. Oral administration of recombinant cholera toxin subunit B inhibits IL-12-mediated murine experimental (trinitrobenzene sulfonic acid) colitis. J Immunol. 2001;166:3522-3532. [PubMed] |
| 12. | Koga H, Sakisaka S, Ohishi M, Kawaguchi T, Taniguchi E, Sasatomi K, Harada M, Kusaba T, Tanaka M, Kimura R. Expression of cyclooxygenase-2 in human hepatocellular carcinoma: relevance to tumor dedifferentiation. Hepatology. 1999;29:688-696. [PubMed] [DOI] |
| 13. | Banks C, Bateman A, Payne R, Johnson P, Sheron N. Chemokine expression in IBD. Mucosal chemokine expression is unselectively increased in both ulcerative colitis and Crohn's disease. J Pathol. 2003;199:28-35. [PubMed] [DOI] |
| 14. | Watanabe S, Yamakawa M, Hiroaki T, Kawata S, Kimura O. Correlation of dendritic cell infiltration with active crypt inflammation in ulcerative colitis. Clin Immunol. 2007;122:288-297. [PubMed] [DOI] |
| 15. | Izadpanah A, Dwinell MB, Eckmann L, Varki NM, Kagnoff MF. Regulated MIP-3alpha/CCL20 production by human intestinal epithelium: mechanism for modulating mucosal immunity. Am J Physiol Gastrointest Liver Physiol. 2001;280:G710-G719. [PubMed] |
| 16. | Jin Y, Fuller L, Ciancio G, Burke GW 3rd, Tzakis AG, Ricordi C, Miller J, Esquenzai V. Antigen presentation and immune regulatory capacity of immature and mature-enriched antigen presenting (dendritic) cells derived from human bone marrow. Hum Immunol. 2004;65:93-103. [PubMed] [DOI] |
| 17. | Oki M, Ohtani H, Kinouchi Y, Sato E, Nakamura S, Matsumoto T, Nagura H, Yoshie O, Shimosegawa T. Accumulation of CCR5+ T cells around RANTES+ granulomas in Crohn's disease: a pivotal site of Th1-shifted immune response? Lab Invest. 2005;85:137-145. [PubMed] |
| 18. | Matsuzaki K, Hokari R, Kato S, Tsuzuki Y, Tanaka H, Kurihara C, Iwai A, Kawaguchi A, Nagao S, Itoh K. Differential expression of CCR5 and CRTH2 on infiltrated cells in colonic mucosa of patients with ulcerative colitis. J Gastroenterol Hepatol. 2003;18:1081-1088. [PubMed] [DOI] |
| 19. | Kiss DL, Longden J, Fechner GA, Avery VM. The functional antagonist Met-RANTES: a modified agonist that induces differential CCR5 trafficking. Cell Mol Biol Lett. 2009;14:537-547. [PubMed] [DOI] |
| 20. | Akyildiz H, Akcan A, Sozuer E, Kucuk C, Yilmaz N, Deniz K. The preventive effect of Met-RANTES on postoperative intraperitoneal adhesion formation in the rat model. Surgery. 2008;144:404-409. [PubMed] [DOI] |
| 21. | Uchida O, Kajiwara N, Hayashi A, Miyajima K, Nagatsuka T, Hayashi H, Taira M, Kimura M, Tsuboi M, Kato H. Met-RANTES ameliorates fibrous airway obliteration and decreases ERK expression in a murine model of bronchiolitis obliterans. Ann Thorac Cardiovasc Surg. 2007;13:82-86. [PubMed] |
| 22. | Bhatia M, Proudfoot AE, Wells TN, Christmas S, Neoptolemos JP, Slavin J. Treatment with Met-RANTES reduces lung injury in caerulein-induced pancreatitis. Br J Surg. 2003;90:698-704. [PubMed] [DOI] |
| 23. | Hyun JG, Lee G, Brown JB, Grimm GR, Tang Y, Mittal N, Dirisina R, Zhang Z, Fryer JP, Weinstock JV. Anti-interferon-inducible chemokine, CXCL10, reduces colitis by impairing T helper-1 induction and recruitment in mice. Inflamm Bowel Dis. 2005;11:799-805. [PubMed] [DOI] |
| 24. | Rivera-Nieves J, Ho J, Bamias G, Ivashkina N, Ley K, Oppermann M, Cominelli F. Antibody blockade of CCL25/CCR9 ameliorates early but not late chronic murine ileitis. Gastroenterology. 2006;131:1518-1529. [PubMed] [DOI] |