修回日期: 2010-01-03
接受日期: 2010-01-11
在线出版日期: 2010-02-28
目的: 探讨内源性硫氧还蛋白-1(Trx-1)在急性坏死性胰腺炎(ANP)大鼠模型肺组织中的表达; 观察褪黑素对ANP胰和肺脏的保护作用和对肺组织Trx-1表达的影响.
方法: 将72只SD大鼠随机分成对照组(C组, n = 24)、急性胰腺炎组(A组, n = 24)、褪黑素前干预组(M组, n = 24). A组用6%的左旋精氨酸(L-Arginine, L-Arg)腹腔内注射, 每次25 mL/kg体质量, 共3次, 注射间隔1 h, 诱导ANP模型, 在首次注射L-Arg前30 min腹腔注射生理盐水20 mL/kg体质量1次; C组同法注射相当于A组各次注射用量的等容积生理盐水; M组在诱导胰腺炎前30 min腹腔内注射0.25%褪黑素(20 mL/kg体质量)干预. 在注射完L-Arg后的6、12、24 h三个时点分批处死大鼠, 应用免疫组织化学技术检测各组ANP肺组织Trx-1的表达, 并观察各组对应各时点胰腺、肺组织病理学和肺免疫组织化学的改变; 抽取动脉血测定Trx-1和淀粉酶.
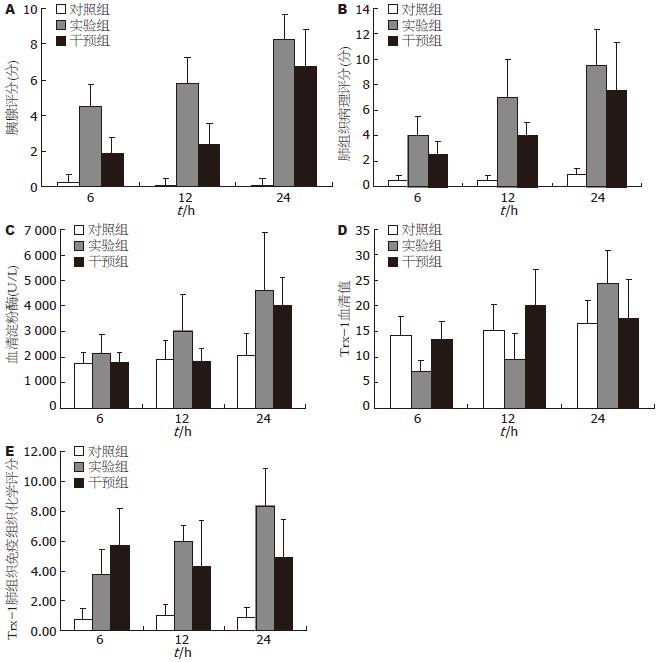
结果: A组大鼠胰腺和肺组织病理损伤在6、12、24 h时点比C组明显加重(均P<0.01); M组胰腺和肺组织病理损伤在6、12、24 h时点较A组明显减轻(P<0.01或0.05). A组、M组肺组织表达Trx-1量在6、12、24 h时点较C组显著升高(均P<0.01). 在24 h, A组血清淀粉酶较C组显著升高(4 598 U/L±2 274 U/L vs 2 033 U/L±863 U/L, P<0.01); M 组较A组低(3 990 U/L±1 146 U/L vs 4 598 U/L±2 274 U/L, P<0.05). A组大鼠血清Trx-1含量在6、12 h时点显著降低, 24 h时点显著升高, 呈前低后高趋势; 与A组比较, M组血清Trx-1在6、12 h时点显著升高, 24 h时点显著降低, 量的峰值前移.
结论: Trx-1在ANP肺损伤组织中的过度表达与急性胰腺炎相关性肺损伤关系密切. 褪黑素影响Trx-1表达, 并可能在一定程度上减轻ANP的胰、肺组织损伤.
引文著录: 牛桂军, 唐国都, 梁志海, 钟卫一, 黄文福. 硫氧还蛋白-1在急性坏死性胰腺炎大鼠肺组织中的表达及褪黑素干预的影响. 世界华人消化杂志 2010; 18(6): 550-556
Revised: January 3, 2010
Accepted: January 11, 2010
Published online: February 28, 2010
AIM: To investigate the expression of thioredoxin-1 (Trx-1) in the lungs of rats with L-arginine (L-Arg)-induced acute necrotizing pancreatitis (ANP) and assess the effects of melatonin on Trx-1 expression.
METHODS: Seventy-two male Sprague-Dawley rats were randomly divided into three groups: normal control group, model control group and melatonin intervention group. The ANP model group was intraperitoneally injected three times with 6% L-Arg at a dose of 25 mL/kg body weight at an interval of 1 h to induce ANP. The normal control group was intraperitoneally injected with equal volumes of normal saline. The melatonin intervention group was injected intraperitoneally with 0.25% melatonin at a dose of 20 mL/kg body weight half an hour before ANP induction. Rats were executed at 6, 12 and 24 hours after last L-Arg injection. The expression of Trx-1 in the lungs was detected by immunohistochemistry. The pathological changes in the pancreas and lungs were analyzed and scored according to Kusser's and Lei's criteria, respectively. The contents of serum Trx-1 and amylase were measured.
RESULTS: At 6, 12 and 24 hours after last L-Arg injection, the pathological changes in the pancreas and lungs in the model control group were more severe than those in the normal control group (all P < 0.01). However, the pathological changes in the pancreas and lungs in the melatonin intervention group were milder than those in the model control group (P < 0.01 or 0.05). At 24 hours, the content of serum amylase in the model control group was significantly higher than that in the normal control group (4 598 U/L ± 2 274 U/L vs 2 033 U/L ± 863 U/L, P < 0.01). In contrast, the content of serum amylase in the melatonin intervention group was lower than that in the model control group (3 990 U/L ± 1 146 U/L vs 4 598 U/L ± 2 274 U/L, P < 0.05). Compared to the normal control group, serum Trx-1 contents in the model control group significantly decreased at 6 and 12 hours but significantly increased at 24 hours. The contents of serum Trx-1 in melatonin intervention group at 6 and 12 hours were significantly higher than those in the model control group.
CONCLUSION: Lung injury is closely related to pancreatic injury in ANP. The expression of Trx-1 in the lungs of rats with ANP increases significantly. Overexpression of Trx-1 in the lungs is closely associated with the development of ANP and acute pancreatitis-associated lung injury. Melatonin can, to a certain extent, alter the expression of Trx-1 and reduce pancreatic and pulmonary injury in ANP in rats.
- Citation: Niu GJ, Tang GD, Liang ZH, Zhong WY, Huang WF. Effects of melatonin on Trx-1 expression in the lungs of rats with acute necrotizing pancreatitis. Shijie Huaren Xiaohua Zazhi 2010; 18(6): 550-556
- URL: https://www.wjgnet.com/1009-3079/full/v18/i6/550.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i6.550
急性坏死性胰腺炎(acute necrotizing pancreatitis ANP)临床上又称之为重症急性胰腺炎(severe acute pancreatitis, SAP), 病情发展快、病死率高. 急性胰腺炎相关性肺损伤(acute pancreatitis-associated lung injury, APALI)是ANP胰外损伤中重要的并发症, 可出现急性呼吸窘迫综合征(acute respiratory distress syndrome, ARDS)和呼吸衰竭[1-3]. 氧化应激在APALI中起着重要作用, 硫氧还蛋白-1(thioredoxin-1, Trx-1)作为组织细胞氧化应激的重要指标, 在该病的作用尚不清楚. ANP时, Trx-1在肺等组织的表达情况尚知之甚少; 其表达程度与肺组织损伤程度关系如何目前亦不清楚[4,5]. 褪黑素(melatonin, MT)因其强抗氧化活性近年来也受到关注[6]. 在大剂量左旋精氨酸(L-arginine, L-Arg)分次腹腔注射诱发的实验性ANP大鼠动物模型中, 肺组织在ANP发展过程中, 其Trx-1表达情况和组织病理炎症程度有无相关改变; 褪黑素对ANP肺组织Trx-1表达和胰肺组织的病理改变的影响国内外罕有报道. 本实验拟用大剂量L-Arg腹腔注射制备ANP大鼠模型, 研究Trx-1在ANP大鼠模型中肺组织表达情况, 探讨Trx-1与氧化应激在ANP肺损伤的关系; 观察褪黑素对ANP及肺急性损伤的保护作用和对Trx-1表达的影响.
健康♂SD大鼠72只, 体质量180-250 g. 由广西医科大学实验动物中心提供. L-Arg和褪黑素购于美国Sigma公司; 一抗: Thioredoxin-1(C63C6)Rabbit mAb(Cell Signaling); 大鼠Trx-1ELISA试剂盒由Adlitteram诊断实验室提供. α-淀粉酶试剂盒(上海执诚生物技术有限公司).
1.2.1 ANP动物模型的制备: 根据谭至柔等[7]实验方法并加以改进制备ANP大鼠模型: SD大鼠按随机表法分成正常对照组(C组, n = 24)、ANP组(A组, n = 24)、褪黑素前干预组(M组, n = 24). 所有大鼠实验前禁食12 h, 自由饮水. A组用6%的L-Arg腹腔内注射, 每次25 mL/kg体质量, 共3次, 注射间隔1 h, 诱导ANP模型. C组大鼠腹腔内注射等量生理盐水. 干预组参考Szabolcs等[6]方法: M组应用0.25%褪黑素(melatonin)(20 mL/kg体质量)在诱导ANP前30 min腹腔注射进行预处理. 各组大鼠在末次注射L-Arg后, 于6、12和24 h 3个时点, 每组各处死8只大鼠. 从腹主动脉取血在-80 ℃保存并留取胰肺组织标本待测.
1.2.2 血清淀粉酶和Trx-1测定: 用EPS速率法, 在日立7170A大型全自动生化仪上检测. (校准品: 英国Randox公司). Trx-1按ELISA试剂盒说明书操作检测.
1.2.3 提取肺和胰腺组织行组织病理学检查: 将右下肺和胰腺标本完全浸入10%中性甲醛液固定, 用石蜡包埋、切片及HE染色. 采用单盲法由病理科医师对大鼠肺组织的病理改变, 在光镜下观察并分别按雷文章等[8]结合Schimidt等[9]评分标准进行综合评分; 胰腺组织按Kusser等[10]评分法进行病理评分. 光学显微镜下观察胰腺组织的病理学改变. 在每例大鼠肺和胰腺组织中, 随机各取5个视野进行综合评分.
1.2.4 免疫组织化学技术检测肺组织Trx-1表达水平: 采用Elivison二步法检测Trx-1. 兔抗鼠多克隆一抗(Thioredoxin 1 Babbit aMb, Cell Signaling公司)工作浓度为1:200, 生物素化抗兔二抗来源于即用型免疫组织化学Elivison plus广谱试剂盒. 用PBS替代一抗作阴性对照, 用已知阳性肺癌切片作阳性对照. 染色模式: 胞核和/或胞质.
肺组织免疫组织化学评分参照Lu等[11]采用半定量积分法: 在全片上、下、左、右、中各随机选取一个400倍视野, 观察每个视野中阳性细胞的染色强度及该强度细胞占视野中所有肺细胞的百分率. 分级: 按阳性细胞占总细胞数的百分率分4级, Ⅰ级: 5%-25%; Ⅱ级: 26%-50%; Ⅲ级: 51%-75%; Ⅳ级: >75%. ≥5%作为阳性标准. 阳性细胞的染色强度分为4级: 1级: (±); 2级: (+); 3级: (++); 4级: (+++). 一个视野的免疫组织化学染色得分 = 该视野中的各种染色强度与该强度阳性细胞的百分率级别的乘积之和. 该组织的免疫组织化学染色综合得分 = 5个视野的免疫组织化学染色得分之总和÷5.
统计学处理 采用SPSS13.0统计软件, 各组计量资料以mean±SD表示; 采用重复测量资料的方差分析方法, 球形性检验, 对不同处理组、不同时间点之间各指标进行统计分析; 采用Spearman等级相关进行分析. 检验水准为0.05.
A组大鼠血清淀粉酶水平比C组增高, 随着观察时间的延长, 血清淀粉酶含量呈逐渐增加趋势, 在24 h达到高峰. 与A组相比, M组血清淀粉酶水平12 h下降. A组和M组24 h较6 h明显升高(表1, 图1C).
| 分组 | 胰腺病理评分(分) | 肺组织病理评分(分) | 血清淀粉酶(U/L) |
| 对照组 | |||
| 6 h | 0.25±0.46 | 0.52±0.35 | 1 736±436 |
| 12 h | 0.13±0.35 | 0.52±0.35 | 1 901±777 |
| 24 h | 0.13±0.35 | 1.00±0.46 | 2 033±863 |
| 实验组 | |||
| 6 h | 4.50±1.20b | 4.00±1.52b | 2 129±760 |
| 12 h | 5.75±1.49b | 7.00±2.98b | 3 012±1 425a |
| 24 h | 8.25±1.40bfh | 9.52±2.80bf | 4 598±2 274bfh |
| 干预组 | |||
| 6 h | 1.88±0.84bd | 2.52±1.03bc | 1 824±334 |
| 12 h | 2.38±1.19bdf | 4.00±1.07bd | 1 835±499c |
| 24 h | 6.75±2.12bcfh | 7.52±3.76bcfh | 3 990±1 146a |
A组大鼠血清Trx-1含量在6、12 h时值显著降低, 24 h时值显著升高, 呈前低后高趋势; 与A组比较, M组血清Trx-1在6、12 h显著升高, 24 h时显著降低, 量的峰值前移(表2, 图1D).
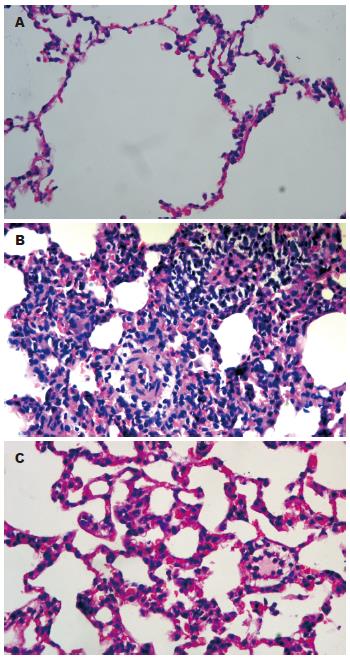
光镜下C组未见明显病理变化. A组在各时点均可见胰腺组织间质增宽, 小叶间隔及腺泡间隔扩张, 胰腺组织发生不同程度的组织水肿、炎症细胞浸润, 腺泡细胞出现空泡化、脱落及衰变, 部分胰腺组织可见腺泡细胞坏死、腺小叶结构消失等病理学改变. 大片状出血少见. 病变随时间延长而加重, 24 h达高峰. M组病变较A组明显减轻(表1, 图1A).
C组无明显病理改变. A组镜下可见肺间质和肺泡水肿, 炎症细胞浸润, 间质增宽, 毛细血管淤血, 肺透明膜形成, 甚至灶性或片状肺不张. 光镜下病变随着时间的延长加重, 尤以肺泡间隔增宽和炎症细胞大量浸润最为突出. A组评分明显高于C组. M组各时点病变明显较A组轻. (表1, 图1B, 图2).
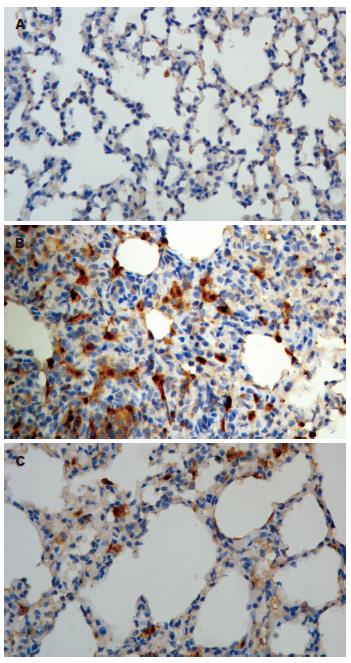
Trx-1主要在肺巨噬细胞、肺泡上皮细胞和小支气管上皮表达. C组大鼠肺组织Trx-1多呈弱表达或无表达, A组和M组均较C组表达显著增强. A组Trx-1的表达随时间延长而增强. M组较A组表达峰值前移, 呈现先高后低趋势(表2, 图1E, 图3).
胰腺组织病理评分: 在M组, 同肺组织病理评分、肺免疫组织化学染色评分和血清淀粉酶呈正相关(rs = 0.463, P = 0.023; rs = 0.714, P = 0.000; rs = 0.649, P = 0.001; P<0.05, rs>0.04); 在A组, 其评分与肺组织病理评分、肺免疫组织化学染色评分呈正相关(rs = 0.452, P = 0.027; rs = 0.500, P = 0.013, 表3).
| A组 | M组 | |||
| rs值 | P值 | rs值 | P值 | |
| 肺组织病理评分 | 0.452 | 0.027 | 0.463 | 0.023 |
| 肺免疫组织化学评分 | 0.500 | 0.013 | 0.714 | 0.000 |
| 血清淀粉酶 | 0.374 | 0.072 | 0.649 | 0.001 |
ANP无论病因如何, 他的结局总是局部和全身的炎症反应, 这与氧化应激和炎症介质的过度释放有关[1,12,13]. 氧化应激和促炎因子协同, 激活单核巨噬细胞系统产生大量活性氧及活性氮等致微循环障碍. 大量炎性介质进入体循环, 通过多条信号转导通路, 触发了炎症级联扩增的信号转录通道, 导致"二次打击"和全身炎症反应综合征、多器官功能障碍综合征及APALI发生[2]. 同时, 机体有关细胞释放一系列介质和酶, 如胰蛋白酶、氧自由基(oxygen free radicals, OFR)等直接损伤肺泡上皮及肺血管内皮细胞. 其中Ⅱ型肺泡上皮细胞在ARDS早期即受损, 致表面活性物质合成减少或功能降低, 导致肺泡表面张力增高和肺顺应性下降, 发生肺泡水肿[3].
本实验显示应用大剂量L-Arg分次大鼠腹腔注射后, 出现血浆淀粉酶明显升高, 胰腺逐渐出现坏死等病理变化, 并伴发胰腺远隔器官肺的损害, 且随着胰腺损伤加重, 肺脏病理损伤改变相应加重. 光镜下可见肺组织间质水肿, 肺泡间隔增宽, 炎症细胞浸润, 肺泡内可见淡红色肺水肿液体渗出. 与临床患者SAP病变过程相似, 证明了ANP和APALI模型的建立是成功的, 血清淀粉酶活性在注射L-Arg后12 h升高, 峰值约24 h[6].
Trx-1是一种反应氧化应激水平的指标, 其在氧化应激和许多炎症相关性疾病表达上调. 急性胰腺炎患者血清中Trx-1增加表达, 并和病情严重程度呈正相关[12,14]. Trx-1不仅在维持细胞氧化还原状况中起重要作用, 且其可通过抑制炎症部位的中性粒细胞发挥抗炎效应[12]. 研究发现Trx-1过度表达, 通过抑制NF-κB活性, 抑制iNOS表达[15,16], 高水平的Trx-1可保护胰腺和肺等组织或细胞减轻氧化损伤, 改善胰腺炎及APALI. Trx-1抑制细胞凋亡信号调节激酶-1(apoptosis signal-regulating kinase 1, ASK-1)是已知的抗凋亡效应的机制[4,17]. 给予Trx-1减轻香烟诱导的肺炎症和大鼠的肺损伤[18,19]. 研究报道Trx-1在间质性肺病和肺损伤患者肺泡巨噬细胞和Ⅱ型肺泡上皮细胞表达增强[20,21].
本研究进一步充实了我们前期的探索, 在L-Arg诱导的非转基因大鼠的ANP模型中, ANP可诱导Trx-1表达[22], 血清Trx-1的含量呈现随时间延长先降低后升高的趋势, 在24 h时达峰值; 深入研究表明, A组随时间延长, 肺组织的Trx-1蛋白表达均较对照组显著增高, 体现了机体的自我保护机制. 从相关性分析也可以看出, Trx-1表达与胰腺组织和肺损伤程度呈正相关. 表明Trx-1表达与组织炎症反应相关, 其表达强度与炎症反应亦有关, 反映应激反应和伴随组织结构损伤, 在其病理生理过程中发挥重要作用. 可作为细胞再生和炎症的标志和反映ANP及相关性肺损伤一个较好指标.
本实验显示, A、M组Trx-1在肺组织不同程度的上调表达, 主要定位在肺巨噬细胞和肺泡上皮细胞; 肺损伤以肺泡隔增厚特别突出, 导致肺泡腔塌陷. 而从巨噬细胞和肺泡上皮细胞分泌的Trx-1可能阻断控制上皮细胞的凋亡信号[17], 由于肺泡Ⅱ型上皮细胞和巨噬细胞对肺组织病理生理过程起关键性作用. 因此, 我们推测Trx-1在肺巨噬细胞和肺泡上皮细胞的过度表达可能参与了巨噬细胞和肺泡Ⅱ型上皮细胞调控和活化, 在APALI中发挥十分重要的作用.
MT因其强抗氧化活性近来也受到关注. MT可通过电子供体直接对多种氧自由基解毒, 还可抑制一氧化氮合酶, 使一氧化氮产生减少, 并可通过阻断转录因子NF-κB的活性而发挥抗炎作用[6]. 本实验结果显示, ANP大鼠褪黑素前干预可显著提高血清Trx-1含量, 使组织中Trx-1表达峰值提前, 而Trx-1可减轻大鼠胰腺和肺的病理损伤. 提示褪黑素可通过激活Trx-1的表达发挥抗氧化活性, 减轻全身炎症反应, 保护胰腺和肺等重要器官. M组24 h胰腺和肺组织Trx-1表达减低, 可能与褪黑素半衰期短, 腹腔单次注射的药物消耗有关. 提示褪黑素对胰腺炎以及其相关性肺损伤有一定保护作用, 持续或延长给药时间有望增强疗效.
总之, 大剂量L-Arg分次腹腔注射, 可以成功制造实验性大鼠ANP及APALI模型; 肺损伤病变严重程度在24 h内随ANP病程的延长和胰损伤逐渐加重. Trx-1在ANP血液和肺组织表达上调, 提示氧化应激参与了胰腺炎及相关性肺损伤; 并可能对该病的发生发展发挥一定保护作用. 褪黑素可一定程度影响Trx-1的表达, 对减轻实验性ANP动物的胰肺等损伤有一定保护作用.
急性坏死性胰腺炎临床上又称之为重症急性胰腺炎, 病情发展快、病死率高, 急性胰腺炎相关性肺损伤是其胰外损伤中重要的并发症, 可出现ARDS和呼吸衰竭. 氧化应激在该病发病中起着重要作用.
陈其奎, 教授, 中山大学附属第二医院消化内科
氧化应激在APALI中起着重要作用, 已经成为该病研究热点. 硫氧还蛋白-1作为组织细胞氧化应激的重要指标, 在该病的作用尚不清楚, 在肺等组织的表达情况尚知之甚少; 其表达程度与肺组织损伤程度关系如何目前亦不清楚. 褪黑素因其强抗氧化活性近年来也受到关注, 褪黑素对ANP肺组织Trx-1表达国内外罕有报道, 对胰肺组织的病理改变的影响研究有限, 有必要深入研究.
本课题组前期研究证实在野生鼠实验性ANP中胰腺组织该蛋白表达上调, 褪黑素干预可致其表达峰值提前. 现进一步深入研究他们在APALI的作用.
本研究有助于研发人工合成Trx-1、Trx-1的内源性调节剂和褪黑素诱导剂的研究; 有助于进一步筛选对涉及氧化应激的急慢性肺部疾病等炎症相关性疾病的有效治疗药物; 有助于将来临床运用. 随着研究的深入, 对炎症相关性疾病等的防治有重大意义.
本文内容丰富, 设计合理, 结果有很好的参考价值.
编辑: 李军亮 电编:何基才
| 1. | Bhatia M, Wong FL, Cao Y, Lau HY, Huang J, Puneet P, Chevali L. Pathophysiology of acute pancreatitis. Pancreatology. 2005;5:132-144. [PubMed] [DOI] |
| 2. | Pereda J, Sabater L, Aparisi L, Escobar J, Sandoval J, Viña J, López-Rodas G, Sastre J. Interaction between cytokines and oxidative stress in acute pancreatitis. Curr Med Chem. 2006;13:2775-2787. [PubMed] [DOI] |
| 3. | Pastor CM, Matthay MA, Frossard JL. Pancreatitis-associated acute lung injury: new insights. Chest. 2003;124:2341-2351. [PubMed] [DOI] |
| 4. | Powis G, Montfort WR. Properties and biological activities of thioredoxins. Annu Rev Pharmacol Toxicol. 2001;41:261-295. [PubMed] [DOI] |
| 5. | Okamoto T, Asamitsu K, Tetsuka T. Thioredoxin and mechanism of inflammatory response. Methods Enzymol. 2002;347:349-360. [PubMed] [DOI] |
| 6. | Szabolcs A, Reiter RJ, Letoha T, Hegyi P, Papai G, Varga I, Jarmay K, Kaszaki J, Sari R, Rakonczay Z Jr, Lonovics J, Takacs T. Effect of melatonin on the severity of L-arginine-induced experimental acute pancreatitis in rats. World J Gastroenterol. 2006;12:251-258. [PubMed] |
| 9. | Schmidt J, Lewandrowsi K, Warshaw AL, Compton CC, Rattner DW. Morphometric characteristics and homogeneity of a new model of acute pancreatitis in the rat. Int J Pancreatol. 1992;12:41-51. [PubMed] |
| 10. | Kusske AM, Rongione AJ, Ashley SW, McFadden DW, Reber HA. Interleukin-10 prevents death in lethal necrotizing pancreatitis in mice. Surgery. 1996;120:284-288; discussion 289. [PubMed] [DOI] |
| 11. | Lu CD, Altieri DC, Tanigawa N. Expression of a novel antiapoptosis gene, survivin, correlated with tumor cell apoptosis and p53 accumulation in gastric carcinomas. Cancer Res. 1998;58:1808-1812. [PubMed] |
| 12. | Ohashi S, Nishio A, Nakamura H, Kido M, Ueno S, Uza N, Inoue S, Kitamura H, Kiriya K, Asada M. Protective roles of redox-active protein thioredoxin-1 for severe acute pancreatitis. Am J Physiol Gastrointest Liver Physiol. 2006;290:G772-G781. [PubMed] [DOI] |
| 13. | DiMagno MJ, DiMagno EP. New advances in acute pancreatitis. Curr Opin Gastroenterol. 2007;23:494-501. [PubMed] |
| 14. | World CJ, Yamawaki H, Berk BC. Thioredoxin in the cardiovascular system. J Mol Med. 2006;84:997-1003. [PubMed] [DOI] |
| 15. | Hoshino T, Nakamura H, Okamoto M, Kato S, Araya S, Nomiyama K, Oizumi K, Young HA, Aizawa H, Yodoi J. Redox-active protein thioredoxin prevents proinflammatory cytokine- or bleomycin-induced lung injury. Am J Respir Crit Care Med. 2003;168:1075-1083. [PubMed] [DOI] |
| 16. | Kondo N, Nakamura H, Masutani H, Yodoi J. Redox regulation of human thioredoxin network. Antioxid Redox Signal. 2006;8:1881-1890. [PubMed] [DOI] |
| 17. | Hoshino Y, Nakamura T, Sato A, Mishima M, Yodoi J, Nakamura H. Neurotropin demonstrates cytoprotective effects in lung cells through the induction of thioredoxin-1. Am J Respir Cell Mol Biol. 2007;37:438-446. [PubMed] [DOI] |
| 18. | Sato A, Hara T, Nakamura H, Kato N, Hoshino Y, Kondo N, Mishima M, Yodoi J. Thioredoxin-1 suppresses systemic inflammatory responses against cigarette smoking. Antioxid Redox Signal. 2006;8:1891-1896. [PubMed] [DOI] |
| 19. | Tipple TE, Welty SE, Rogers LK, Hansen TN, Choi YE, Kehrer JP, Smith CV. Thioredoxin-related mechanisms in hyperoxic lung injury in mice. Am J Respir Cell Mol Biol. 2007;37:405-413. [PubMed] [DOI] |
| 20. | Tiitto L, Kaarteenaho-Wiik R, Sormunen R, Holmgren A, Pääkkö P, Soini Y, Kinnula VL. Expression of the thioredoxin system in interstitial lung disease. J Pathol. 2003;201:363-370. [PubMed] [DOI] |