修回日期: 2010-01-11
接受日期: 2010-01-19
在线出版日期: 2010-02-28
目的: 探讨重组人生长激素(rhGH)对荷人胃癌细胞株SGC-7901裸鼠移植瘤生长及VEGF表达的影响.
方法: 免疫细胞化学染色法鉴定SGC-7901细胞株GHR表达状态, 30只接种皮下移植瘤的裸鼠随机分为: 对照组(生理盐水0.2 mL/d), 低剂量rhGH组[0.5 U/(kg•d)], 高剂量rhGH组[2.5 U/(kg•d)], 连续给药14 d, 观察并记录裸鼠体质量和肿瘤体积, 酶联免疫吸附法测定血清VEGF含量, 免疫组织化学法检测胃癌组织中VEGF蛋白表达, RT-PCR检测VEGF mRNA表达.
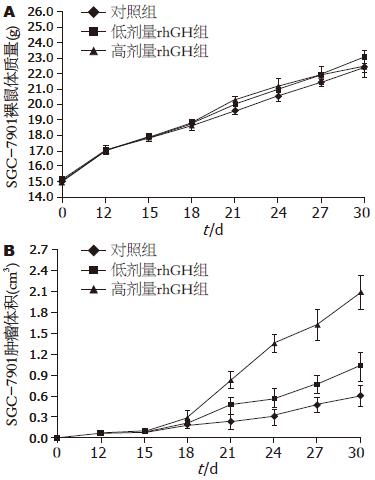
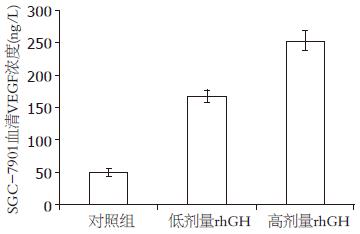
结果: SGC-7901细胞株GHR呈强阳性表达. 自rhGH给药第3天起, rhGH给药组与对照组肿瘤体积相差悬殊(P<0.05), 且高剂量rhGH比低剂量rhGH促肿瘤生长效应更加明显(P<0.05), 3组间裸鼠体质量差别不明显(P>0.05). 裸鼠血清VEGF含量, 与对照组和低剂量rhGH组相比, 高剂量rhGH组血清中VEGF水平明显升高, 差别具有统计学意义(252.94 ng/L±15.32 ng/L vs 49.94 ng/L±5.73 ng/L, 167.60 ng/L±9.54 ng/L, 均P<0.05). 肿瘤组织VEGF蛋白的表达, 对照组VEGF表达呈中度阳性; 低剂量rhGH组和高剂量rhGH组VEGF表达量高, 呈强阳性. 肿瘤组织VEGF mRNA表达水平, 高剂量rhGH组VEGF相对表达量明显高于对照组和低剂量rhGH组, 差别具有统计学意义(0.647±0.0447 vs 0.323±0.0258, 0.412±0.0351, 均P<0.05).
结论: rhGH能促进GHR阳性表达的SGC-7901移植瘤生长, 并促进VEGF表达.
引文著录: 程璐, 苏翔宇, 林岩, 李苏宜. 重组人生长激素对荷人胃癌细胞SGC-7901裸鼠移植瘤生长及VEGF表达的影响. 世界华人消化杂志 2010; 18(6): 536-541
Revised: January 11, 2010
Accepted: January 19, 2010
Published online: February 28, 2010
AIM: To investigate the effects of recombinant human growth hormone (rhGH) on tumor growth and VEGF expression in subcutaneous xenografts derived from human gastric carcinoma SGC-7901 cells in nude mice.
METHODS: The expression of growth hormone receptor (GHR) in human gastric carcinoma cell line SGC-7901 was detected by immunocytochemistry. Thirty nude mice bearing subcutaneous xenografts derived from carcinoma SGC-7901 cells were randomly divided into three groups: control group, low-dose rhGH group and high-dose rhGH group. The low- and high-dose rhGH groups were injected with rhGH at doses of 0.5 and 2.5 U/(kg•d) once a day for two weeks, respectively, while the control group was injected with equal volumes of normal saline for the same duration. The changes in body weight and tumor volume were recorded. The content of serum VEGF in peripheral blood was analyzed by enzyme-linked immunosorbent assay (ELISA). The expression of VEGF mRNA and protein in tumor tissue was detected by reverse transcription-polymerase chain reaction (RT-PCR) and immunohistochemistry, respectively.
RESULTS: GHR is highly expressed in SGC-7901 cells. After treatment with rhGH for three days, the tumor volume was significantly larger in the two rhGH groups than in the control group (both P < 0.05). High-dose rhGH revealed stronger tumor growth-promoting effect than low-dose one (P < 0.05). No significant difference was found in the body weight of nude mice among the three groups (all P > 0.05). The content of serum VEGF was elevated more obviously in the high-dose rhGH group than in the low-dose rhGH group and the control group. (252.94 ng/L ± 15.32 ng/L vs 167.60 ng/L ± 9.54 ng/L and 49.94 ng/L ± 5.73 ng/L, respectively; both P < 0.05). The expression level of VEGF protein in tumor tissue was significantly higher in the two rhGH groups than in the control group. The relative expression level of VEGF mRNA was much higher in the high-dose rhGH group than in the low-dose rhGH group and the control group (0.647 ± 0.0447 vs 0.412 ± 0.0351 and 0.323 ± 0.0258, respectively; both P < 0.05).
CONCLUSION: RhGH can promote tumor growth and VEGF expression in subcutaneous xenografts derived from human gastric carcinoma SGC-7901 cells in nude mice.
- Citation: Cheng L, Su XY, Lin Y, Li SY. Recombinant human growth hormone promotes tumor growth and VEGF expression in subcutaneous xenografts derived from human gastric carcinoma SGC-7901 cells in nude mice. Shijie Huaren Xiaohua Zazhi 2010; 18(6): 536-541
- URL: https://www.wjgnet.com/1009-3079/full/v18/i6/536.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i6.536
恶性肿瘤患者常并发严重营养不良, 特别是手术、放化疗后及晚期消化系肿瘤患者, 以胃癌患者营养不良的发生率最为突出, 且恶病质一旦启动, 常规的营养支持治疗往往难以逆转, 直接影响了肿瘤患者的生活质量和生存时间. 作为一种高效的促合成代谢因子, 重组人生长激素(recombinant human growth hormone, rhGH)在刺激骨骼生长加速, 纠正负氮平衡状态, 增强抗感染能力等方面疗效显著, 然而rhGH能否应用于胃癌患者, 在改善患者全身状况的同时, 是否会促进原有肿瘤的生长、浸润和转移复发, 仍需要深入评价. 生长激素受体(growth hormone receptor, GHR)是生长激素(growth hormone, GH)发挥生物学效应的基础, 本研究通过建立GHR阳性表达的裸鼠胃癌皮下移植瘤模型, 给予不同剂量的rhGH干预, 于动物在体水平了解rhGH对胃癌组织生长及血管内皮生长因子(vascular endothelial growth factor, VEGF)表达的影响.
人低分化胃腺癌细胞株SGC-7901购自中国科学院上海细胞生物研究所. BALB/c, nu/nu, ♂裸鼠40只, 购自上海斯莱克实验动物有限公司, 周龄4-5 wk, 体质量14-16 g, 许可证号: SCXK(沪)2004-2005, 无特定病原体(SPF)条件下饲养. 注射用rhGH(珍怡)为上海联合赛尔生物工程有限公司惠赠. 兔抗人GHR多克隆抗体, 兔抗人VEGF多克隆抗体, 小鼠血管内皮细胞生长因子ELISA试剂盒, 浓缩型SABC免疫组织化学试剂盒均购自武汉博士德生物技术有限公司. TRIzol试剂和RT-PCR试剂盒分别为Invitrogen和TaKaRa公司产品.
1.2.1 胃癌细胞GHR表达的检测: SGC-7901细胞培养液为含100 mL/L胎牛血清的RPMI 1640, 37 ℃含50 mL/L CO2的饱和湿度培养箱中培养. 应用免疫细胞化学染色法鉴定SGC-7901的GHR表达情况. 操作步骤按说明书进行. 阳性细胞染为棕黄色或棕褐色, 胞膜、胞质着色. 高倍镜下(×200)随机选择5个视野并分别计数100个细胞, 根据阳性细胞占计数细胞的百分比, 将免疫染色分级如下: 阴性(-), ≤5%; 弱阳性(+), 6%-25%; 中等阳性(++), 25%-50%; 强阳性(+++), ≥50%.
1.2.2 裸鼠胃癌皮下移植瘤模型的建立: 取处于对数生长期的胃癌细胞SGC-7901, 用2.5 g/L胰蛋白酶消化制成单细胞悬液, 台盼蓝拒染法计数活细胞数占95%以上. 收集细胞, 调节浓度为2×106/mL, 随机选取5只裸鼠, 右前肢腋下接种SGC-7901细胞, 每只0.2 mL. 7 d后接种部位可触及肿瘤组织, 14 d后可见直径1.5-2 cm的肿块. 颈椎脱臼法处死裸鼠, 皮肤消毒, 无菌条件下, 于右前肢腋下取出瘤块, 置于有少许生理盐水的培养皿中, 去掉坏死组织, 称质量, 按瘤块质量, 每克肿瘤加入4 mL生理盐水, 于组织匀浆器中研磨, 配成混悬液, 浓度约为(1-2)×107个/mL, 接种至35只实验裸鼠右前肢腋下, 每只0.2 mL, 7 d后见皮下移植瘤形成.
1.2.3 实验分组与观察指标: 剔除过大或过小的肿瘤, 选取肿瘤直径5-6 mm的30只裸鼠进入实验, 随机平均分为3组. 对照组(C组): 生理盐水0.2 mL/d; 低剂量GH组(L组): rhGH 0.5 U/(kg·d); 高剂量GH组(H组): rhGH 2.5 U/(kg·d); 腹壁皮下注射, 每天1次, 自肿瘤接种后第15天至第28天, 共14 d. 每日观察裸鼠的行动、对外界刺激的反应、皮毛色泽及摄食情况. 自第12至第30天, 每3 d监测裸鼠的体质量和皮下移植瘤的生长情况并记录, 测量肿瘤长径(A)和垂直横径(B), 按公式V = A×B2/2计算肿瘤体积, 描绘肿瘤体积增长曲线. 停药2 d后, 每只裸鼠摘除眼球取血约0.5 mL, 后脱臼法处死裸鼠, 取皮下移植瘤, 并仔细检查其他脏器有无转移.
1.2.4 血清VEGF含量检测: 肿瘤接种第30天, 摘除裸鼠眼球取血约0.5 mL, 并于室温下静置2 h, 待血液凝固后, 3 000 r/min离心10 min, 提取上层血清于-80 ℃冻存备检. 小鼠VEGF ELISA试剂盒检测各组血清中VEGF水平.
1.2.5 免疫组织化学法检测胃癌组织中VEGF蛋白表达: 肿瘤组织用10%中性甲醛固定, 石蜡包埋、切片, 以PBS替代一抗作为阴性对照. 免疫特异性染色定位于细胞质. 阳性判断标准以阳性细胞占计数细胞的百分比为准, 免疫分级标准同1.2.1.
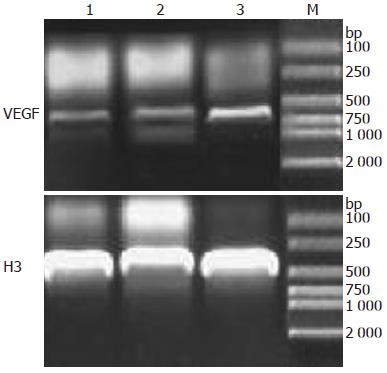
1.2.6 RT-PCR检测胃癌组织中VEGF mRNA的表达: 取新鲜肿瘤组织, TRIzol提取总RNA, 使用随机引物合成cDNA. 以人VEGF165为参照设计引物, VEGF-upper: 5'-GCACCCATGGCAGAAGGAGGAG-3', VEGF-lower 5'-TCACCGCCTCGGCTTGTCAC-3'; 以人H3(HH3)作为内参, 引物序列为HH3-upper: 5'-ATGGCTCGTACAAAGC-3', HH3-lower: 5'-TTAAGCACGTTCTCCACG-3', 以逆转录成的cDNA为模板, 进行PCR, 程序为: 94 ℃变性3 min, 94 ℃ 30 s, 50 ℃ 45 s, 72 ℃ 40 s, 30个循环, 72 ℃延伸5 min, 1.0%琼脂糖电泳检测扩增产物. Image Master VDS凝胶图像分析仪扫描凝胶图谱, 用LabImageVersion2.7.1分析系统对PCR产物半定量分析, 以DNA扩增量之比(NVECF/NH3)代表VEGF mRNA相对表达水平.
统计学处理 用SPSS13.0统计处理软件, 计量数据以mean±SD表示, 不同组间样本均数比较采用单因素方差分析, 配对设计的样本均数比较用两因素方差分析. 以P<0.05作为有统计学差异的标准.
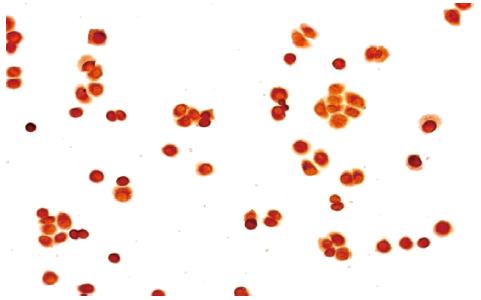
SGC-7901细胞染为棕黄色, 主要为细胞膜、细胞质着色, 阳性细胞数约为83%, 说明GHR呈强阳性表达(图1).
实验开始, 肿瘤接种后第7天, 皮下可触及小瘤结节, 第10天较为明显. 待肿瘤最长径长至0.5 cm左右, 约肿瘤接种后第12天, 开始每3天记录肿瘤大小和裸鼠体质量. 第15天起予以rhGH药物干预. 给药前3天, 3组裸鼠之间的体质量和肿瘤体积变化不明显(P>0.05), 且rhGH实验组裸鼠活动状态和进食量好于对照组. 至给药后第3天起(第18天), 低剂量rhGH组、高剂量rhGH组与对照组相比, 皮下移植瘤体积增加明显(P<0.05), 且高、低rhGH剂量浓度组间亦有差别(P<0.05); 而3组裸鼠体质量差别不具有统计学意义(P>0.05). 随着肿瘤体积的增大, 给药的后半程, 各组裸鼠体质量增长速度均较前半程减缓(图2). 实验结束处死动物, 各组裸鼠肝脏、肺脏、胸腹腔均未见转移病灶.
与对照组和低剂量rhGH组相比, 高剂量rhGH组血清中VEGF水平明显升高, 差别具有统计学意义(252.94 ng/L±15.32 ng/L vs 49.94 ng/L±5.73 ng/L, 167.60 ng/L±9.54 ng/L, 均P<0.05, 图3).
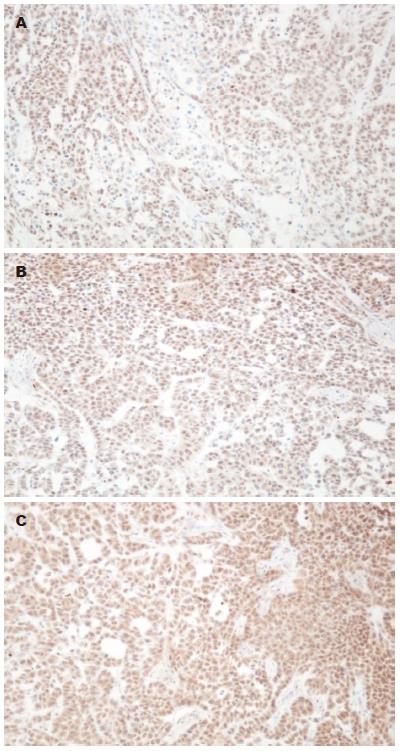
对照组VEGF为中度阳性, 阳性细胞数约占计数细胞总数38%, 低剂量rhGH组和高剂量rhGH组VEGF表达量高, 呈强阳性, 阳性细胞比例均超过60%(图4).
高剂量rhGH组VEGF相对表达量明显高于对照组和低剂量rhGH组, 差别具有统计学意义(0.647±0.0447 vs 0.323±0.0258, 0.412±0.0351, 均P<0.05, 图5). VEGF和H3扩增后电泳结果显示产物片段大小和预先设计一致.
rhGH具有直接的代谢调理作用, 已作为一种促合成代谢药物广泛应用于非肿瘤患者蛋白热卡不足型营养不良的治疗. 胃癌患者由于术前不能正常进食, 肿瘤组织消耗大量能量, 手术创伤大, 且术后处于高分解代谢状态, 近90%患者发生体质量丢失, 20%直接死于营养不良、恶病质[1]. 给予单纯的肠内、肠外营养支持治疗并不能显著逆转恶性肿瘤患者的高分解代谢状态, 因此, 许多学者试图通过应用rhGH的代谢调理和免疫调节作用来纠正负氮平衡, 增强机体抵抗力, 从而提高抗肿瘤治疗疗效, 延长生存期. 有研究证实体内环境中上调鼠生长激素分泌量的生理学刺激不会促进小鼠所荷肿瘤的生长, 认为使用rhGH是一种治疗人类癌性恶病质的适合方法[2]. 然而考虑到rhGH的间接促细胞生长增殖效应, 大剂量使用是否会促进原发肿瘤的生长, 是否增加了第二肿瘤的发生可能, 以及是否使原先非肿瘤患者的新发恶性肿瘤概率增加, 临床研究资料仍存在分歧[3-7].
肿瘤血管生成是肿瘤生长、侵袭和转移的重要条件[8]. 肿瘤通过血管从宿主获得丰富的营养, 并依赖其向宿主输出大量恶性细胞致肿瘤不断生长和转移, 形成一个促血管生成循环. 肿瘤的血管生成与多种生长因子的刺激有关, 其中VEGF是最主要、最直接的促血管生长因子[9]. 临床研究亦发现在胃癌患者的血清及癌组织中VEGF的表达水平均异常增高, 且与浸润深度及有无转移呈正相关, 对疾病预后具有提示作用[10]. 故审视rhGH临床肿瘤患者应用的安全性, 不可忽视其对VEGF表达的影响.
GH可以经生长介质介导, 通过GH-胰岛素样生长因子-1(insulin-like growth factor-1, IGF-1)轴, 促进胰腺癌细胞BXPC-3的增殖[11]. 但其与靶细胞表面GHR的结合则是GH发挥促生长效应更直接的途径[12], GH和IGF-1能够促进人乳腺癌细胞株MCF7在无血清条件中生长, 并且保护细胞免受多柔比星细胞毒效应的影响. 运用IGF-1受体抗体阻断后仍然观察到GH的促增殖效应,而使用GHR受体拮抗剂培维索孟却使其促增殖效应消失, 说明GH的这一效应是直接发挥作用, 并没有经IGF-1介导[13]. 还有研究发现, rhGH能促进表达GHR的人肝癌细胞Bel-7402移植瘤的生长, 其作用有随用药量增加而增强的趋势, 两者之间存在一定相关性[14]. 本课题小组先前的研究结果也显示, rhGH对GHR阳性表达的肝癌细胞具有明显促增殖作用, 但对于GHR阴性表达的肝癌细胞, 由于缺少结合位点, 故未发现rhGH有促其增殖的作用[15,16], 提示GHR极可能是影响rhGH发挥生物学效应的关键靶点.
本实验首先通过免疫细胞化学染色鉴定SGC-7901胃癌细胞株GHR呈强阳性表达, 在体水平观察rhGH对GHR阳性肿瘤生长、营养状况改善程度及VEGF表达的影响. 给药初期, rhGH治疗组的所有裸鼠, 活动状态及饮水进食量均较对照组为佳. 说明rhGH确实能够在一定程度上改善机体代谢状态. 给药3 d后, rhGH给药组的肿瘤生长速率开始明显快于对照组, 肿瘤体积增大显著, 说明rhGH对GHR阳性的肿瘤有较明显的促生长作用, 且高剂量rhGH组的促生长效应更显著; 但3组裸鼠体质量数值无显著差别, 且在给药的后半程, rhGH治疗组的裸鼠体质量随着肿瘤体积的逐步增大, 增长速度逐渐减缓, 最后高剂量rhGH组裸鼠体质量甚至低于低剂量rhGH组, 可能与肿瘤增长过快增加了机体的消耗有关. 同时为了进一步评价rhGH与肿瘤血管生成的关系并结合体外研究的实验结果, 提示rhGH能促GHR+肝癌细胞株Bel-7402分泌更多的VEGF, 促进与其共培养的血管内皮细胞生长, 参与肿瘤血管的生成[17]; 本实验中采用动物皮下移植瘤模型, 于体内水平研究rhGH对胃癌组织VEGF表达的影响, 结果发现, rhGH给药组VEGF的阳性表达率明显高于对照组, 且随着给药剂量增加, VEGF表达阳性程度越高; 同时我们采用RT-PCR从基因转录水平检测VEGF mRNA的表达, 可见各实验组约在495 bp处出现深浅不一的条带, 结论符合蛋白水平检测结果. 此外, 肿瘤不断生长分泌的VEGF不仅仅局限于肿瘤组织本身, 大量的VEGF释放入外周血, 血浆中也可以检测到高水平的VEGF, 且与组织中VEGF表达变化相一致. 由此可见, 对于GHR阳性表达的肿瘤, 可能存在GH发挥促增殖作用的直接通路, 故存在促进肿瘤生长的风险. 同时随着rhGH干预浓度的升高, VEGF表达量也有增加, 推测其也极可能促进了肿瘤的血管生成, 有关其信号通路的具体机制仍需深入探索.
胃癌的治疗不仅包括抗肿瘤治疗本身, 从代谢调理治疗的角度, 以改善患者代谢状态, 使总蛋白合成增加, 有效恢复和维护脏器功能, 提高化疗耐受性, 从而延缓恶病质发生发展. rhGH在促蛋白合成方面存有独特的优势, 但是应用于恶性肿瘤患者, 仍需权衡利弊. GHR是其发挥作用的关键靶点之一, rhGH应用于GHR阳性表达的肿瘤, 有促进肿瘤生长及肿瘤血管生成的风险, 临床上使用应谨慎.
重组人生长激素(rhGH)具有与人体内源生长激素同等的作用, 能够刺激骨骼生长, 促进全身蛋白质合成, 调节脂肪代谢, 增强免疫机能. 但是由于生长激素(GH)具有促细胞有丝分裂效应, 理论上存在潜在的促肿瘤生长风险, 故其能否用于恶性肿瘤患者的代谢调理仍有争议. 有报道认为, rhGH不仅可促进肿瘤细胞增殖, 而且可能与肿瘤血管新生有关, 但尚无明确的理论证据.
王振宁, 教授, 中国医科大学附属第一医院肿瘤外科; 熊斌, 教授, 武汉大学中南医院肿瘤科
rhGH能否利用其促蛋白合成优势, 纠正恶性肿瘤患者的负氮平衡状态, 其肿瘤相关安全性问题需要进一步研究.
王鹰等研究发现rhGH能够促进生长激素受体(GHR)阳性表达的肝癌细胞株Bel-7402分泌更多的VEGF, 促进与其共培养的血管内皮细胞生长, 参与肿瘤血管的生成; 而对于GHR阴性表达的肝癌细胞株SMMC-7721, 虽有VEGF的分泌, 但不受rhGH干预的影响.
肿瘤的血管生成是肿瘤生长、侵袭和转移的重要条件, 探讨rhGH与血管生成的关系有助于进一步评价其肿瘤相关安全性. 以rhGH作用的靶点GHR为切入点, 判断其表达状态, 更全面地研究rhGH生物学效应的发挥.
本研究设计合理, 方法可靠, 结果可信, 文章层次清楚, 其结论有一定的应用价值.
编辑: 李瑞敏 电编:何基才
| 1. | Muscaritoli M, Bossola M, Aversa Z, Bellantone R, Rossi Fanelli F. Prevention and treatment of cancer cachexia: new insights into an old problem. Eur J Cancer. 2006;42:31-41. [PubMed] [DOI] |
| 2. | Khan AS, Smith LC, Anscombe IW, Cummings KK, Pope MA, Draghia-Akli R. Growth hormone releasing hormone plasmid supplementation, a potential treatment for cancer cachexia, does not increase tumor growth in nude mice. Cancer Gene Ther. 2005;12:54-60. [PubMed] [DOI] |
| 3. | Cao J, Luo SM, Liang L, Lai J. Effects of parenteral nutrition without and with growth hormone on growth hormone/ insulin-like growth factor-1 axis after hepatectomy in hepatocellular carcinoma with liver cirrhosis. JPEN J Parenter Enteral Nutr. 2007;31:496-501. [PubMed] [DOI] |
| 4. | Renehan AG, Brennan BM. Acromegaly, growth hormone and cancer risk. Best Pract Res Clin Endocrinol Metab. 2008;22:639-657. [PubMed] [DOI] |
| 5. | Perry JK, Emerald BS, Mertani HC, Lobie PE. The oncogenic potential of growth hormone. Growth Horm IGF Res. 2006;16:277-289. [PubMed] [DOI] |
| 6. | Tacke J, Bolder U, Herrmann A, Berger G, Jauch KW. Long-term risk of gastrointestinal tumor recurrence after postoperative treatment with recombinant human growth hormone. JPEN J Parenter Enteral Nutr. 2000;24:140-144. [PubMed] [DOI] |
| 7. | Liang DM, Chen JY, Zhang Y, Gan P, Lin J, Chen AB. Effects of recombinant human growth hormone on growth of human gastric carcinoma xenograft model in nude mice. World J Gastroenterol. 2006;12:3810-3813. [PubMed] |
| 8. | Carmeliet P, Jain RK. Angiogenesis in cancer and other diseases. Nature. 2000;407:249-257. [PubMed] [DOI] |
| 9. | Karamysheva AF. Mechanisms of angiogenesis. Biochemistry (Mosc). 2008;73:751-762. [PubMed] [DOI] |
| 11. | 蔡 辉华, 孙 跃明, 白 剑峰, 陆 文熊, 石 毅, 赵 翰林, 苗 毅. 生长激素对胰腺癌细胞株BXPC-3增殖的作用及其机制. 世界华人消化杂志. 2008;16:1157-1161. [DOI] |
| 12. | Brooks AJ, Wooh JW, Tunny KA, Waters MJ. Growth hormone receptor; mechanism of action. Int J Biochem Cell Biol. 2008;40:1984-1989. [PubMed] [DOI] |
| 13. | Zatelli MC, Minoia M, Molè D, Cason V, Tagliati F, Margutti A, Bondanelli M, Ambrosio MR, degli Uberti E. Growth hormone excess promotes breast cancer chemoresistance. J Clin Endocrinol Metab. 2009;94:3931-3938. [PubMed] [DOI] |