修回日期: 2009-12-25
接受日期: 2009-12-29
在线出版日期: 2010-02-18
目的: 对比多吉美单药治疗肝癌与联合介入治疗的效果.
方法: 回顾性分析20例系统服用多吉美的肝癌患者, 其中单药治疗的7例, 联合介入治疗的13例, 随访方式采用门诊随访及住院随访, 随访时间7-28 mo. 主要研究终点为肿瘤反应率和肿瘤进展时间.
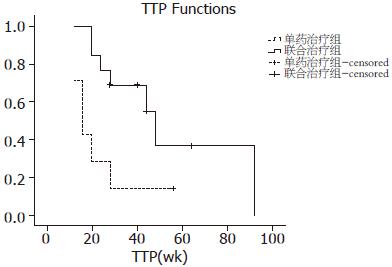
结果: 20例患者中, CR 4例, PR 10例, SD 4例, PD 2例, 其中单药治疗组CR 0例, PR 3例, SD 2例, PD 2例; 单药治疗组及联合治疗组的中位肿瘤进展时间分别为16及48 wk.
结论: 多吉美联合肝癌介入治疗可增加肿瘤反应率, 延长肿瘤进展时间.
引文著录: 李枫, 王峰, 李军, 杨新顺. 多吉美联合介入治疗原发性肝癌20例. 世界华人消化杂志 2010; 18(5): 517-520
Revised: December 25, 2009
Accepted: December 29, 2009
Published online: February 18, 2010
AIM: To analyze the efficacy of Nexavar alone and in combination with interventional therapy for hepatocellular carcinoma.
METHODS: Twenty hepatocellular carcinoma patients, including 7 receiving Nexavar monotherapy and 13 receiving Nexavar in combination with interventional therapy, were retrospectively analyzed. All patients were followed up for 7-28 months. The primary study endpoint was tumor response rate and time to tumor progression (TTP).
RESULTS: Of 20 patients, 4 achieved a complete response (CR), 10 achieved a partial response (PR), 4 had stable disease (SD), and 2 had progressive disease (PD). In the Nexavar monotherapy group, no patients experienced a CR, 3 patients experienced a PR, two patients had SD, and 2 patients had PD. The median time to tumor progression was 16 and 48 weeks in the monotherapy group and the combination treatment group, respectively.
CONCLUSION: Nexavar in combination with interventional therapy can increase the tumor response rate and prolong the time to tumor progression in patients with hepatocellular carcinoma.
- Citation: Li F, Wang F, Li J, Yang XS. Nexavar in combination with interventional therapy for hepatocellular carcinoma: a report of 20 cases. Shijie Huaren Xiaohua Zazhi 2010; 18(5): 517-520
- URL: https://www.wjgnet.com/1009-3079/full/v18/i5/517.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i5.517
多吉美(甲磺酸索拉非尼)已被列为晚期肝癌治疗的标准用药, 作为一种新型的靶向治疗药物, 由于在中国获批时间较短, 针对中国人群疗效的报道尚少, 而多吉美联合传统的肝癌介入治疗能否让患者得到更多的临床获益, 即便在全球范围内, 也缺乏足够的循证学依据. 本研究自2008-04对20例系统服用多吉美治疗的肝癌患者进行了长期随访, 并将资料加以总结分析, 报道如下.
2008-04/2009-10-31在我中心登记随访过的服用多吉美的晚期肝癌患者28例, 其中男21例, 女7例, 中位年龄54(24-78)岁, 所有患者均符合原发性肝癌的临床诊断标准(2001年第八届肝癌会议制定标准), 服用多吉美前肝脏功能分级均为Child-Pugh A级或B级. 其中20例患者服药超过3 mo进入随访, 随访时间7-28 mo. 进入随访的20例患者, 中位年龄52(24-78)岁, 其中男15例(75%); 肝脏功能Child-Pulf分级A级12例, B级8例; BCLC分期Stage B级9例, C级11例.
1.2.1 治疗: 多吉美的服用剂量采用400 mg, 每日2次口服, 对于出现难以耐受的不良反应的患者(如严重手足皮肤反应、胃肠道反应等)予以减量(改为400 mg, 每日1次)或暂停服药2 wk, 根据不良反应减轻程度决定是否继续服药及服药剂量. 全组28例患者中有20例患者服药超过3 mo, 进入随访. 其中联合肝动脉化疗栓塞的12例, 联合局部消融治疗的1例, 多吉美单药治疗的7例(2例为肝移植后肝外转移, 2例拒绝联合介入治疗, 3例不适合介入治疗).
1.2.2 随访: 采用住院随访及门诊随访, 随访间隔为每月1次. 门诊随访内容包括血常规, 生化肝功, 凝血时间, 甲胎蛋白, 强化CT或MR(每2月1次), 药物不良反应及ECOG评分. 联合介入治疗的患者需要定期住院复查及治疗.
1.2.3 疗效评价: 从患者耐受情况、肿瘤反应、肿瘤进展时间(TTP)三个方面进行疗效评价. 肿瘤反应的评价手段采用强化CT或MR, 对于联合TACE治疗的患者由于碘油的存在可能会影响到对肿瘤强化程度的判断, 我们采用强化MR或联合DSA造影判断肿瘤血供的情况. 评价标准采用了"存活肿瘤"的概念, 既2008年美国肝脏病协会(AASLD)提出的RECIST修订标准[1], 以"目标病灶动脉期的增强显影的变化情况作为判断肿瘤大小变化的标准".
全部28例患者中2例服药后0.5-1 mo出现严重手足、胃肠道反应, 无法耐受停药; 2/28例患者服药后0.5-2 mo出现黄疸停药; 1/28例患者服药0.5 mo出现皮肤大片淤斑, 血小板显著下降, 停药1 mo后缓解, 继续服药并进入随访. 严重不良反应率: 5/28(17.5%). 4例患者服药及随访时间短, 未进入本组研究. 进入本组研究的20例患者均未出现III级以上的严重不良反应. 肿瘤反应评价参照AASLD提出的RECIST修订标准, 全组患者CR 4例, PR 10例, SD 4例, PD 2例, 其中单药治疗组CR 0例, PR 3例, SD 2例, PD 2例(基线指标及疗效对比见表1), 单药治疗组及联合治疗组的中位肿瘤进展时间分别为16及48 wk(图1).
| 分组 | 联合治疗组(n=13) | 单药治疗组(n=7) |
| 中位年龄(岁) | 51 | 65 |
| 男性 n(%) | 13(100) | 2(28.6) |
| ECOG评分 | ||
| 0 | 8 | 1 |
| 1 | 5 | 3 |
| 2 | 0 | 3 |
| C-P分级 | ||
| A | 9 | 3 |
| B | 4 | 4 |
| BCLC分期 | ||
| Stage B | 8 | 1 |
| Stage C | 5 | 6 |
| 中位TTP(wk) | 48 | 16 |
| 肿瘤反应 | ||
| CR | 4 | 0 |
| PR | 7 | 3 |
| SD | 2 | 2 |
| PD | 0 | 2 |
多吉美作为一种新型的分子靶向治疗药物, 已被列为中晚期肝癌治疗的标准用药. 关于其治疗原发性肝癌的疗效, 目前共有两组大样本的研究报道, 分别是针对欧洲人群的SHARP研究以及针对亚洲人群的Oriental研究[2,3]. 两组研究结果均肯定了多吉美可显著延长晚期肝癌患者的生存期. 其中SHARP和Oriental研究中的中位OS分别为10.7 mo和6.5 mo, 较对照组分别延长了44%和47%, 中位TTP分别达到5.5 mo和2.8 mo, 较对照组分别延长了74%和73%. 在多吉美出现前虽然也有部分化疗药物及生物制剂被认为对肝癌有效, 但有效率均较低, 且可重复性差, 循证学证据不足. 而上述两组研究取得的结果令人鼓舞, 最终奠定了多吉美作为晚期肝癌治疗首选药物的地位.
虽然目前的证据表明多吉美治疗肝癌有效, 但单药治疗的中位OS延长的时间仍非常有限, 在SHARP研究中, 治疗组的中位OS较对照组仅延长了2.8 mo. 因此, 要提高肝癌患者的远期生存率, 多种治疗方式的联合成为必然.
中晚期肝癌的传统治疗首选肝动脉化疗栓塞(transcatheter arterial chemoembolization, TACE), 已有多项RCT研究证实了TACE可显著延长肝癌患者的生存期[4,5]. 但TACE的远期疗效欠佳, 制约其疗效的主要因素在于栓塞后残瘤的复发及转移. 临床实践中发现, 即使我们认为非常彻底的栓塞也不能保证完全消灭瘤组织, 残瘤细胞在特定机制的调控下逐渐适应了这种乏氧、乏营养微环境, 血管内皮生长因子(vascular endothelial growth factor, VEGF)高表达, 肿瘤血管生成, 侵袭转移能力提高[6,7]. TACE后残存瘤细胞可在乏氧条件下通过信号传递诱导乏氧诱导因子-1α(hypoxia inducible factor 1, HIF-1α)表达, 增加VEGF基因转录, 上调VEGF、PDGF及其受体表达, 刺激启动血管形成, 造成肿瘤局部复发[8]. 因此, 如何降低TACE后VEGF的表达是提高TACE远期疗效的关键.
多吉美作为一种新型的分子靶向治疗药物, 一方面通过抑制RAF-1激酶和B-RAF激酶, 抑制ERK的磷酸化, 达到抑制肿瘤细胞增殖作用的目的; 另一方面通过抑制细胞表面VEGFR-2、VEGFR-3、PDGFR-B、FLT-3和c-KIT受体的自身磷酸化, 影响下游酪氨酸激酶活性, 抑制肿瘤新生血管生成. 正是基于多吉美能够抑制肿瘤新生血管生成这一机制, 使得TACE联合多吉美治疗原发性肝癌理论上存在可行性.
目前, 国际上已有多个中心在进行多吉美联合TACE治疗原发性肝癌的临床实验, 但最终结果尚未公布. 在我们的这组病例中, 介入治疗(主要为TACE)联合多吉美治疗原发性肝癌的中位TTP达到48 wk, 而多吉美单药治疗组的中位TTP仅为16 wk. 从这组数据中我们大致可以看出, 多吉美单药治疗组的中位TTP时间与以亚洲人群为样本的Oriental研究结果相似, 低于以欧洲人群为样本的SHARP研究, 而联合治疗组的中位TTP时间则明显高于上述两组研究. 两组病例的肿瘤反应情况也有明显的不同, 参照AASLD提出的RECIST修订标准, 联合治疗组的完全缓解率达到4/13, 而单药治疗组则没有完全缓解的病例. 从上述结果可以看出, 多吉美联合介入治疗可明显延长患者的TTP时间, 增加肿瘤反应率.
我们注意到在两组病例中, 患者的基线情况存在差异, 而且由于样本量小, 所得结论缺乏统计学的支持. 尽管如此, 上述两组病例疗效的巨大差异仍使我们相信, 多吉美联合介入治疗原发性肝癌的前景广阔, 不仅理论上存在可行性, 实践治疗中同样会让患者获得更大的临床获益.
多吉美作为一种新型的靶向药物, 已被证实在临床肝癌治疗中的作用及地位, 但他与传统的肝动脉化疗栓塞的联合是否会有协同作用, 尚待研究.
张小晋, 主任医师, 北京积水潭医院消化内科.
本文就多吉美联合介入治疗原发性肝癌与多吉美单药治疗的疗效进行对比分析, 首次从临床获益方面得出结论, 即多吉美与介入联合在原发性肝癌的治疗上具有协同作用.
本研究证实了多吉美与肝动脉化疗栓塞在原发性肝癌的治疗上具有协同作用, 为其临床进一步推广提供依据.
本研究选题较好, 结论有一定临床应用价值.
编辑: 李军亮 电编:吴鹏朕
| 1. | Llovet JM, Di Bisceglie AM, Bruix J, Kramer BS, Lencioni R, Zhu AX, Sherman M, Schwartz M, Lotze M, Talwalkar J. Design and endpoints of clinical trials in hepatocellular carcinoma. J Natl Cancer Inst. 2008;100:698-711. [PubMed] [DOI] |
| 2. | Llovet JM, Ricci S, Mazzaferro V, Hilgard P, Gane E, Blanc JF, de Oliveira AC, Santoro A, Raoul JL, Forner A. Sorafenib in advanced hepatocellular carcinoma. N Engl J Med. 2008;359:378-390. [PubMed] [DOI] |
| 3. | Cheng AL, Kang YK, Chen Z, Tsao CJ, Qin S, Kim JS, Luo R, Feng J, Ye S, Yang TS. Efficacy and safety of sorafenib in patients in the Asia-Pacific region with advanced hepatocellular carcinoma: a phase III randomised, double-blind, placebo-controlled trial. Lancet Oncol. 2009;10:25-34. [PubMed] [DOI] |
| 4. | Marelli L, Stigliano R, Triantos C, Senzolo M, Cholongitas E, Davies N, Tibballs J, Meyer T, Patch DW, Burroughs AK. Transarterial therapy for hepatocellular carcinoma: which technique is more effective? A systematic review of cohort and randomized studies. Cardiovasc Intervent Radiol. 2007;30:6-25. [PubMed] [DOI] |
| 5. | Llovet JM, Bruix J. Systematic review of randomized trials for unresectable hepatocellular carcinoma: Chemoembolization improves survival. Hepatology. 2003;37:429-442. [PubMed] [DOI] |
| 6. | Sergio A, Cristofori C, Cardin R, Pivetta G, Ragazzi R, Baldan A, Girardi L, Cillo U, Burra P, Giacomin A. Transcatheter arterial chemoembolization (TACE) in hepatocellular carcinoma (HCC): the role of angiogenesis and invasiveness. Am J Gastroenterol. 2008;103:914-921. [PubMed] [DOI] |
| 7. | Shim JH, Park JW, Kim JH, An M, Kong SY, Nam BH, Choi JI, Kim HB, Lee WJ, Kim CM. Association between increment of serum VEGF level and prognosis after transcatheter arterial chemoembolization in hepatocellular carcinoma patients. Cancer Sci. 2008;99:2037-2044. [PubMed] |