修回日期: 2009-12-30
接受日期: 2010-01-04
在线出版日期: 2010-02-08
目的: 探讨胃癌患者血浆p16和MGMT基因启动子区甲基化状态.
方法: 采用巢式甲基化特异性PCR法(nested methylation-specific PCR, nMSP)对69例胃癌患者血浆中p16和MGMT基因启动子区甲基化状态进行研究. 同时以16例健康体检作为对照.
结果: 在受检的69例胃癌患者中, p16、MGMT基因启动子区甲基化率分别为30.4%(21/69)、17.4%(12/69). 对照组未见p16、MGMT基因启动子区甲基化. 胃癌患者血浆中存在p16和MGMT基因启动子区甲基化, 其中p16基因启动子区甲基化与对照组相比差异显著, 具有统计学意义.
结论: 检测血浆循环DNA中p16、MGMT基因启动子区的甲基化状态, 可为胃癌的早期分子诊断提供了有用信息.
引文著录: 王燕, 周力, 陈晓琴, 张维, 王岚. 巢式MSP法检测胃癌患者血浆p16、MGMT基因甲基化. 世界华人消化杂志 2010; 18(4): 384-387
Revised: December 30, 2009
Accepted: January 4, 2010
Published online: February 8, 2010
AIM: To analyze aberrant promoter methylation of the p16 and O-6-methylguanine-DNA methyltransferase (MGMT) genes in serum DNA samples from patients with gastric carcinoma.
METHODS: Nested methylation-specific polymerase chain reaction (nMSP) was adopted to detect the promoter methylation of the p16 and MGMT genes in serum DNA samples from 69 patients with gastric carcinoma. Serum DNA samples from 16 healthy individuals were used as normal controls.
RESULTS: The frequencies of p16 and MGMT promoter methylation in patients with gastric carcinoma were 30.4% and 17.4%, respectively. In contrast, no p16 and MGMT promoter methylation was detected in normal controls. The frequencies of p16 and MGMT promoter methylation were significantly higher in patients with gastric carcinoma than in normal controls (both P < 0.05).
CONCLUSION: Detection of p16 and MGMT promoter methylation in serum DNA samples can provide valuable information for molecular diagnosis of early gastric carcinoma.
- Citation: Wang Y, Zhou L, Chen XQ, Zhang W, Wang L. Detection of p16 and MGMT promoter methylation in gastric carcinomas by nested methylation-specific polymerase chain reaction. Shijie Huaren Xiaohua Zazhi 2010; 18(4): 384-387
- URL: https://www.wjgnet.com/1009-3079/full/v18/i4/384.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i4.384
p16基因是机体重要的抑癌基因, 通过抑制细胞周期蛋白依赖性激酶(cyclin dependent kinases 4/6, CDK4/6)活性, 使细胞周期停滞于G1/S期, 对细胞周期起着负性调控作用. MGMT基因编码的O6-甲基鸟嘌呤-DNA甲基转移酶(O6-methylguanine-DNA methyltransferase, MGMT)是一种高效的DNA直接修复酶, 可修复由烷化剂引起的DNA损伤, 在DNA修复中发挥重要作用. 启动子区高甲基化是引起基因沉默的主要机制之一, 可能影响基因功能的正常发挥[1]. p16基因是目前甲基化研究较多的肿瘤抑制基因, 已有研究显示胃癌组织中存在p16基因启动子区甲基化+, 相比之下, 对胃癌患者MGMT基因启动子甲基化状态的研究较少. 在恶性肿瘤患者血清或血浆中存在外周血循环DNA, 这种细胞外游离DNA来源于肿瘤细胞[3], 已有研究证实肿瘤患者血清或血浆DNA与原发灶组织存在一致的基因改变, 为应用外周血进行分子诊断提供了可能. 为了解胃癌患者外周血中p16和MGMT基因启动子区甲基化状态, 本研究采用巢式甲基化特异性PCR法(nested methylation-specific PCR, nMSP)对胃癌患者进行血浆p16、MGMT基因启动子区甲基化状态研究, 现报道如下.
2008-06/2009-09贵阳医学院附属医院收治的经确诊的胃癌患者69例, 其中男49例, 女20例, 年龄23-72(平均年龄51)岁, 所有患者诊断标准参照《实用内科学》[4]. 同时以16例体检者为对照, 其中男7例, 女5例, 年龄24-57(平均年龄41)岁. 亚硫酸氢钠(Sigma)、对苯二酚(Sigma)、矿物油(Sigma)、Wizard DNA Clean-Up System(Promega公司)、CpG甲基转移酶M.SssⅠ(New England Biolabs)、琼脂糖(西班牙分装)、Taq酶(TaKaRa)、100 bp DNA Marker(天根)、Tris饱和酚(天津灏洋生物制品有限责任公司)、蛋白酶K(德国Merck). DSHZ-300多用途水浴恒温振荡器(江苏太仓市实验设备厂)、TU-1810紫外可见分光光度计(北京普析通用仪器有限责任公司)、梯度PCR扩增仪(德国Eppendorf 5330型)、DNA成像分析仪(美国Bio-Rad公司). 引物合成参照文献[5-7], 由上海捷瑞生物工程有限公司合成(表1).
| 名称 | 引物序列 | 产物大小(bp) 退火温度(℃) | |
| p16-ff | 5'-GAAGAAAGAGGAGGGGTTGG-3' | 280 | 60 |
| p16-fr | 5'-CTACAAACCCTCTACCCACC-3' | ||
| p16-mf | 5'-TTATTAGAGGGTGGGGCGGATCGC-3' | 150 | 67 |
| p16-mr | 5'-GACCCCGAACCGCGACCGTAA-3' | ||
| p16-uf | 5'-TTATTAGAGGGTGGGGTGGATTGT-3' | 151 | 62 |
| p16-ur | 5'-CAACCCCAAACCACAACCATAA-3' | ||
| MGMT-ff | 5'-GGATATGTTGGGATAGTT-3' | 289 | 52 |
| MGMT-fr | 5'-CCAAAAACCCCAAACCC-3' | ||
| MGMT-mf | 5'-TTTCGACGTTCGTAGGTTTTCGC-3' | 81 | 66 |
| MGMT-mr | 5'-GCACTCTTCCGAAAACGAAACG-3' | ||
| MGMT-uf | 5'-TTTGTGTTTTGATGTTTGTAGGTTTTTGT-3' | 93 | 66 |
| MGMT-ur | 5'-AACTCCACACTCTTCCAAAAACAAAACA-3' |
1.2.1 标本收集: 采集受检者外周血2 mL, 经EDTA抗凝, 分离血浆, -80 ℃保存备用.
1.2.2 常规酚-氯仿法提取血浆DNA: 提取的血浆DNA经紫外可见分光光度计定量, 选择A260/280>1.7的DNA样本进行后续试验, DNA样本保存于-20 ℃.
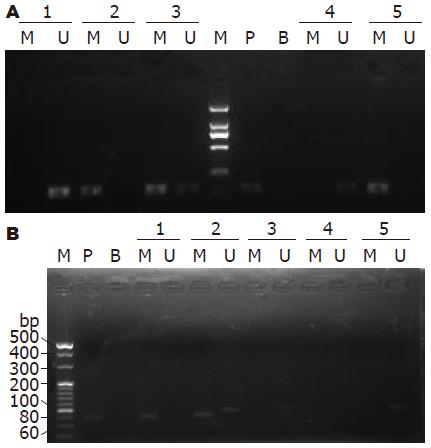
1.2.3 nMSP法检测胃癌患者p16、MGMT基因启动子区甲基化状态: (1)基因组DNA的亚硫酸盐修饰: 参考Herman等[8]的方法, 取约1.5 μg DNA, 加入超纯水至50 μL; 加入5.5 μL新鲜配制的3 mol/L NaOH, 37 ℃水浴30 min后加入30 μL 10 mmol/L氢醌和520 μL 3 mol/L亚硫酸氢钠(pH5.0), 轻柔混匀后加入100 μL石蜡油覆盖液面, 55 ℃避光水浴16 h; 次日取出样本, 按照Promega Wizard Cleanup System说明进行DNA纯化, 收集50洗脱液, 加入5.5 μL新鲜配制的3 mol/L NaOH, 室温放置15 min, 加入33 μL 10 mol/L乙酸铵、1 μL 10 g/L糖原及165 μL冰无水乙醇沉淀DNA, -20 ℃过夜; 次日取出后离心弃上清, 再用100 μL 700 mL/L乙醇洗涤2次, 离心弃上清, 室温干燥后, 加入35 μL超纯水溶解, -20 ℃保存备用. (2)n-MSP法检测p16、MGMT基因启动子甲基化状态: 以亚硫酸盐修饰后的DNA样本为模板, 分别以p16启动子区引物(p16-ff、p16-fr)和MGMT启动子区引物(MGMT-ff、MGMT-fr)进行第1轮PCR, 扩增p16、MGMT基因启动子区, 反应体系: 10×PCR缓冲液2.5 μL、2 mmol/L Mg2+、200 μmol/L dNTPs、引物10 pmol、Taq DNA聚合酶1 U、硫化处理DNA 3 μL, 用ddH2O补齐25 μL. 扩增程序: 95 ℃预变性5 min; 95 ℃ 45 s, 退火45 s(p16基因60 ℃、MGMT基因52 ℃), 72 ℃ 45 s, 扩增35个循环; 再经72 ℃延伸10 min. 以第1轮PCR扩增出p16、MGMT基因启动子区目的条带的PCR产物经30倍稀释后取2 μL为模板, 用p16基因甲基化引物(p16-mf、p16-mr)和非甲基化引物(p16-uf、p16-ur)以及MGMT基因甲基化引物(MGMT-mf、MGMT-mr)和非甲基化引物(MGMT-uf、MGMT-ur)进行第2轮PCR, 反应体系同第1轮PCR, 扩增程序: 95 ℃预变性5 min; 95 ℃, 15 s, 退火15 s(p16基因甲基化引物为65 ℃, 非甲基化引物为62 ℃; MGMT基因甲基化引物、非甲基化引物为66 ℃), 72 ℃, 15 s, 扩增28个循环; 再经72 ℃延伸10 min. 扩增产物经2%琼脂糖凝胶电泳检测, 紫外成像仪下观察结果并拍照. 每批标本均同时扩增甲基化酶SssⅠ修饰的胎盘DNA作为甲基化阳性对照, 以去离子水为模板的反应体系作为阴性对照.
统计学处理 采用SPSS统计学软件进行χ2检验.
以甲基化处理的胎盘DNA为阳性对照经甲基化引物扩增后出现相应片段, 双蒸水作空白对照经甲基化引物扩增无相应片段出现, 同时甲基化引物与非甲基化引物扩增必出现任一条或两条均扩增出相应条带时, 满足以上条件时判为结果有效. 仅非甲基化引物扩增出相应片段为甲基化阴性. 仅有甲基化引物扩增出相应片段即为完全甲基化, 甲基化引物与非甲基化引物均扩增出相应片段为不完全甲基化, 完全甲基化和不完全甲基化均计为甲基化检测阳性.
DNA甲基化可通过不改变基因序列而引起基因表达失活, 是肿瘤形成过程中基因沉默的重要机制之一[1]. DNA甲基化状态改变往往出现在细胞恶性增殖早期, 并随恶性肿瘤的发生、发展而变化. 循环DNA存在于血液(血清或血浆)、滑膜液等体液中[3]. 应用血清或血浆进行人类肿瘤某些抑癌基因甲基化状态的研究报道已见于胶质瘤[9]、乳腺癌[10]、胃癌[11,12]等. 由于外周血循环DNA的水平较肿瘤组织中相应DNA水平低, 且基因组DNA在进行硫化处理过程中存在降解, 因此本研究中采用较普通较甲基化特异性PCR法(MSP)具有更高灵敏度的巢式甲基化特异性PCR法(nMSP)进行相关研究[13]. 结果显示胃癌患者血浆样本中存在p16和MGMT基因启动子区高甲基化改变.
p16基因作为机体重要的抑癌基因, 其启动子区甲基化已被证实存在于多种人类肿瘤中. 以往研究认为基因纯合性缺失或点突变是基因表达失活的主要机制, 在本课题组前期对胃癌患者外周血p16基因的相关研究中, 结果显示p16基因第1、2外显子缺失率为8.7%(6/69), 所有检测样本未见点突变. 本研究对69例胃癌患者外周血基因组p16基因启动子区甲基化状态进行检测, 结果显示p16基因启动子区存在甲基化, 甲基化率为30.4%, 与对照组相比差异具有统计学意义. Ikoma等[12]采用MSP法检测到48%(52/109)的胃癌患者外周血中存在包括p16基因在内的至少一个基因高甲基化异常. 以上研究结果表明p16基因启动子区甲基化是胃癌中p16基因失活的主要机制. 由于p16基因启动子甲基可能引起表达失活, 失去对细胞周期正常的负性调控作用, 致细胞过度增殖, 细胞周期加速, 使未修复的DNA过早进入S期, 从而导致肿瘤的发生.
MGMT是机体重要的DNA修复基因. 国内段家华等[14]和雷晓华等[15]分别应用加强型原位杂交三相寡核苷酸探针高效标记技术和免疫组织化学法检测胃癌组织中MGMT基因和蛋白表达, 结果显示胃癌组织中MGMT低表达或表达不足. 本研究对69例胃癌患者血浆中MGMT基因启动子区甲基化状态研究, 结果显示甲基化发生率为17.4%(12/69). 以上研究提示胃癌中MGMT基因低表达不足可能与MGMT基因高甲基化有关.
肿瘤发生过程较为复杂, 往往涉及多种基因[16,17]的异常改变. 本研究证实胃癌患者血浆中p16和MGMT基因存在启动子区高甲基化表现, 其中p16基因甲基化率与Ksiaa等[16]采用胃癌组织进行研究所得甲基化率相似(29.4%). 本研究中MGMT基因甲基化率(17.4%)低于Ksiaa等报道(36.8%), 但Zhao等[17]研究也显示胃癌组织中较低的MGMT甲基化率(6.9%), 以上研究结果不一致与所用受检样本及检测方法有关, 因此尚需进一步研究以证实胃癌患者中MGMT基因甲基化状态.
基因表达的调控机制较为复杂, 本研究成功运用nMSP法对胃癌患者外周血p16和MGMT基因甲基化状态研究, 但p16和MGMT基因高甲基化与其表达的相关性及在临床上的运用价值尚需深入研究.
p16基因是目前甲基化研究较多的肿瘤抑制基因, 已有研究显示胃癌组织中存在p16基因启动子区甲基化, 相比之下, 对胃癌患者MGMT基因启动子甲基化状态的研究较少. 在恶性肿瘤患者血清或血浆中存在外周血循环DNA, 这种细胞外游离DNA来源于肿瘤细胞, 已有研究证实肿瘤患者血清或血浆DNA与原发灶组织存在一致的基因改变, 为应用外周血进行分子诊断提供了可能.
崔立红, 副教授, 中国人民解放军海军总医院消化内科
p16和MGMT基因高甲基化与其表达的相关性及在临床上的运用价值尚需深入研究.
在本课题组前期对胃癌患者外周血p16基因的相关研究中, 结果显示p16基因第1、2外显子缺失率为8.7%(6/69), 所有检测样本未见点突变.
本研究用nMSP法对胃癌患者外周血p16和MGMT基因甲基化状态进行观察, 发现了一些倾向, 但基因表达的调控机制较为复杂, p16和MGMT基因高甲基化与其表达的相关性及在临床上的运用价值尚需深入研究. 本文有一定研究价值, 可增加例数继续观察总结, 但不宜过早下结论.
编辑: 李军亮 电编:吴鹏朕
| 1. | Esteller M. Epigenetic gene silencing in cancer: the DNA hypermethylome. Hum Mol Genet. 2007;16 Spec No 1:R50-R59. [PubMed] [DOI] |
| 2. | Zou XP, Zhang B, Zhang XQ, Chen M, Cao J, Liu WJ. Promoter hypermethylation of multiple genes in early gastric adenocarcinoma and precancerous lesions. Hum Pathol. 2009;40:1534-1542. [PubMed] [DOI] |
| 3. | Sunami E, Vu AT, Nguyen SL, Hoon DS. Analysis of methylated circulating DNA in cancer patients' blood. Methods Mol Biol. 2009;507:349-356. [PubMed] [DOI] |
| 5. | Palmisano WA, Divine KK, Saccomanno G, Gilliland FD, Baylin SB, Herman JG, Belinsky SA. Predicting lung cancer by detecting aberrant promoter methylation in sputum. Cancer Res. 2000;60:5954-5958. [PubMed] |
| 6. | Abbaszadegan MR, Moaven O, Sima HR, Ghafarzadegan K, A'rabi A, Forghani MN, Raziee HR, Mashhadinejad A, Jafarzadeh M, Esmaili-Shandiz E. p16 promoter hypermethylation: a useful serum marker for early detection of gastric cancer. World J Gastroenterol. 2008;14:2055-2060. [PubMed] [DOI] |
| 7. | Bae SI, Lee HS, Kim SH, Kim WH. Inactivation of O6-methylguanine-DNA methyltransferase by promoter CpG island hypermethylation in gastric cancers. Br J Cancer. 2002;86:1888-1892. [PubMed] [DOI] |
| 8. | Herman JG, Graff JR, Myöhänen S, Nelkin BD, Baylin SB. Methylation-specific PCR: a novel PCR assay for methylation status of CpG islands. Proc Natl Acad Sci U S A. 1996;93:9821-9826. [PubMed] [DOI] |
| 9. | Wakabayashi T, Natsume A, Hatano H, Fujii M, Shimato S, Ito M, Ohno M, Ito S, Ogura M, Yoshida J. p16 promoter methylation in the serum as a basis for the molecular diagnosis of gliomas. Neurosurgery. 2009;64:455-461; discussion 461-462. [PubMed] [DOI] |
| 10. | Shukla S, Mirza S, Sharma G, Parshad R, Gupta SD, Ralhan R. Detection of RASSF1A and RARbeta hypermethylation in serum DNA from breast cancer patients. Epigenetics. 2006;1:88-93. [PubMed] |
| 11. | Leung WK, To KF, Chu ES, Chan MW, Bai AH, Ng EK, Chan FK, Sung JJ. Potential diagnostic and prognostic values of detecting promoter hypermethylation in the serum of patients with gastric cancer. Br J Cancer. 2005;92:2190-2194. [PubMed] [DOI] |
| 12. | Ikoma H, Ichikawa D, Daito I, Nobuyuki T, Koike H, Okamoto K, Ochiai T, Ueda Y, Yamagishi H, Otsuji E. Clinical application of methylation specific-polymerase chain reaction in serum of patients with gastric cancer. Hepatogastroenterology. 2007;54:946-950. [PubMed] |
| 13. | Carless M. Investigation of genomic methylation status using methylation-specific and bisulfite sequencing polymerase chain reaction. Methods Mol Biol. 2009;523:217-234. [PubMed] [DOI] |
| 14. | 段 家华, 孙 幼芳, 曾 桃英, 王 君. 胃癌MGMT基因表达的临床病理意义. 华中科技大学学报(医学版). 2006;35:807-809. |
| 16. | Ksiaa F, Ziadi S, Amara K, Korbi S, Trimeche M. Biological significance of promoter hypermethylation of tumor-related genes in patients with gastric carcinoma. Clin Chim Acta. 2009;404:128-133. [PubMed] [DOI] |
| 17. | Zhao YF, Zhang YG, Tian XX, Juan Du, Jie Zheng. Aberrant methylation of multiple genes in gastric carcinomas. Int J Surg Pathol. 2007;15:242-251. [PubMed] [DOI] |