修回日期: 2010-11-14
接受日期: 2010-11-23
在线出版日期: 2010-12-18
目的: 研究氨诱导体外培养大鼠脑星形胶质细胞凋亡及坏死的作用, 探讨肝性脑病的发病机制.
方法: 体外原代培养大鼠脑星形胶质细胞并免疫细胞化学鉴定(神经胶质纤维酸性蛋白阳性), 随机分为氨低浓度组(NH4Cl浓度为2.5 mmol/L), 氨高浓度组(NH4Cl浓度为5 mmol/L)和对照组(不加处理). 分别作用24、48、72 h后, 用流式细胞仪测定星形胶质细胞坏死和凋亡的比率.
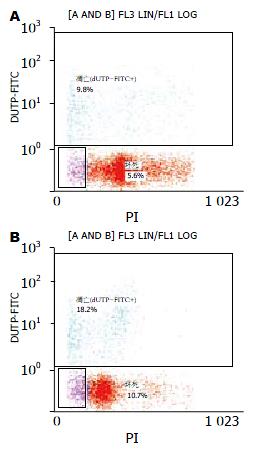
结果: 2.5 mmol/L浓度的NH4Cl即可出现大鼠星形胶质细胞发生细胞凋亡及坏死, 随着NH4Cl浓度的提高(5 mmol/L)和作用时间延长(48、72 h), 胶质细胞细胞凋亡和坏死明显增加. 氨高浓度组24、48、72 h细胞凋亡率和坏死率均高于对照组(12.5%±4.0%vs 7.7%±1.9%, 9.3%±1.6% vs 6.3%±0.7%; 17.7%±4.2% vs 8.5%±1.3%, 10.5%±2.8% vs 7.2%±1.1%; 23.9%±4.1% vs 9.6%±1.9%, 11.4%±2.5% vs 7.9%±1.5%, 均P<0.05).
结论: 氨可诱导体外培养的大鼠脑星形胶质细胞坏死和凋亡, 且与氨的浓度和作用时间相关.
引文著录: 胥莹, 陈学平, 杨晋辉, 张渊智, 徐智媛, 唐映梅. 氨培养对大鼠脑星形胶质细胞凋亡及坏死的影响. 世界华人消化杂志 2010; 18(35): 3787-3790
Revised: November 14, 2010
Accepted: November 23, 2010
Published online: December 18, 2010
AIM: To investigate whether treatment with ammonia induces apoptosis and necrosis of rat astrocytes in vitro and to analyze the pathogenesis of hepatic encephalopathy.
METHODS: Primary astrocytes isolated from the cerebral cortex of newborn rats were cultured in vitro and identified by immunocytochemistry (positive for glial fibrillary acidic protein). Cells were then randomly assigned to low-concentration ammonia group (treated with 2.5 mmol/L NH4Cl), high-concentration ammonia group (treated with 5 mmol/L NH4Cl), and control group (untreated). After culture for 24, 48, and 72 h, cell apoptosis and necrosis were detected by flow cytometry.
RESULTS: Treatment with ammonia at a concentration of 2.5 mmol/L could induce astrocyte apoptosis and necrosis, and apoptosis- and necrosis-inducing activity of ammonia was concentration- and time-dependent. Compared with the control group, the apoptosis and necrosis rates of astrocytes in the high-concentration ammonia group were significantly higher (24 h: 12.5% ± 4.0% vs 7.7% ± 1.9%, 9.3% ± 1.6% vs 6.3% ± 0.7%; 48 h: 17.7% ± 4.2% vs 8.5% ± 1.3%, 10.5% ± 2.8% vs 7.2% ± 1.1%; 72 h: 23.9% ± 4.1% vs 9.6% ± 1.9%, 11.4% ± 2.5% vs 7.9% ± 1.5%, all P < 0.05).
CONCLUSION: Treatment with ammonia could induce astrocyte apoptosis and necrosis in vitro in a time- and concentration-dependent manner.
- Citation: Xu Y, Chen XP, Yang JH, Zhang YZ, Xu ZY, Tang YM. Treatment with ammonia induces apoptosis and necrosis of rat astrocytes in vitro. Shijie Huaren Xiaohua Zazhi 2010; 18(35): 3787-3790
- URL: https://www.wjgnet.com/1009-3079/full/v18/i35/3787.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i35.3787
肝性脑病指由肝功能严重失调或障碍所致, 以代谢紊乱为主要特征的中枢神经系统功能失调的综合征, 是临床上各种终末期肝病最常见的死亡原因. 目前肝性脑病的发病机制仍不十分清楚, 人们根据肝性脑病的不同特征和表现, 提出了不同的假说, 其中, 氨中毒学说占重要地位. 过去的研究主要集中在于氨对神经细胞的毒性和脑的能量代谢方面, 而对氨与星形胶质细胞的功能代谢, 死亡形式关系研究较少. 本研究拟通过观察氨对体外培养大鼠星形胶质细胞影响, 探讨肝性脑病时血氨增高与星形胶质细胞凋亡和坏死的关系.
SP免疫组织化学试剂盒(福州迈新生物公司); GFAP抗体(Sigma)0.01%多聚赖氨酸(Sigma); DMEM培养基(HyClone公司); 氯化铵(天津化学试剂公司); 流式细胞仪(美国Beckman公司Coulter Epics XL). 实验动物: 新生1-2 d昆明种小鼠, 由昆明医学院实验动物中心提供.
1.2.1 原代星形胶质细胞培养: 取新生小鼠剪下头部于盛有750 mL/L的培养皿中消毒约2 min, 再移入盛有D-Hanks液的培养皿中, 在掀开颅骨, 暴露全脑后用在显微镜下开始从腹侧向背侧剥离脑膜, 从正中矢状位向两侧掀开大脑, 夹取边缘的大脑皮质. 将取下大脑皮质夹成1 mm×1 mm×1 mm左右组织块, 于离心管中, 加入0.125%胰蛋白酶, 置37 ℃水浴消化30 min, 其间每2-3 min晃动1次, 然后加入预冷的DMEM培养液终止消化, 取出离心5 min后弃上清液, 加入适量种植培养液, 吹打混匀后取0.6-0.8份的大脑皮质加入10 mL的种植培养液[其中每1 mL培养液中含有10 ng的上表皮生长因子(epidermal growth factor, EGF)]接种于预先经多聚赖氨酸包被的24孔培养板中, 每孔以400 µL接种后, 放入50 mL/L CO2培养箱中, 每周换液1次.
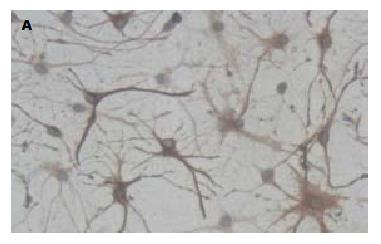
1.2.2 星形胶质细胞鉴定: 细胞培养至第3周时进行实验, 将培养的细胞用40 g/L多聚甲醛固定30 min, PBS充分漂洗, 然后按SP法行神经胶质纤维酸性蛋白(glial fibrillary acidic protein, GFAP)免疫细胞化学染色, DAB显色, 进行阳性细胞计数, 所培养的细胞90%以上为GFAP阳性细胞(图1).
1.2.3 分组: 氨低浓度组(NH4Cl 2.5 mmol/L), 氨高浓度组(NH4Cl 5 mmol/L), 对照组(不加任何处理).
1.2.4 流式细胞仪观察各组中细胞凋亡和坏死情况: 加药后各组细胞分别培养24、48、72 h后, 弃培养基, 终止氨作用. PBS冲洗2 次, 0.125%胰蛋白酶消化, 收集细胞, 1 mL PBS重悬, 300目尼龙网过滤后离心, 弃上清, 收集细胞制成细胞悬液, 调整细胞浓度至1×106/mL. 70%冰乙醇固定, PBS轻洗1次后加TdT标记液37℃孵育1-2 h, PBS轻洗1次, 避光在37 ℃与100 µL的染色缓冲液孵育30 min, 含0.1% TritonX-100的PBS轻洗1次, 用1 mL PBS(含5 g/L PI, 0.1% RNase A)重悬. 使用Coulter EPICS-XL 流式细胞仪上机检测各类细胞百分数, Cell quest软件进行计算机定量分析.
统计学处理 采用SPSS 11.5统计分析软件处理实验数据, 所得数据以mean±SD表示, 计数资料采用t检验.
氨低浓度组大鼠星形胶质细胞发生细胞凋亡及坏死, 在低氨环境24 h这种情况并不明显, 与对照组相比无统计学意义(P>0.05). 随着NH4Cl浓度的提高(5 mmol/L)和作用时间延长, 胶质细胞细胞凋亡和坏死明显增加, 其凋亡细胞数和坏死细胞数占总体细胞数的百分率明显高于正常对照组(P<0.05), 且氨作用时间越长, 浓度越高, 细胞坏死也更明显(表1, 图2).
星形胶质细胞是神经组织内数量最多、分布最广的胶质细胞, 星形胶质约占脑总体积的50%. 传统的观点认为, 星形胶质细胞只是神经系统的支持细胞; 近年来越来越多的资料表明胶质细胞更多作用. 星形胶质细胞表面具有电压依赖的Na+、K+及Ca2+通道, 分布着许多神经递质、神经肽、激素及神经营养因子受体, 并能合成及分泌多种神经活性物质, 在维持神经细胞内外环境、生存、迁移、免疫调节、信号转导、轴突生长及功能整合等方面具有重要作用, 与中枢神经系统疾病密切相关[1-3].
氨中毒学说是肝性脑病发生的最重要发病机制. 肝功能减退时肝对氨的代谢能力降低形成高氨血症, 进入中枢的氨首先在脑星形胶质细胞内在谷氨酰胺合成酶的作用下谷氨酸结合形成谷氨酰胺解毒. 由于脑内缺乏尿素循环, 星形胶质细胞是氨在脑内唯一的解毒场所. 高氨状态下星形胶质细胞出现功能, 代谢乃至形态结构的变化. 有关氨和神经细胞凋亡的研究已有很多[4,5], 但是由于长期以来对星形胶质细胞功能的忽视, 从而对胶质细胞是否发生凋亡和坏死了解不多. 我们的实验发现低浓度的氨即可诱导星形胶质细胞发生凋亡和坏死, 随着氨作用时间越长, 浓度越高, 细胞凋亡增多, 细胞坏死也更明显. 对氨引起星形胶质细胞的凋亡和坏死的机制目前并不是很清楚. 可能的机制是在高氨血症时, 星形细胞表达谷氨酸转运体GLT-1、GLAST的蛋白和基因显著下降. 从而使胶质细胞对谷氨酸盐的重摄取降低, 并可有星形胶质细胞源谷氨酸盐释放增加, 其结果是细胞外谷氨酸盐增高[6-9]. 胡波等[10]证实在无钙的细胞外液中, 谷氨酸仍可诱发胶质细胞内游离钙的升高, 而钙超载是细胞坏死和发生凋亡的重要机制之一. 在氨浓度升高时, 氨可能通过细胞受体、第二信使的传递, 影响基因调控蛋白, 从而细胞凋亡和坏死. 由于胶质细胞具有各种受体和其他类型的电压门控和受体门控通道, 血氨升高可使谷氨酸盐受体的NMDA亚型活化, 导致细胞内钙浓度增加, 从而启动钙依赖性NO和cGMP的合成增加, 使脑内ATP耗竭, 产生能量障碍, 导致脑水肿NMDA受体激活NMDA可引起Ca2+过度内流导致胶质细胞凋亡或坏死[11,12].
此外, 氨导致星形胶质细胞细胞形态改变及凋亡和坏死可能与氧化应激作用, 线粒体通透性转变和谷氨酰胺渗透, 影响能量代谢, 钙内流增加, 以及细胞因子共同作用等有关[13-18].
本实验结果显示氨对原代培养星形胶质细胞具有毒性作用, 其引起病变的严重程度与氨的浓度和作用时间相关. 氨引起星形胶质细胞凋亡和坏死机制尚未完全清楚, 通过降低血氨浓度、抑制谷氨酸受体激活及钙内流、抗氧化、减少谷氨酰胺渗透等干预措施保护星形胶质细胞可望成为治疗肝性脑病的新途径之一.
肝性脑病是临床上各种终末期肝病最常见的死亡原因, 其发病机制尚未完全阐明,已知是多种因素综合作用的结果. 目前存在的学说除了氨中毒、假性神经递质、血浆氨基酸失衡和GABA/BZ复合受体学说外, 近年发现锰、色氨酸、内毒素及肿瘤坏死因子等也参与肝性脑病的发病. 其中, 氨中毒学说研究最多.
吴志勇, 教授, 上海交通大学医学院附属仁济医院普外科
脑水肿和星状胶质细胞水肿是肝性脑病的病理基础, 星状胶质细胞是脑内主要的细胞成分. 过去认为星形胶质细胞只是神经系统的支持细胞, 近年来发现星形胶质细胞在维持神经细胞内外环境、信号转导等方面具有重要作用, 与中枢神经系统疾病密切相关. 目前肝性脑病发病机制中血氨升高引起星状胶质细胞形态改变是研究热点之一.
氨对星形胶质细胞具有直接毒性作用. 通过降低血氨浓度、抑制谷氨酸受体激活及钙内流、抗氧化、减少谷氨酰胺渗透等干预措施, 保护星形胶质细胞可成为肝性脑病治疗的新靶点.
本文选题尚可, 为肝性脑病的氨中毒学说提供了依据.
编辑: 曹丽鸥 电编:李薇
| 2. | Aschner M, Sonnewald U, Tan KH. Astrocyte modulation of neurotoxic injury. Brain Pathol. 2002;12:475-481. [PubMed] [DOI] |
| 3. | Swanson RA, Ying W, Kauppinen TM. Astrocyte influences on ischemic neuronal death. Curr Mol Med. 2004;4:193-205. [PubMed] [DOI] |
| 5. | Llansola M, Boscá L, Felipo V, Hortelano S. Ammonia prevents glutamate-induced but not low K(+)-induced apoptosis in cerebellar neurons in culture. Neuroscience. 2003;117:899-907. [PubMed] [DOI] |
| 6. | Chan H, Butterworth RF. Evidence for an astrocytic glutamate transporter deficit in hepatic encephalopathy. Neurochem Res. 1999;24:1397-1401. [PubMed] [DOI] |
| 7. | Zhou BG, Norenberg MD. Ammonia downregulates GLAST mRNA glutamate transporter in rat astrocyte cultures. Neurosci Lett. 1999;276:145-148. [PubMed] [DOI] |
| 8. | Chan H, Hazell AS, Desjardins P, Butterworth RF. Effects of ammonia on glutamate transporter (GLAST) protein and mRNA in cultured rat cortical astrocytes. Neurochem Int. 2000;37:243-248. [PubMed] [DOI] |
| 9. | Jayakumar AR, Panickar KS, Murthy ChR, Norenberg MD. Oxidative stress and mitogen-activated protein kinase phosphorylation mediate ammonia-induced cell swelling and glutamate uptake inhibition in cultured astrocytes. J Neurosci. 2006;26:4774-4784. [PubMed] [DOI] |
| 11. | Bai G, Rama Rao KV, Murthy CR, Panickar KS, Jayakumar AR, Norenberg MD. Ammonia induces the mitochondrial permeability transition in primary cultures of rat astrocytes. J Neurosci Res. 2001;66:981-991. [PubMed] [DOI] |
| 12. | Fiacco TA, Agulhon C, Taves SR, Petravicz J, Casper KB, Dong X, Chen J, McCarthy KD. Selective stimulation of astrocyte calcium in situ does not affect neuronal excitatory synaptic activity. Neuron. 2007;54:611-626. [PubMed] [DOI] |
| 14. | Häussinger D, Görg B. Interaction of oxidative stress, astrocyte swelling and cerebral ammonia toxicity. Curr Opin Clin Nutr Metab Care. 2010;13:87-92. [PubMed] [DOI] |
| 15. | Jayakumar AR, Rama Rao KV, Tong XY, Norenberg MD. Calcium in the mechanism of ammonia-induced astrocyte swelling. J Neurochem. 2009;109 Suppl 1:252-257. [PubMed] [DOI] |
| 16. | Sinke AP, Jayakumar AR, Panickar KS, Moriyama M, Reddy PV, Norenberg MD. NFkappaB in the mechanism of ammonia-induced astrocyte swelling in culture. J Neurochem. 2008;106:2302-2311. [PubMed] |
| 17. | Norenberg MD, Jayakumar AR, Rama Rao KV, Panickar KS. New concepts in the mechanism of ammonia-induced astrocyte swelling. Metab Brain Dis. 2007;22:219-234. [PubMed] [DOI] |
| 18. | Zou J, Wang YX, Dou FF, Lü HZ, Ma ZW, Lu PH, Xu XM. Glutamine synthetase down-regulation reduces astrocyte protection against glutamate excitotoxicity to neurons. Neurochem Int. 2010;56:577-584. [PubMed] [DOI] |