修回日期: 2010-10-30
接受日期: 2010-11-02
在线出版日期: 2010-12-18
目的: 研究改良胃旁路术(gastric bypass, GBP)对非肥胖型2型糖尿病(Goto-Kakizaki, GK)大鼠的降糖效果及其机制.
方法: ♂GK大鼠20只, 随机分为手术组和对照组, 每组10只. 对手术组大鼠行GBP, 对照组大鼠在十二指肠球部远端0.5 cm处切断吻合. 测定各组术前1 wk及术后8 wk体质量、空腹血糖(FPG)、餐后30 min血糖、血浆胰岛素(INS)、血浆胰高血糖素样肽-1(GLP-1)水平.
结果: 术后8 wk, 手术组FPG和餐后30 min血糖较术前明显降低(4.013 mmol/L±0.476 mmol/L vs 5.050 mmol/L±0.395 mmol/L; 12.488 mmol/L±1.173 mmol/L vs 22.790 mmol/L±3.525 mmol/L, 均P<0.05), 血浆INS和GLP-1较术前明显升高(873.630 ng/L±115.920 ng/L vs 674.000 ng/L±224.372 ng/L; 8 508.750 ng/L±l 247.013 ng/L vs 6 915.000 ng/L±1 566.860 ng/L, 均P<0.05).
结论: 改良GBP能降低GK大鼠血糖, 其机制可能与术后GLP-1的升高, 从而导致胰岛素分泌增多有关.
引文著录: 翁山耕, 张斌, 刘赵琪, 石铮. 改良胃旁路术对GK大鼠的降糖作用及其机制. 世界华人消化杂志 2010; 18(35): 3778-3781
Revised: October 30, 2010
Accepted: November 2, 2010
Published online: December 18, 2010
AIM: To investigate whether improved gastric bypass (GBP) surgery decreases blood glucose levels in Goto-Kakizaki (GK) rats and to explore possible mechanisms involved.
METHODS: Twenty male GK rats were randomized into two groups: one undergoing improved GBP surgery (GBP surgery group) and the other undergoing a sham operation (sham operation group). Body weight, fasting plasma glucose (FPG), oral glucose tolerance (OGTT), and plasma levels of insulin and glucagon-like peptide-1 level (GLP-1) were determined at 1 week before surgery and at 8 weeks after surgery.
RESULTS: After the surgery, fasting plasma glucose level decreased from (5.050 mmol/L ± 0.395 mmol/L) to (4.013 mmol/L ± 0.476 mmol/L), and OGTT from (22.790 mmol/L ± 3.525 mmol/L) to (12.488 mmol/L ± 1.173 mmol/L) in GK rats, while plasma insulin level increased from (674.000 ng/L ± 224.372 ng/L) to (873.630 ng/L ± 115.920 ng/L), and plasma GLP-1 level from (6 915.000 ng/L ± 1 566.860 ng/L) to (8 508.750 ng/L ± 1 247.013 ng/L).There were significant differences in the above parameters between the two groups of rats.
CONCLUSION: Improved GBP surgery can significantly improve carbohydrate tolerance in non-obese rats with type 2 diabetes possibly by increasing plasma GLP-1 level.
- Citation: Weng SG, Zhang B, Liu ZQ, Shi Z. Improved gastric bypass surgery decreases blood glucose levels in Goto-Kakizaki rats. Shijie Huaren Xiaohua Zazhi 2010; 18(35): 3778-3781
- URL: https://www.wjgnet.com/1009-3079/full/v18/i35/3778.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i35.3778
1982年, Pories等[1]在使用减肥手术治疗病态肥胖症时偶然发现, 合并有2型糖尿病的患者接受手术后, 体质量减轻的同时血糖也迅速恢复正常, 从而开创了外科手术治疗2型糖尿病的新途径. 近年来, 许多研究证实了胃旁路术(gastric bypass, GBP)可以治疗2型糖尿病, 但其机制尚不明确[2-4]. 本研究对非肥胖2型糖尿病(goto-kakizaki, GK)大鼠行改良的GBP, 观察这种术式对GK大鼠血糖、血浆胰高血糖素样肽-1(glucagon-like peptide-1, GLP-1)、血浆胰岛素(insulin, INS)水平等的影响, 并探讨其可能的机制.
8周龄♂GK大鼠20只, 上海斯莱克实验动物有限公司提供, 实验动物证号(SCXK(沪)2007-0005). 饲养于福建医科大学实验动物中心屏障系统. 大鼠INS ELISA试剂盒(美国R&D公司, 广州合达生物有限公司分装), 大鼠GLP-1 ELISA试剂盒(美国R&D公司, 广州合达生物有限公司分装).
1.2.1 分组: 动物自由进水, 喂食5%脂肪饲料, 每天20-25 g. 2 wk后, 随机分为手术组和对照组, 每组10只.
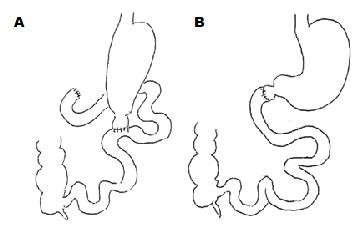
1.2.2 手术: 各组大鼠均在10 wk龄时行手术, 术前1 d禁食, 不禁饮. 10%水合氯醛按5 mL/kg体质量进行腹腔注射麻醉. 手术组大鼠在十二指肠球部远端0.5 cm处横断十二指肠, 远端封闭, 近端与距Treitz韧带20 cm的空肠行十二指肠空肠端侧吻合术. 对照组在十二指肠球部远端0.5 cm处横断后再吻合(图1).
1.2.3 体质量测量: 使用电子体质量测量仪, 测量术前1 wk及术后8 wk各组大鼠的体质量, 在清晨空腹时测量.
1.2.4 血糖的测量: 使用罗氏活力型一键式微量血糖仪. 取大鼠尾静脉血, 测量术前1 wk及术后8 wk禁食12 h后清晨空腹血糖以及给予3 g/kg 50%葡萄糖灌胃30 min后的血糖.
1.2.5 血浆INS、GLP-1的测量: 术前1 wk及术后8 wk, 禁食12 h后, 给予3 g/kg 50%葡萄糖灌胃. 灌胃后30 min, 眶静脉取血, 用50 mmol/L EDTA, 12 kTIU/L抑肽酶和100 μmol/L的胰酶胃蛋白酶抑制剂处理后3 000 r/min在4 ℃离心10 min, 分离后的血浆保存在-80 ℃冰箱中待测量. 测量使用大鼠INS RIA试剂盒和大鼠GLP-1 ELISA试剂盒.
统计学处理 用SPSS13.0软件行统计学分析, 数据以mean±SD表示.
术后8 wk, 手术组大鼠死亡1只, 对照组大鼠无死亡.
术后8 wk, 两组大鼠体质量与术前相比, 均有增多; 手术组与对照组大鼠间体质量差别无统计学意义(表1).
| 指标 | 手术组 | 对照组 | ||
| 术前1 wk | 术后8 wk | 术前1 wk | 术后8 wk | |
| 体质量(g) | 293.200±12.363 | 321.250±5.339 | 282.700±11.285 | 319.000±4.899 |
| FPG(mmol/L) | 5.050±0.395 | 4.013±0.476a | 5.380±0.700 | 5.175±0.838 |
| 餐后30 min血糖(mmol/L) | 22.790±3.525 | 12.488±1.173a | 21.290±2.285 | 19.088±3.026 |
| INS(ng/L) | 674.000±224.372 | 873.630±115.920a | 701.000±214.529 | 680.750±115.806 |
| GLP-1(ng/L) | 6 915.000±1 566.860 | 8 508.750±1 247.013a | 7 456.000±1 519.789 | 6 368.750±1 320.438 |
与术前相比, 手术组大鼠空腹血糖(fasting plasma glucose, FPG)水平显著降低, 差别具有统计学意义(P<0.05); 对照组大鼠术前术后差别无明显统计学意义(表1).
与术前相比, 手术组大鼠餐后30 min血糖水平显著降低, 差别具有统计学意义(P<0.05). 对照组大鼠术前术后差别无统计学意义(表1).
与术前相比, 手术组大鼠血浆INS水平显著上升, 差别具有统计学意义(P<0.05); 对照组大鼠术前术后差别无统计学意义(表1).
与术前相比, 手术组大鼠血浆GLP-1水平显著上升, 差别具有统计学意义(P<0.05). 对照组大鼠术前术后差别无统计学意义(表1).
近年来, GBP治疗2型糖尿病的机制成为一个新的研究热点, 因其机制不明, 大多数学者都以大鼠为模型进行机制研究. GK大鼠作为自发的非肥胖2型糖尿病模型鼠, 被广泛应用于非胰岛素依赖性2型糖尿病的研究. GBP手术在动物实验中, 操作难度相对较大, 因此我们设计一个了既旷置了近端小肠又只有一个吻合口的新术式, 即改良GBP. 改良GBP保留幽门, 并将十二指肠和近端小肠直接端侧吻合, 比GBP少了一个吻合口, 降低了实验动物手术的难度. Dallegrave Marchesini等[5]于2007年提出相类似的想法, 但并没有后续相应的临床及基础研究报道指出其想法的可行性.
本实验通过对GK大鼠的研究结果表明, 行改良GBP术后8 wk, 大鼠空腹血糖较术前明显降低(P<0.05), 而对照组大鼠术后血糖与术前相比, 差别无统计学意义, 表明改良GBP能降低GK大鼠的血糖水平.
Buchwald等[6]在回顾性研究中指出, 22 094例合并2型糖尿病的患者在接受GBP后, 84%的患者血糖降低. Pacheco等[7]对GK大鼠的研究结果表明, 大鼠在接受GBP后, 血糖恢复正常且并没有饮食的减少以及体质量减轻. GBP能够治疗2型糖尿病, 然而对于GBP治疗2型糖尿病的机制目前尚无定论, 目前众多学者比较认同的是肠道假说. 下段小肠假说最早由Mason[8]提出, 此假说认为下段回肠存在一种L细胞, 该细胞在营养素刺激下能够产生GLP-1. GLP-1是一种肠促胰岛素, 能够通过增加胰岛素分泌、抑制胰高血糖素分泌、抑制胃排空、刺激β细胞增生等作用而提高糖耐量[9]. GBP改变了消化路径, 使得未消化或消化不完全的食物提早进入下段小肠, 刺激L细胞分泌GLP-1, GLP-1的分泌增加, 从而改善了血糖.
从我们的实验结果来看, 行改良GBP术后GK大鼠的血糖明显降低, 其体质量并无明显减轻, 说明体质量减少并不是GBP治疗2型糖尿病的主要机制. 术后8 wk, 手术组大鼠的血浆GLP-1和INS均明显升高(P<0.05). 我们的实验结果与下段小肠学说的假设相吻合, 与近年来的许多研究结果相一致[10-13]. 因此, 我们认为GBP治疗2型糖尿病的机制可能是由于手术旷置了上段小肠, 使得未消化或消化不完全的食物提前进入下段小肠, 引起GLP-1分泌的增加, 使得胰岛素分泌增加, 从而导致血糖的降低.
改良GBP操作更简单, 降低了实验动物的手术难度, 并且能够降低GK大鼠血糖水平, 其机制可能与GLP-1分泌增加, 使得胰岛素分泌增加有关, 但不排除其他原因的可能, 例如肠抑胃肽、血浆抵抗素等水平变化[14,15].
2型糖尿病在世界范围内都是常见的疾病, 其发病机制尚不明确, 目前内科药物治疗尚无法治愈. 1982年Pories等的偶然发现, 开创了外科手术治疗糖尿病的新途径, 掀起了一股研究热潮.
谢敏, 主任医师, 南京大学医学院附属鼓楼医院普外科
胃旁路术可治疗2型糖尿病的机制仍不明确, 近年来, 人们认识到肠道能够分泌多种激素, 在调节胰岛素分泌和敏感性方面起重要作用, 因此, 肠道假说也成为近年来的研究热点.
Clifton等指出, 糖尿病患者在接受胃旁路术后, GLP-1水平升高, 血糖、血脂等指标都得到了良好的控制. BOSE等的研究同样表明了胃旁路术后, 患者GLP-1水平升高.
目前, 多数学者还是通过实验动物研究胃旁路术治疗2型糖尿病的机制, GK大鼠作为常用的实验动物, 对其行胃旁路术难度相对较大, 因此本课题组提出一种新的术式, 以降低在实验动物研究中的技术难度.
本文新颖性较好, 提出了一种改良的胃旁路术动物模型, 对研究胃旁路术治疗2型糖尿病具有一定的参考价值.
编辑: 李薇 电编:何基才
| 1. | Pories WJ, Swanson MS, MacDonald KG, Long SB, Morris PG, Brown BM, Barakat HA, deRamon RA, Israel G, Dolezal JM. Who would have thought it? An operation proves to be the most effective therapy for adult-onset diabetes mellitus. Ann Surg. 1995;222:339-350; discussion 350-352. [PubMed] [DOI] |
| 2. | Wickremesekera K, Miller G, Naotunne TD, Knowles G, Stubbs RS. Loss of insulin resistance after Roux-en-Y gastric bypass surgery: a time course study. Obes Surg. 2005;15:474-481. [PubMed] [DOI] |
| 3. | Rubino F, Marescaux J. Effect of duodenal-jejunal exclusion in a non-obese animal model of type 2 diabetes: a new perspective for an old disease. Ann Surg. 2004;239:1-11. [PubMed] [DOI] |
| 4. | Alexandrides TK, Skroubis G, Kalfarentzos F. Resolution of diabetes mellitus and metabolic syndrome following Roux-en-Y gastric bypass and a variant of biliopancreatic diversion in patients with morbid obesity. Obes Surg. 2007;17:176-184. [PubMed] [DOI] |
| 5. | Dallegrave Marchesini JC. End-to-side duodeno-jejunostomy with half-and-half biliopancreatic limb for the treatment of type 2 diabetes: a proposal for a simpler technique. Obes Surg. 2007;17:138-139. [PubMed] [DOI] |
| 6. | Buchwald H, Avidor Y, Braunwald E, Jensen MD, Pories W, Fahrbach K, Schoelles K. Bariatric surgery: a systematic review and meta-analysis. JAMA. 2004;292:1724-1737. [PubMed] |
| 7. | Pacheco D, de Luis DA, Romero A, González Sagrado M, Conde R, Izaola O, Aller R, Delgado A. The effects of duodenal-jejunal exclusion on hormonal regulation of glucose metabolism in Goto-Kakizaki rats. Am J Surg. 2007;194:221-224. [PubMed] [DOI] |
| 8. | Mason EE. Ileal [correction of ilial] transposition and enteroglucagon/GLP-1 in obesity (and diabetic?) surgery. Obes Surg. 1999;9:223-228. [PubMed] [DOI] |
| 9. | Drucker DJ. The role of gut hormones in glucose homeostasis. J Clin Invest. 2007;117:24-32. [PubMed] [DOI] |
| 10. | le Roux CW, Aylwin SJ, Batterham RL, Borg CM, Coyle F, Prasad V, Shurey S, Ghatei MA, Patel AG, Bloom SR. Gut hormone profiles following bariatric surgery favor an anorectic state, facilitate weight loss, and improve metabolic parameters. Ann Surg. 2006;243:108-114. [PubMed] [DOI] |
| 11. | Korner J, Bessler M, Inabnet W, Taveras C, Holst JJ. Exaggerated glucagon-like peptide-1 and blunted glucose-dependent insulinotropic peptide secretion are associated with Roux-en-Y gastric bypass but not adjustable gastric banding. Surg Obes Relat Dis. 2007;3:597-601. [PubMed] [DOI] |
| 12. | Laferrère B, Heshka S, Wang K, Khan Y, McGinty J, Teixeira J, Hart AB, Olivan B. Incretin levels and effect are markedly enhanced 1 month after Roux-en-Y gastric bypass surgery in obese patients with type 2 diabetes. Diabetes Care. 2007;30:1709-1716. [PubMed] [DOI] |
| 13. | Morínigo R, Moizé V, Musri M, Lacy AM, Navarro S, Marín JL, Delgado S, Casamitjana R, Vidal J. Glucagon-like peptide-1, peptide YY, hunger, and satiety after gastric bypass surgery in morbidly obese subjects. J Clin Endocrinol Metab. 2006;91:1735-1740. [PubMed] [DOI] |
| 14. | Flatt PR. Effective surgical treatment of obesity may be mediated by ablation of the lipogenic gut hormone gastric inhibitory polypeptide (GIP): evidence and clinical opportunity for development of new obesity-diabetes drugs? Diab Vasc Dis Res. 2007;4:151-153. [PubMed] [DOI] |
| 15. | Whitson BA, Leslie DB, Kellogg TA, Maddaus MA, Buchwald H, Billington CJ, Ikramuddin S. Adipokine response in diabetics and nondiabetics following the Roux-en-Y gastric bypass: a preliminary study. J Surg Res. 2007;142:295-300. [PubMed] [DOI] |