修回日期: 2010-11-05
接受日期: 2010-11-17
在线出版日期: 2010-12-08
目的: 评价P-gp和TopoⅡ过表达与胃癌患者临床病理参数间的相关性及其临床意义.
方法: 收集2006-01/2009-08在中国人民解放军南京军区福州总医院手术切除的胃癌组织标本1 107例, 采用EliVisionTM plus免疫组织化学染色方法检测其中临床资料完整的775例胃腺癌标本中P-gp和TopoⅡ蛋白的表达.
结果: P-gp和TopoⅡ在胃癌组织中阳性表达率分别为52.39%(406/775)、58.45%(453/775); P-gp蛋白表达与患者性别、年龄、肿瘤部位、组织类型、分化程度及远处转移无相关性(P>0.05), 而与浸润深度、TNM分期、淋巴结转移相关(P<0.05); TopoⅡ蛋白表达与患者性别、TNM分期、远处转移无相关性(P>0.05), 而与年龄、肿瘤部位、浸润深度、组织类型、分化程度及淋巴结转移相关(P<0.05).
结论: P-gp和TopoⅡ可以作为评估胃癌恶性生物学行为及预后的指标, 并为临床选择化疗药物提供参考依据.
引文著录: 刘伟, 余英豪, 欧阳学农, 王烈, 武一曼, 陈娟, 熊喜生. P-gp和TopoⅡ在中国胃癌患者中的表达及其临床意义. 世界华人消化杂志 2010; 18(34): 3640-3647
Revised: November 5, 2010
Accepted: November 17, 2010
Published online: December 8, 2010
AIM: To investigate the correlation of P-glycoprotein (P-gp) and topoisomerase II (Topo II) protein expression with the clinicopathological characteristics of gastric cancer.
METHODS: A total of 1 107 surgical specimens of gastric cancer were collected from patients treated at Fuzhou General Hospital of Nanjing Military Command from January 2006 to August 2009. The protein expression of P-gp and Topo II in 775 specimens from gastric cancer patients having complete clinical data was examined by immunohistochemistry.
RESULTS: The overexpression rates of P-gp and Topo II proteins in patients with gastric cancer were 52.39% (406/775) and 58.45% (453/775), respectively. P-gp protein overexpression was associated with depth of invasion, TNM stage, and lymph node metastasis (all P < 0.05), but not with sex, age, tumor site, histotype, differentiation, and distant metastasis (all P > 0.05). Topo II protein overexpression was associated with age, tumor site, depth of invasion, histotype, differentiation, and lymph node metastasis (all P < 0.05), but not with sex, TNM stage and distant metastasis (all P > 0.05).
CONCLUSION: Detection of P-gp and Topo II protein expression may be used to assess the malignant biological behavior and prognosis of gastric cancer and can therefore provide a theoretical basis for choice of chemotherapy drugs for gastric cancer.
- Citation: Liu W, Yu YH, Ouyang XN, Wang L, Wu YM, Chen J, Xiong XS. Clinical significance of P-glycoprotein and topoisomerase II expression in gastric cancer. Shijie Huaren Xiaohua Zazhi 2010; 18(34): 3640-3647
- URL: https://www.wjgnet.com/1009-3079/full/v18/i34/3640.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i34.3640
胃癌是最常见消化系肿瘤[1]. 目前, 胃癌的治疗仍以手术为主, 放化疗为辅, 但目前应用的化疗药物及方案的总体疗效并不理想, 其主要原因是肿瘤细胞具有内在耐药性. P-糖蛋白(P-glycoprotein, P-gp)和拓扑异构酶Ⅱ(topoisomerase II, TopoⅡ)蛋白是多药耐药基因(multidrug resistance, MDR-1)的表达产物, 在肿瘤的耐药中起到非常重要的作用[2]. 鉴于目前国内尚未见关于胃癌P-gp和TopoⅡ的大宗病例报道, 本研究采用免疫组织化学方法检测775例胃癌组织中P-gp和TopoⅡ蛋白的表达, 探讨P-gp和TopoⅡ与胃癌发生发展、浸润转移等临床病理特征及预后的关系, 并为临床选择化疗药物提供参考依据.
收集2006-01/2009-08在中国人民解放军南京军区福州总医院手术切除的胃癌组织标本1 107例, 选择资料完整的胃腺癌病例775例进行研究, 手术标本经100 g/L中性甲醛固定, 石蜡包埋, 3 μm厚连续切片, 分别进行HE和免疫组织化学染色; 所有病例术前均未行放化疗. 患者中男576例, 女199例, 年龄27-85(平均58.2)岁. 胃癌TNM分期采用AJCC标准(2002), 组织分型采用Lauren分型标准, 分为肠型、弥漫型、混合型. 另外, 在775例胃腺癌病例中随机抽取100例癌旁(距癌灶距离>5 cm)非肿瘤性胃黏膜作为对照. 试剂均购自福州迈新生物技术开发公司, 一抗P-gp和TopoⅡ均为鼠抗人单克隆抗体. 试剂盒选用EliVisionTMplus试剂盒. 石蜡切片机(LEICA RM2245); 显微镜(OLYMPUS BX51); 电热恒温干燥箱(上海-恒科技有限公司). 所有标记均设阳性对照并用PBS缓冲液代替一抗做阴性对照.
1.2.1 EliVisionTM plus免疫组织化学染色: 石蜡切片脱蜡、水化, PBS冲洗3×3 min; 高温高压抗原修复; 加30 g/L过氧化氢溶液, 室温下孵育10 min, 以阻断内源性过氧化物酶; PBS冲洗3×3 min; 加第一抗体, 室温下孵育60 min; PBS冲洗3×5 min; 加聚合物增强剂(试剂A), 室温下孵育20 min; PBS冲洗3×3 min; 加酶标抗鼠聚合物(试剂B), 室温下孵育30 min; PBS冲洗3×3 min; 加新配制的DAB显色液, 显微镜下观察3-10 min, 阳性显色为棕黄色; 自来水冲洗, 苏木素复染, 0.1%盐酸分化, 自来水冲洗, PBS冲洗返蓝; 梯度酒精脱水干燥, 中性树脂封片.
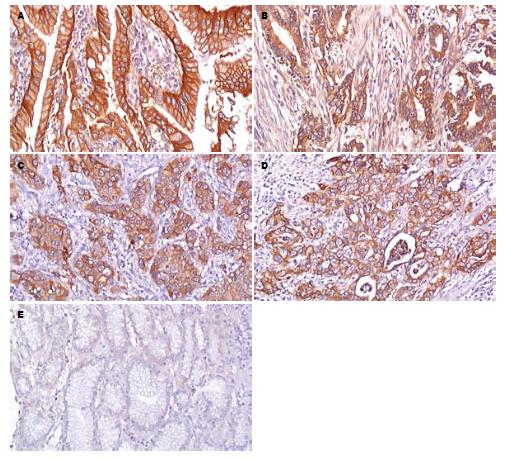
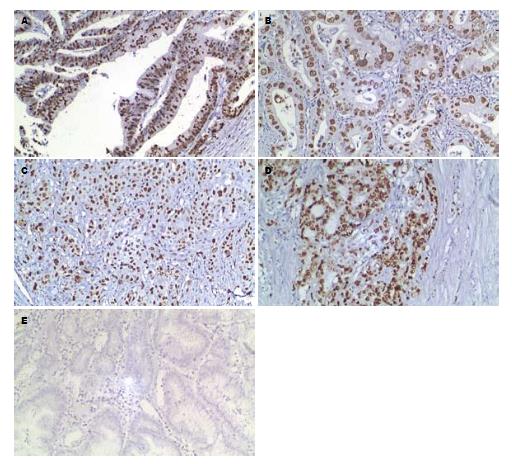
1.2.2 P-gp和TopoⅡ过表达的分析: P-gp阳性染色呈棕黄色颗粒, 位于细胞膜和细胞质; TopoⅡ阳性染色呈棕黄色颗粒, 位于细胞核. P-gp和TopoⅡ均以肿瘤细胞不着色/<10%的肿瘤细胞着色为阴性(-), ≥10%的肿瘤细胞着色为阳性[3,4], 并根据肿瘤阳性细胞数所占比例分为: 10%-25%(+), 26%-50%(++), 51%-75%(+++), >75%(++++).
统计学处理 采用SPSS16.0软件进行χ2检验分析.
P-gp阳性染色呈棕黄色颗粒, 定位于细胞膜和细胞质(图1); TopoⅡ阳性染色呈棕黄色颗粒, 定位于细胞核(图2). 其表达呈明显的异质性. 但癌旁非肿瘤性胃黏膜未见P-gp和TopoⅡ蛋白的过表达.
775例胃癌组织中P-gp阳性表达406例, 表达率为52.39%; TopoⅡ阳性表达453例, 表达率为58.45%. P-gp表达与患者性别、年龄、肿瘤部位、组织类型、分化程度及远处转移无相关性(P>0.05), 而与浸润深度、TNM分期、淋巴结转移相关(P<0.05, 表1); TopoⅡ蛋白表达与患者性别、TNM分期、远处转移无相关性(P>0.05), 而与年龄、肿瘤部位、浸润深度、组织类型、分化程度及淋巴结转移相关(P<0.05, 表2).
| 病理参数 | n | - | + | ++ | +++ | ++++ | 阳性率n(%) | P值 |
| 性别 | ||||||||
| 男 | 576 | 282 | 32 | 75 | 74 | 113 | 294(51.0) | >0.100 |
| 女 | 199 | 8 | 14 | 26 | 32 | 40 | 112(56.3) | |
| 年龄(岁) | ||||||||
| <60 | 363 | 176 | 27 | 40 | 55 | 65 | 187(51.5) | >0.500 |
| ≥60 | 412 | 193 | 23 | 50 | 59 | 87 | 219(53.2) | |
| 肿瘤部位 | ||||||||
| 胃食管连接部胃癌1 | 324 | 155 | 13 | 41 | 55 | 60 | 169(52.2) | >0.500 |
| 胃部胃癌 | 451 | 214 | 35 | 55 | 57 | 90 | 237(52.5) | |
| 浸润深度 | ||||||||
| Tis | 2 | 2 | 0 | 0 | 0 | 0 | 0(0.0) | <0.005 |
| T1 | 51 | 36 | 1 | 2 | 6 | 6 | 15(29.4) | |
| T2 | 314 | 152 | 23 | 26 | 46 | 67 | 162(51.6) | |
| T3 | 385 | 168 | 37 | 58 | 51 | 71 | 217(56.4) | |
| T4 | 23 | 10 | 0 | 3 | 4 | 6 | 13(56.5) | |
| Lauren分型 | ||||||||
| 肠型 | 285 | 147 | 24 | 20 | 26 | 68 | 138(53.5) | >0.100 |
| 弥漫型 | 313 | 146 | 20 | 51 | 46 | 50 | 167(53.4) | |
| 混合型 | 177 | 76 | 12 | 17 | 31 | 41 | 101(57.1) | |
| 分化程度 | ||||||||
| 高、中分化 | 461 | 225 | 40 | 48 | 46 | 102 | 236(51.2) | >0.100 |
| 低、未分化 | 314 | 144 | 27 | 44 | 40 | 59 | 170(54.1) | |
| TNM分期 | ||||||||
| 0+Ⅰ+Ⅱ | 351 | 176 | 16 | 33 | 39 | 82 | 170(48.4) | <0.050 |
| Ⅲ、Ⅳ | 424 | 195 | 35 | 58 | 67 | 76 | 236(55.7) | |
| 淋巴结转移 | ||||||||
| N0 | 215 | 125 | 9 | 21 | 24 | 36 | 90(41.9) | <0.005 |
| N1 | 322 | 152 | 19 | 38 | 38 | 75 | 170(52.8) | |
| N2 | 168 | 71 | 12 | 25 | 36 | 24 | 97(57.7) | |
| N3 | 70 | 21 | 10 | 8 | 18 | 13 | 49(70.0) | |
| 远处转移 | ||||||||
| 无 | 89 | 40 | 6 | 6 | 17 | 20 | 49(55.1) | >0.500 |
| 有 | 686 | 329 | 40 | 88 | 92 | 137 | 357(52.0) |
| 病理参数 | n | - | + | ++ | +++ | ++++ | 阳性率n(%) | P值 |
| 性别 | ||||||||
| 男 | 576 | 232 | 84 | 93 | 92 | 78 | 344(59.7) | >0.100 |
| 女 | 199 | 90 | 25 | 31 | 22 | 31 | 109(54.8) | |
| 年龄(岁) | ||||||||
| <60 | 363 | 171 | 40 | 61 | 50 | 41 | 192(52.9) | <0.005 |
| ≥60 | 412 | 151 | 72 | 75 | 69 | 45 | 261(63.6) | |
| 肿瘤部位 | ||||||||
| 胃食管连接部胃癌1 | 324 | 117 | 36 | 56 | 63 | 52 | 207(63.9) | <0.010 |
| 胃部胃癌 | 451 | 205 | 62 | 71 | 52 | 61 | 246(54.5) | |
| 浸润深度 | ||||||||
| Tis | 2 | 1 | 0 | 0 | 0 | 1 | 1(50.0) | <0.050 |
| T1 | 51 | 27 | 11 | 5 | 5 | 3 | 24(47.1) | |
| T2 | 314 | 112 | 42 | 48 | 48 | 64 | 202(64.3) | |
| T3 | 385 | 170 | 46 | 70 | 57 | 42 | 215(55.8) | |
| T4 | 23 | 12 | 1 | 5 | 4 | 1 | 11(47.8) | |
| Lauren分型 | ||||||||
| 肠型 | 285 | 76 | 33 | 28 | 66 | 82 | 209(73.3) | <0.005 |
| 弥漫型 | 313 | 166 | 36 | 51 | 35 | 25 | 147(47.0) | |
| 混合型 | 177 | 80 | 17 | 24 | 29 | 27 | 97(54.8) | |
| 分化程度 | ||||||||
| 高、中分化 | 461 | 149 | 52 | 54 | 90 | 116 | 312(67.7) | <0.001 |
| 低、未分化 | 314 | 173 | 30 | 45 | 40 | 26 | 141(44.9) | |
| TNM分期 | ||||||||
| 0+Ⅰ+Ⅱ | 351 | 139 | 47 | 50 | 53 | 62 | 212(60.4) | >0.100 |
| Ⅲ、Ⅳ | 424 | 183 | 52 | 78 | 61 | 50 | 241(56.8) | |
| 淋巴结转移 | ||||||||
| N0 | 215 | 106 | 10 | 22 | 37 | 40 | 109(50.7) | <0.005 |
| N1 | 322 | 127 | 35 | 65 | 52 | 43 | 195(60.6) | |
| N2 | 168 | 63 | 29 | 31 | 22 | 23 | 105(62.2) | |
| N3 | 70 | 26 | 4 | 13 | 16 | 11 | 44(62.9) | |
| 远处转移 | ||||||||
| 无 | 89 | 35 | 12 | 9 | 19 | 14 | 54(60.7) | >0.500 |
| 有 | 686 | 287 | 86 | 115 | 98 | 100 | 399(58.2) |
本课题组前期对同组胃癌病例进行了Her-2蛋白检测, 发现胃癌组织中存在Her-2蛋白的过表达[5], 将本研究中胃癌P-gp、TopoⅡ蛋白表达与前期同组胃癌病例Her-2蛋白表达进行相关性检验分析发现, P-gp的表达与Her-2蛋白表达呈负相关(P<0.005, Pearson列联系数C = 0.9476, 表3); TopoⅡ蛋白表达与Her-2蛋白表达无相关性(P>0.05, 表4); P-gp与TopoⅡ蛋白表达之间亦无相关性(P>0.05, 表5).
| P-gp | Her-2 | 合计 | |
| - | + | ||
| + | 400 | 6 | 406 |
| - | 287 | 82 | 369 |
| 合计 | 687 | 88 | 775 |
| TopoⅡ | Her-2 | 合计 | |
| - | + | ||
| + | 394 | 59 | 453 |
| - | 293 | 29 | 322 |
| 合计 | 687 | 88 | 775 |
| P-gp | TopoⅡ | 合计 | |
| - | + | ||
| + | 165 | 241 | 406 |
| - | 157 | 212 | 369 |
| 合计 | 322 | 453 | 775 |
P-gp是一种相对分子质量为170 000 Da的跨膜糖蛋白, 又称P-170, 为MDR-1基因所编码. 在耐药肿瘤细胞中MDR-1基因扩增导致P-gp过量表达, 由ATP提供能量, P-gp与进入细胞内的抗肿瘤药物结合后, 将化疗药物快速泵出细胞外而使抗肿瘤药物的细胞毒作用降低出现耐药[6]. 此外P-gp还可抑制FAS诱导的caspase-3和caspase-8激活而诱导细胞凋亡, 导致细胞耐药性[7]. P-gp的作用底物主要包括蒽环类(阿霉素等)、长春碱类、依托泊苷及某些抗癌抗生素等亲脂类药物. Takechi等[8]研究发现在5-FU耐药的胃癌细胞株中存在P-gp过表达. Xu等[9]报道, 在胃癌组织中P-gp和MDR蛋白的阳性表达率分别为41.7%、29.2%, 共表达率为23%; 在对喜树碱类似物(homocamptothecin)和氨甲喋呤耐药的胃癌细胞组中, P-gp和MDR蛋白的阳性表达率明显高于非耐药组.
Hu等[10]研究发现, 胃癌中P-gp, 肺耐药蛋白(lung resistance protein, LRP), 多药耐药相关蛋白(multidrug resistance - associated protein, MRP)的阳性表达率分别为86.4%、84.7%和27.1%, 并且P-gp的表达与临床分期和预后密切相关. 关云艳等[3]研究认为, P-gp在胃癌中的表达与病变大小、淋巴结转移、血管侵犯等密切相关, 而与性别、组织类型、分化程度、TNM分期等无相关性. 本研究显示, P-gp表达与患者性别、年龄、肿瘤部位、组织类型、分化程度及远处转移无相关性(P>0.05); 而与浸润深度、TNM分期、淋巴结转移相关(P<0.05); 并且随着浸润深度的增加、TNM分期的增高、淋巴结转移的增多, P-gp阳性表达率逐渐升高, 提示P-gp阳性表达的患者预后较差. 以上临床资料初步显示, P-gp在胃癌中存在过表达, 且与预后有关的临床病理参数相关, 可以作为临床评价胃癌患者预后的一个参考指标.
由于P-gp在胃癌中的过表达, 使肿瘤细胞对阿霉素等化疗药物敏感性下降, 导致P-gp阳性表达患者的化疗效果不理想, 预后较差; 近年来, 关于逆转P-gp介导的多药耐药作用的药物研究引起了人们的关注. 最主要的化学药物逆转剂为类钙离子拮抗剂, 如异搏定、维拉帕米、奎尼丁、PSC833 、GF120918、S9788、XR9576等, 其作用机制是与抗癌药竞争结合P-gp上的药物结合点, 改变药物分布, 使细胞内抗癌药物外排减少, 细胞内抗癌药物浓度增高, 从而达到杀伤肿瘤细胞的作用. 但此类逆转剂有效剂量与中毒剂量非常接近, 对心血管和肝脏的损害较为严重, 因此阻碍了其在临床的广泛应用[11-13]. 除了药物逆转剂的研究外, 通过分子生物学的方法调节MDR-1基因的表达, 逆转P-gp介导的多药耐药也是目前研究的热点, 主要包括反义寡核苷酸、核酶、siRNA等, 在逆转P-gp介导的多药耐药中也取得了一定的效果. 李玲等[14]研究发现, MDR-1反义寡脱氧核苷酸片段可部分逆转人胃癌耐药细胞SGC7901/ADM的耐药性. Stierlé等[15]研究表明, 将特定的siRNA转染到MCF7-R细胞可实现有效的MDR-1基因沉默, 从而达到逆转多药耐药的目的.
TopoⅡ是一种能调节核酸空间结构动态变化, 控制核酸生理功能的关键酶, 参与基因重组、转录和DNA修复等, 是多种化疗药物如喜树碱、柔红霉素、阿霉素、VP-16、蒽环类、鬼臼毒素等的重要靶点[16], 这些药物通过与该酶及肿瘤细胞DNA交链形成药物-TopoⅡ-DNA共价复合物, 引起肿瘤DNA 断裂, 导致肿瘤细胞死亡. 若该酶含量减少或活性降低, 可导致药物-TopoⅡ-DNA共价复合物形成减少, 则产生耐药, 因而与多种肿瘤的多药耐药关系密切[17-21]. 耐药机制与P-gp耐药有明显的区别, 为不典型多药耐药. TopoⅡ表达降低使肿瘤细胞对多种抗癌药产生耐药, TopoⅡ含量的高低, 可以作为判定各种肿瘤对抗癌药物的敏感性或抗药性的参考指标[22].
Liu等[23]研究发现, 在以5-FU为基础化疗的胃癌患者中, 具有TopoⅡα、Her-2基因扩增和TopoⅡα蛋白表达的患者明显较TopoⅡα、Her-2基因无扩增和TopoⅡα蛋白无表达的患者生存期长. 本研究中TopoⅡ蛋白表达与患者性别、TNM分期、远处转移无相关性(均P>0.05), 而与年龄、肿瘤部位、浸润深度、组织类型、分化程度及淋巴结转移相关(P<0.05). 并且年龄越大、分化程度越高, TopoⅡ的阳性表达率越高. 初步表明TopoⅡ的表达与胃癌的生物学行为密切相关, 可以作为评价患者预后的参考指标.
将本研究中胃癌P-gp、TopoⅡ蛋白表达与前期同组胃癌病例Her-2蛋白表达, 进行相关性检验分析发现, P-gp的表达与Her-2蛋白表达呈负相关(P<0.005, Pearson列联系数C = 0.9476), 关于P-gp表达与Her-2蛋白表达相关性的研究尚未见相关文献报道, 其具体机制也待于进一步阐明; 本结果显示TopoⅡ蛋白表达与Her-2蛋白表达无相关性(P>0.05), 但Liu等报道TopoⅡα与Her-2蛋白在胃癌中的表达有一定的相关性, 但关系不甚密切[23,24]. Mano等报道在卵巢癌中, Her-2蛋白过表达的患者对蒽环类化疗药物不敏感, 预后较差, 但当Her-2与TopoⅡ协同表达时, 对其敏感性反而增加, 预后较Her-2蛋白单表达为好[25,26]. Tanner等[27]报道在具有TopoⅡα与Her-2基因扩增的胃癌患者, 应用曲妥珠单抗(herceptin, 赫赛汀)治疗效果较单独有Her-2基因扩增的患者预后差. P-gp与TopoⅡ在本组病例中的表达亦无相关性, 可能与两者的耐药机制不同有关.
总之, 联合检测胃癌组织中P-gp、TopoⅡ、Her-2蛋白表达具有重要的临床意义, 一方面有助于揭示胃癌发生发展、浸润转移、复发的机制, 并能作为评价患者预后的参考指标; 另一方面可以揭示胃癌多药耐药的机制, 并有效预测肿瘤对多种化疗药物的反应程度, 有针对性地选择敏感药物和针对Her-2的靶向药物(如赫赛汀), 制定个性化的联合化疗方案, 从而提高疗效, 以期延长胃癌患者生存期和生活质量具有积极的意义.
目前胃癌的治疗仍以手术为主, 放化疗为辅, 但总体疗效并不理想, 其主要原因是肿瘤细胞具有内在耐药性. 检测胃癌组织中的耐药基因, 筛选敏感的化疗药物以提高疗效, 是临床的迫切需要.
刘云鹏, 教授, 中国医科大学附属第一医院肿瘤内科
Hu等研究发现, 胃癌中P-gp, 肺耐药蛋白(LRP), 多药耐药相关蛋白(MRP)的阳性表达率分别为86.4%、84.7%和27.1%, 并且P-gp的表达与临床分期和预后密切相关.
本文采用大宗病例研究, 综合分析P-gp和TopoⅡ在胃癌中的表达情况及胃癌生物学行为和预后的关系, 并以期为筛选胃癌化疗药物及判断预后提供参考依据.
本研究采用免疫组织化学的方法检测P-gp和TopoⅡ蛋白在胃癌组织中的表达情况, 探讨P-gp和TopoⅡ与胃癌发生发展、浸润转移等临床病理特征及预后的关系, 并为临床选择化疗药物提供参考依据.
本文选题恰当, 具有较好的临床参考价值.
编辑: 李薇 电编:何基才
| 1. | Jemal A, Siegel R, Ward E, Hao Y, Xu J, Thun MJ. Cancer statistics, 2009. CA Cancer J Clin. 2009;59:225-249. [PubMed] [DOI] |
| 2. | Labialle S, Gayet L, Marthinet E, Rigal D, Baggetto LG. Transcriptional regulators of the human multidrug resistance 1 gene: recent views. Biochem Pharmacol. 2002;64:943-948. [PubMed] [DOI] |
| 5. | 陈 娟, 李 东石, 余 英豪, 王 烈, 欧阳 学农, 谢 飞来, 熊 喜生. Her-2蛋白在胃癌中的表达及其临床意义. 世界华人消化杂志. 2010;18:1375-1379. [DOI] |
| 6. | Arancia G, Molinari A, Calcabrini A, Meschini S, Cianfriglia M. Intracellular P-glycoprotein in multidrug resistant tumor cells. Ital J Anat Embryol. 2001;106:59-68. [PubMed] |
| 7. | Ruefli AA, Tainton KM, Darcy PK, Smyth MJ, Johnstone RW. P-glycoprotein inhibits caspase-8 activation but not formation of the death inducing signal complex (disc) following Fas ligation. Cell Death Differ. 2002;9:1266-1272. [PubMed] [DOI] |
| 8. | Takechi T, Koizumi K, Tsujimoto H, Fukushima M. Screening of differentially expressed genes in 5-fluorouracil-resistant human gastrointestinal tumor cells. Jpn J Cancer Res. 2001;92:696-703. [PubMed] |
| 9. | Xu HW, Xu L, Hao JH, Qin CY, Liu H. Expression of P-glycoprotein and multidrug resistance-associated protein is associated with multidrug resistance in gastric cancer. J Int Med Res. 2010;38:34-42. [PubMed] |
| 10. | Hu WQ, Peng CW, Li Y. The expression and significance of P-glycoprotein, lung resistance protein and multidrug resistance-associated protein in gastric cancer. J Exp Clin Cancer Res. 2009;28:144. [PubMed] [DOI] |
| 11. | Jeong H, Chiou WL. Role of P-glycoprotein in the hepatic metabolism of tacrolimus. Xenobiotica. 2006;36:1-13. [PubMed] |
| 12. | Fox E, Bates SE. Tariquidar (XR9576): a P-glycoprotein drug efflux pump inhibitor. Expert Rev Anticancer Ther. 2007;7:447-459. [PubMed] [DOI] |
| 13. | Zhang Y, Shi Y, Li X, Du R, Luo G, Xia L, Du W, Chen B, Zhai H, Wu K. Proteasome inhibitor MG132 reverses multidrug resistance of gastric cancer through enhancing apoptosis and inhibiting P-gp. Cancer Biol Ther. 2008;7:540-546. [PubMed] [DOI] |
| 15. | Stierlé V, Laigle A, Jollès B. Modulation of the efficiency of a siRNA directed against MDR1 expression in MCF7-R cells when combined with a second siRNA. Biochimie. 2007;89:1033-1036. [PubMed] [DOI] |
| 16. | Topcu Z. DNA topoisomerases as targets for anticancer drugs. J Clin Pharm Ther. 2001;26:405-416. [PubMed] [DOI] |
| 17. | Gupta D, Shidham V, Holden J, Layfield L. Prognostic value of immunohistochemical expression of topoisomerase alpha II, MIB-1, p53, E-cadherin, retinoblastoma gene protein product, and HER-2/neu in adrenal and extra-adrenal pheochromocytomas. Appl Immunohistochem Mol Morphol. 2000;8:267-274. [PubMed] [DOI] |
| 18. | Costa MJ, Hansen CL, Holden JA, Guinee D Jr. Topoisomerase II alpha: prognostic predictor and cell cycle marker in surface epithelial neoplasms of the ovary and peritoneum. Int J Gynecol Pathol. 2000;19:248-257. [PubMed] [DOI] |
| 19. | Park SH, Suh YL. Expression of cyclin A and topoisomerase IIalpha of oligodendrogliomas is correlated with tumour grade, MIB-1 labelling index and survival. Histopathology. 2003;42:395-402. [PubMed] [DOI] |
| 20. | Shabbits JA, Krishna R, Mayer LD. Molecular and pharmacological strategies to overcome multidrug resistance. Expert Rev Anticancer Ther. 2001;1:585-594. [PubMed] [DOI] |
| 21. | Ma J, Maliepaard M, Nooter K, Loos WJ, Kolker HJ, Verweij J, Stoter G, Schellens JH. Reduced cellular accumulation of topotecan: a novel mechanism of resistance in a human ovarian cancer cell line. Br J Cancer. 1998;77:1645-1652. [PubMed] |
| 22. | Chikamori K, Grozav AG, Kozuki T, Grabowski D, Ganapathi R, Ganapathi MK. DNA Topoisomerase II Enzymes as Molecular Targets for Cancer Chemotherapy. Curr Cancer Drug Targets. 2010; Jun 25. [Epub ahead of print]. [PubMed] |
| 23. | Liu JM, Chen LT, Li AF, Wu CW, Lan C, Chung TR, Shiah HS, Lee KD, Liu TW, Peng JW. Prognostic implications of the expression of erbB2, topoisomerase II alpha and thymidylate synthase in metastatic gastric cancer after fluorouracil-based therapy. Jpn J Clin Oncol. 2004;34:727-732. [PubMed] [DOI] |
| 25. | Mano MS, Awada A, Di Leo A, Durbecq V, Paesmans M, Cardoso F, Larsimont D, Piccart M. Rates of topoisomerase II-alpha and HER-2 gene amplification and expression in epithelial ovarian carcinoma. Gynecol Oncol. 2004;92:887-895. [PubMed] [DOI] |
| 26. | Tanner B, Pilch H, Schäffer U, Franzen A, Seufert R, Hengstler JG. [Expression of c-erbB-2 and topoisomerase II alpha in relation to chemoresistance in ovarian cancer]. Zentralbl Gynakol. 2002;124:176-183. [PubMed] [DOI] |
| 27. | Tanner M, Hollmén M, Junttila TT, Kapanen AI, Tommola S, Soini Y, Helin H, Salo J, Joensuu H, Sihvo E. Amplification of HER-2 in gastric carcinoma: association with Topoisomerase IIalpha gene amplification, intestinal type, poor prognosis and sensitivity to trastuzumab. Ann Oncol. 2005;16:273-278. [PubMed] [DOI] |