修回日期: 2010-10-17
接受日期: 2010-10-18
在线出版日期: 2010-11-28
目的: 探讨功能性消化不良(FD)及其伴随精神症状与五羟色胺转运体(SERT)基因多态性的关系.
方法: 采用多聚酶链式反应技术(PCR)检测60例FD患者与80例健康对照者SERT基因的启动子区(5-HTTLPR)和内含子2可变数目串联重复序列(VNTRs)的多态性.
结果: 5-HTTLPR区S等位基因频率在FD临床分型各组间以及有无精神症状各组间比较差异具有统计学意义(P<0.05). VNTRs区的多态性比较无统计学意义.
结论: 5-HTTLPR的S等位基因可能与FD-PDS亚型的发病以及FD患者伴随精神症状的发生有关.
引文著录: 韩仙芝, 高峰, 赵立群. 功能性消化不良及其伴随精神症状与五羟色胺转运体基因多态性的关系. 世界华人消化杂志 2010; 18(33): 3599-3603
Revised: October 17, 2010
Accepted: October 18, 2010
Published online: November 28, 2010
AIM: To investigate the association of serotonin transporter (SERT) gene polymorphisms with the development of functional dyspepsia (FD) and accompanying psychiatric symptoms.
METHODS: Polymerase chain reaction (PCR) was used to detect the SERT gene-linked polymorphic region (5-HTTLPR) and the variable number tandem repeats (VNTRs) in intron 2 of the SERT gene in 60 patients with FD and 80 healthy subjects.
RESULTS: There are significant differences in 5-HTTLPR S allele frequencies among groups classified according to FD subtype and those according to psychiatric symptoms (all P < 0.05). No significant differences were noted in genotype distribution or allele frequency of VNTRs between controls and FD patient.
CONCLUSION: The S allele of 5-HTTLPR may be associated with the development of FD-PDS subtype and FD-associated psychiatric symptoms.
- Citation: Han XZ, Gao F, Zhao LQ. Association of serotonin transporter gene polymorphisms with the development of functional dyspepsia and accompanying psychiatric symptoms. Shijie Huaren Xiaohua Zazhi 2010; 18(33): 3599-3603
- URL: https://www.wjgnet.com/1009-3079/full/v18/i33/3599.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i33.3599
功能性消化不良(functional dyspepsia, FD)是一种上消化道功能紊乱性疾病, 按照罗马Ⅲ功能性消化不良诊断标准可分为两种亚型: 一种是餐后不适综合征(postprandial distress syndrome, PDS), 表现为早饱、餐后饱胀感等与进餐有关的症状; 一种是上腹疼痛综合征(epigastric pain syndrome, EPS), 以上腹疼痛和上腹烧灼感为主要症状[1]. 其病因及发病机制尚不清楚, 可能与胃肠动力、内脏敏感性、感染性因素以及精神心理障碍等因素相关. 近年研究表明功能性胃肠道疾病(functional gastrointestinal disorders, FGIDs)与基因决定的遗传易感性相关[2,3], 目前, 有关遗传学因素在FD不同临床分型及其伴随精神症状中意义的报道极少. 本文按照罗马Ⅲ功能性消化不良诊断标准将FD患者进行临床分型, 研究FD及其伴随精神症状与五羟色胺(serotonin)转运体(serotonin transporter, SERT)基因启动子区(5-HT gene-linked polymorphic region, 5-HTTLPER)及内含子区(VNTRs)两种基因多态性的关系, 以探寻其在FD及其伴随精神症状发病中的意义.
患者组为郑州大学第一附属医院2009-11/2010-04门诊及住院患者60例, 男26例, 女34例, 年龄16-78(平均48.76±14.84)岁, 均符合罗马Ⅲ功能性消化不良诊断标准, 并采用成人功能性胃肠病罗马Ⅲ诊断性问卷[4]-FD部分进行初步测评及临床亚型分类, 包括PDS、EPS以及以上两种类型的混合型(PDS+EPS), 所有患者均行胃镜检查排除器质性病变(慢性浅表性胃炎除外)、同时排除如糖尿病等慢性疾病及其他系统严重疾病. 患者均采用抑郁自评量表(self-rating depression scale, SDS)和焦虑自评量表(self-rating anxiety scales , SAS)进行自我精神状况评定, 评定标准为: SDS标准总分>53分为伴随有抑郁症状, SAS标准总分>50分为伴随有焦虑症状, 在本研究中伴随有精神症状是指SDS标准总分>53分和(或)SAS标准总分>50分[5]. 对照组根据与患者年龄、性别相当的条件选取, 共80例, 年龄20-75(平均45.56±12.57)岁, 来自本校学生、本院职工、志愿鲜血者, 均无FD症状, 均排除精神疾病及其他器质性疾病.
1.2.1 标本采集及DNA提取: 取受试者外周静脉血2 mL, 0.2% EDTA-Na2抗凝. 采用TaKaRa宝生物工程(大连)有限公司NDA提取试剂盒(Universal Genomic DNA Extraction Kit Ver.3.0)提取基因组DNA.
1.2.2 多聚酶链式反应技术(PCR)扩增获取目的基因: 经查阅文献并与GenBank对照确认, 预实验后选定以下引物, 由生工生物工程(上海)有限公司合成. 5-HTTLPR: 上游5'-GCCGCTCTGAATGCCAGCAC-3', T: 63.95 ℃; 下游5'-GGAGGAACTGACCCCTGAAAACTG-3', T: 63.68 ℃. VNTRs: 上游5'-GTGATTGGCTATGCTGTGGACC-3', T: 61.94 ℃; 下游5'-CCTGGCGGAGATTTGACTTT-3', T: 57.80 ℃. 5-HTTLPR PCR反应体系[TaKaRa宝生物工程(大连)有限公司PrimerSTARTM HS DNA Polymerase]为: 总体积50 µL, 含5×PrimerSTARTM Buffer(Mg2+ plus)10 µL, dNTPs(各2.5 µmol/L)4 µL, 引物(10 µmol/L)各1 µL, 人基因组DNA 100 ng , PrimerSTARTM HS DNA Polymerase(2.5×103 kU/L)0.5 µL; 反应条件: 98 ℃ 10 s, 68 ℃ 45 s, 30个循环. VNTRs反应体系[TaKaRa宝生物工程(大连)有限公司TaKaRa TaqTM]为: 总体积50 µL, 含10×PCR Buffer(Mg2+ Free)5 µL, MgCl2(25 mmol/L)3 µL, dNTPs(各2.5 µmol/L) 4µL, 引物(20 µmol/L)各1 µL, 人基因组DNA 200ng, TaKaRa Taq(5×103 kU/L)0.25 µL; 反应条件: 94 ℃预变性4 min, 94 ℃ 30 s, 57 ℃ 30 s, 72 ℃ 45 s, 共30个循环, 72 ℃ 10 min.
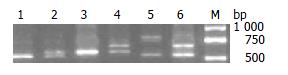
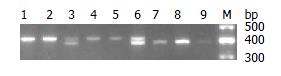
1.2.3 基因型判断及检测: PCR扩增产物经2%琼脂糖凝胶, 65 V电压电泳1 h, 溴化乙锭染色后, 行凝胶成像仪观察照相. 目的基因片段长度: 5-HTTLPR: S 528 bp、L 572 bp, 3种基因型即: S/S、L/S、L/L. VNTRs: Stin2.10 388 bp、Stin2.12 422 bp, 3种基因型即: 10/10、12/10、12/12(注: 未发现Stin2.9 377 bp的罕见片段). PCR产物由TaKaRa宝生物工程(大连)有限公司进行基因测序鉴定.
统计学处理 基因型和等位基因片段频率以%表示, 差异显著性比较用χ2检验(检验水准α = 0.05). 采用SPSS16.0 for Windows软件包处理.
5-HTTLPR多态性位点基因型电泳结果见图1. 本实验中发现较少见的加长型等位基因类型及相应的基因型(如xL/S、xxL/S归入L/S组, xL/L归入L/L组). VNTRs多态性位点基因型电泳结果见图2. 5-HTTLPR区S等位基因频率在FD临床分型各组间以及有无精神症状各组间比较差异具有统计学意义(P<0.05, 表1). VNTRs区的多态性比较无统计学意义(表2).
| 分组 | 基因型 | χ2值 | P值 | 等位基因 | χ2值 | P值 | |||
| S/S | L/S | L/L | S | L | |||||
| FD组 | 37(61.7) | 15(25.0) | 8(13.3) | 2.944 | 0.229 | 89(74.2) | 31(25.8) | 0.771 | 0.380 |
| 对照组 | 40(50.0) | 31(38.8) | 9(11.2) | 111(69.4) | 49(30.6) | ||||
| FD男性 | 15(57.7) | 6(23.1) | 5(19.2) | 1.382 | 0.501 | 36(69.2) | 16(30.8) | 1.167 | 0.280 |
| FD女性 | 22(64.7) | 9(26.5) | 3(8.8) | 53(77.9) | 15(22.1) | ||||
| PDS组 | 21(70.0) | 7(23.3) | 2(6.7) | 5.873 | 0.209 | 49(81.7) | 11(18.3)b | 6.785 | 0.034 |
| EPS组 | 5(41.7) | 3(25.0) | 4(33.3) | 13(54.2) | 11(45.8) | ||||
| PDS+EPS组 | 11(61.1) | 5(27.8) | 2(11.1) | 27(75.0) | 9(25.0) | ||||
| 伴精神症状 | 15(78.9) | 3(15.8) | 1(5.3) | 3.648 | 0.161 | 33(86.8) | 5(13.2) | 4.663 | 0.043 |
| 无精神症状 | 22(53.7) | 12(29.3) | 7(17.0) | 56(68.3) | 26(31.7) | ||||
| 分组 | 基因型 | χ2值 | P值 | 等位基因 | χ2值 | P值 | |||
| 12/12 | 12/10 | 10/10 | 12 | 10 | |||||
| FD组 | 35(58.3) | 22(36.7) | 3(5.0) | 1.076 | 0.584 | 92(76.7) | 28(23.3) | 0.041 | 0.840 |
| 对照组 | 43(53.8) | 35(43.8) | 2(2.5) | 121(75.6) | 39(24.4) | ||||
| FD男性 | 15(57.7) | 10(38.5) | 1(3.8) | 0.166 | 0.92 | 40(76.9) | 12(23.1) | 0.003 | 0.954 |
| FD女性 | 20(58.8) | 12(35.3) | 2(5.9) | 52(76.5) | 16(23.5) | ||||
| PDS组 | 19(63.3) | 9(30.0) | 2(6.7) | 5.873 | 0.209 | 47(78.3) | 13(21.7) | 0.575 | 0.750 |
| EPS组 | 5(41.7) | 7(58.3) | 0(0.0) | 17(70.8) | 7(29.2) | ||||
| PDS+EPS组 | 11(61.1) | 6(33.3) | 1(5.6) | 28(77.8) | 8(22.2) | ||||
| 伴精神症状 | 13(68.4) | 5(26.3) | 1(5.3) | 1.301 | 0.522 | 31(81.6) | 7(18.4) | 0.750 | 0.386 |
| 无精神症状 | 22(53.7) | 17(41.5) | 2(4.9) | 61(74.4) | 21(25.6) | ||||
FGIDs是以消化系统症状为临床表现, 而应用生化、影像学和内镜等检查并未发现有器质性病变或不能用器质性疾病解释症状的一组胃肠道疾病. FD是FGIDs中较为常见的疾病之一, 其患者占消化门诊的20%-40%[6], 由于高发病率及对患者生活质量的影响, 越来越引起消化科医生的重视. 近年较多临床观察发现FGIDs患者常常伴有不同类型、不同程度的精神情绪状态的异常[7,8]. 在生物-心理-社会医学模式的医疗环境中, FGIDs及其伴随精神症状的发病原因及机制值得探讨.
5-HT是调节胃肠道运动和分泌功能的重要神经递质之一, 并在脑-肠轴的信号传导中发挥着重要作用, 同时5-HT又是重要的中枢神经递质, 与精神、情绪活动关系密切[9]. 而五羟色胺转运体SERT在5-HT的转运及代谢过程中发挥着重要作用, 其主要生理作用在于将效应部位的5-HT再摄取, 避免5-HT聚集而致5-HT受体脱敏[10]. SERT基因具有两个多态性位点是目前研究的热点, 其一是启动子区的44 bp核苷酸序列的插入/缺失即5-HTTLPR, 该插入/缺失形成长型(L)和短型(S)两种等位基因片段, 构成L/L、L/S、S/S 3种等位基因类型, 偶尔有超长片段(xL和xxL), 该多态性调节了SERT的转录, S型较L型转录效率低, 使SERT表达减少, 5-HT结合及重摄取减少, 导致5-HT能活动延长[11], 从而出现5-HT信号系统异常, 导致胃肠道动力及分泌功能的异常以及内脏高敏感性, 而这又与慢性便秘、肠易激综合征(irritable bowel syndrome, IBS)、腹泻及PD等功能性胃肠病关系密切[10,12-14]. 另一多态性位点为SERT基因内含子2的17 bp的可变数目重复片段即VNTRs(variable number tandem repeats), 在人类中具有3种等位基因即STin2.9, STin2.10, STin2.12, 其不同的基因类型, 同样会影响5-HT的表达[15].
已有学者对这两个多态性位点在FGIDs及精神障碍性疾病中的作用分别进行了研究, 但结果不一. 关于FGIDs的研究大多集中于IBS, 在遗传学研究方面, 国内外部分研究认为SERT基因是IBS发病的重要候选基因, Saito等[16]研究认为5-HTTLPR区S等位基因仅与混合型IBS发病有关, Li等[17]的研究结果则显示在5-HTTLPR区便秘型IBS具有较高频率的L/L基因型. 与IBS一样同属于FGIDs范畴, 研究者在FD遗传学发病方面进行了研究. van Lelyveld等[18]研究结果显示FD的发病与基因GNB3C825T具有相关性, 而与基因HTR3A(5-HT3受体A亚型)以及5-HTTLPR的基因多态性没有关系. 本研究结果则显示FD患者5-HTTLPR区基因多态性分布与正常对照组无差异, 但按罗马Ⅲ FD诊断标准对FD患者进行分组后, 虽各组间基因型频率分布差异无统计学意义, 但PDS组S等位基因频率显著高于EPS组, 差异具有统计学意义, 与PDS+EPS组比较差异无统计学意义. 推测S等位基因可能参与FD-PDS亚型的发病.
5-HT作为重要的中枢神经递质, 在5-HT能神经递质传递的微调中起关键作用, 与精神、情绪活动关系密切, 因此近年SERT基因多态性与精神障碍性疾病关系的研究亦是一热点, 研究认为SERT基因是参与情感障碍的重要候选基因之一, 而众多临床观察发现FGIDs患者常常伴有精神情绪状态的异常. Jarrett等[19]研究了139例IBS患者中抑郁、焦虑两种精神症状的发病与两个SERT基因多态区的关系, 结果发现存在S/S基因型或携带有VNTRs STin2.12等位基因的患者较其他更易有抑郁, 焦虑病史. 另外, Thierry等[20]研究认为5-HTTLPR中的S遗传突变因子与VNTRs中的STin2.12等位基因是情感障碍的易感遗传因子. 本研究中在FD患者伴随精神症状与否的分组中, 两组间5-HTTLPR基因型频率分布无差异, 但伴精神症状组S等位基因表达显著高于无精神症状组, 差异具有统计学意义, 与其他学者部分研究结果一致, 但在VNTRs多态性与FD及其临床分型以及伴随情感障碍与否的研究结果中未发现其相关性. 可能具有S等位基因的FD-PDS亚型患者增加了抑郁、焦虑等情感障碍的发病机率, SERT基因型可能改变了FD患者抑郁、焦虑等精神症状的发病风险.
临床上, FD患者女性多于男性, 对此尚未找到明确的原因, 本研究显示, SERT基因启动子区的多态性可能参与了FD的发病机制, 但在不同性别的分组比较中, 5-HTTLPR和VNTRs的多态性分布均无明显差异.
正是由于5-HT在胃肠道和中枢神经系统发挥着重要作用, 关于FGIDs及其伴随精神症状的病因学研究逐渐受到众多学者的关注. Van Oudenhove等[21]研究发现焦虑状态在FD患者、特别是高敏感的患者中扮演着重要角色, 焦虑状态可加重患者的不适感、降低胃肠道容受性. 在其另1篇是否对FD患者进行抗抑郁治疗的研究中, 称虽不推荐对FD患者进行常规的抗抑郁治疗, 但同时指出对伴有抑郁和(或)焦虑状态的患者进行抗抑郁治疗是有益的[22].
众多研究表明5-HT是联系FGIDs与中枢神经系统疾病的重要纽带, 他们或许有着共同的遗传学机制, 可能由于SERT基因各等位基因频率的改变, SERT表达异常, 导致5-HT信号系统异常, 出现FD患者胃肠道动力、分泌功能以及内脏敏感性的改变, 同时改变了FD患者精神障碍性疾病的发作风险, 但还需要更多的临床观察和基础研究, 从而更好的指导FD患者的临床药物治疗, 提高临床疗效.
功能性消化不良是一种上消化道功能紊乱性疾病, 按照罗马Ⅲ功能性消化不良诊断标准可分为两种亚型: 一种是餐后不适综合征, 表现为早饱、餐后饱胀感等与进餐有关的症状; 一种是上腹疼痛综合征, 以上腹疼痛和上腹烧灼感为主要症状, 目前其病因及发病机制尚不清楚.
许文燮, 教授, 上海交通大学生命科学院生物医学工程系
本文按照罗马Ⅲ功能性消化不良(FD)诊断标准将FD患者进行临床分型, 研究FD及其伴随精神症状与五羟色胺转运体基因启动子区及内含子区两种基因多态性的关系, 以探寻其在功能性消化不良及其伴随精神症状发病中的意义.
本研究发现可能具有S等位基因的FD-PDS亚型患者增加了抑郁、焦虑等情感障碍的发病机率, SERT基因型可能改变了FD患者抑郁、焦虑等精神症状的发病风险, 结合更多的临床观察和基础研究, 能够更好地指导FD患者的临床药物治疗, 提高其临床疗效.
功能性胃肠病(FGIDs): 是以消化系统症状为临床表现, 而应用生化、影像学和内镜等检查, 并未发现有器质性病变或不能用器质性疾病解释症状的一组胃肠道疾病.
本文结果可靠, 在临床防治功能性消化不良方面具有一定的指导意义.
编辑: 李军亮 电编:李薇
| 1. | Tack J, Talley NJ, Camilleri M, Holtmann G, Hu P, Malagelada JR, Stanghellini V. Functional gastroduodenal disorders. Gastroenterology. 2006;130:1466-1479. [PubMed] [DOI] |
| 2. | Saito YA, Mitra N, Mayer EA. Genetic approaches to functional gastrointestinal disorders. Gastroenterology. 2010;138:1276-1285. [PubMed] [DOI] |
| 4. | Douglas A. Drossman, MD, 柯美云, 方秀才. 罗马Ⅲ功能性胃肠病. 北京: 科学出版社 2008; 802-830. |
| 5. | 张 明园. 精神科手册. 上海: 上海科学技术出版社 1999; 416-421. |
| 6. | 刘 谦民, 令狐 恩强, 刘 运祥, 黄 留业. 功能性胃肠病学. 北京: 人民军医出版社 2003; 214. |
| 8. | 陈 仕武, 陈 刚, 张 晓, 殷 先锋, 黄 振銮, 邵 昌发, 崔 桂林. 功能性消化不良抑郁、焦虑的发生情况及其对患者生活质量和疗效的影响. 临床军医杂志. 2009;37:378-381. |
| 9. | Hansen MB. The enteric nervous system II: gastrointestinal functions. Pharmacol Toxicol. 2003;92:249-257. [PubMed] [DOI] |
| 10. | Baig MK, Zhao RH, Woodhouse SL, Abramson S, Weiss JJ, Nogueras JJ, Wexner SD. Variability in serotonin and enterochromaffin cells in patients with colonic inertia and idiopathic diarrhoea as compared to normal controls. Colorectal Dis. 2002;4:348-354. [PubMed] [DOI] |
| 11. | Lesch KP, Bengel D, Heils A, Sabol SZ, Greenberg BD, Petri S, Benjamin J, Müller CR, Hamer DH, Murphy DL. Association of anxiety-related traits with a polymorphism in the serotonin transporter gene regulatory region. Science. 1996;274:1527-1231. [PubMed] [DOI] |
| 12. | Chua AS, Keeling PW, Dinan TG. Role of cholecystokinin and central serotonergic receptors in functional dyspepsia. World J Gastroenterol. 2006;12:1329-1335. [PubMed] |
| 13. | Gershon MD. Nerves, reflexes, and the enteric nervous system: pathogenesis of the irritable bowel syndrome. J Clin Gastroenterol. 2005;39:S184-S193. [PubMed] |
| 15. | Minov C, Baghai TC, Schüle C, Zwanzger P, Schwarz MJ, Zill P, Rupprecht R, Bondy B. Serotonin-2A-receptor and -transporter polymorphisms: lack of association in patients with major depression. Neurosci Lett. 2001;303:119-122. [PubMed] [DOI] |
| 16. | Saito YA, Locke GR 3rd, Zimmerman JM, Holtmann G, Slusser JP, de Andrade M, Petersen GM, Talley NJ. A genetic association study of 5-HTT LPR and GNbeta3 C825T polymorphisms with irritable bowel syndrome. Neurogastroenterol Motil. 2007;19:465-470. [PubMed] [DOI] |
| 17. | Li YY, Nie YQ, Xie J, Tan HZ, Zhou YJ, Wang H. [Serotonin transporter gene polymorphisms in irritable bowel syndrome and their impact on tegaserod treatment]. Zhonghua Neike Zazhi. 2006;45:552-555. [PubMed] |
| 18. | van Lelyveld N, Linde JT, Schipper M, Samsom M. Candidate genotypes associated with functional dyspepsia. Neurogastroenterol Motil. 2008;20:767-773. [PubMed] [DOI] |
| 19. | Jarrett ME, Kohen R, Cain KC, Burr RL, Poppe A, Navaja GP, Heitkemper MM. Relationship of SERT polymorphisms to depressive and anxiety symptoms in irritable bowel syndrome. Biol Res Nurs. 2007;9:161-169. [PubMed] [DOI] |
| 20. | Thierry N, Willeit M, Praschak-Rieder N, Zill P, Hornik K, Neumeister A, Lenzinger E, Stastny J, Hilger E, Konstantinidis A. Serotonin transporter promoter gene polymorphic region (5-HTTLPR) and personality in female patients with seasonal affective disorder and in healthy controls. Eur Neuropsychopharmacol. 2004;14:53-58. [PubMed] [DOI] |
| 21. | Van Oudenhove L, Vandenberghe J, Geeraerts B, Vos R, Persoons P, Demyttenaere K, Fischler B, Tack J. Relationship between anxiety and gastric sensorimotor function in functional dyspepsia. Psychosom Med. 2007;69:455-463. [PubMed] [DOI] |
| 22. | Van Oudenhove L, Tack J. Is the antidepressant venlafaxine effective for the treatment of functional dyspepsia? Nat Clin Pract Gastroenterol Hepatol. 2009;6:74-75. [PubMed] [DOI] |