修回日期: 2010-08-29
接受日期: 2010-09-07
在线出版日期: 2010-11-28
目的: 比较UW液零下非结冰(-0.8 ℃)保存后C3A与L-02细胞的生物学特性, 探索其对生物人工肝的应用价值.
方法: 贴壁培养C3A与L-02细胞, 0.25%胰酶消化, 制备成细胞悬液, 细胞浓度调至2×109/L, 分装至2 mL冻存管, UW液-0.8 ℃保存0、24、48及72 h后, 分别测定细胞存活率与凋亡率、AST与LDH释放、尿素合成功能及白蛋白分泌功能.
结果: 随着低温保存时间的延长, 细胞存活率逐渐下降, 但72 h C3A细胞存活率明显高于L-02细胞(86.49%±2.80% vs 70.17%±2.82%, P<0.001); 细胞凋亡率亦逐渐上升, 但72 h C3A细胞凋亡率低于L-02细胞(1.26%±0.84% vs 5.73%±1.68%,P<0.001); AST及LDH的释放量逐渐增加, 但72 h C3A细胞低于L-02细胞(4.61 U/L±0.43 U/L vs 6.22 U/L±0.65 U/L,P<0.001; 86.10 U/L±11.10 U/L vs 113.88 U/L±5.64 U/L, P<0.001). 尿素合成功能呈下降的趋势, 但72 h L-02细胞明显优于C3A细胞(1.01 mmol/L±0.14 mmol/L vs 0.60 mmol/L±0.06 mmol/L, P<0.001). 白蛋白分泌功能逐渐降低, 但72 h C3A细胞明显优于L-02细胞(2.060 g/L±0.220 g/L vs 9.04 mg/L±0.53 mg/L, P<0.001).
结论: UW液-0.8 ℃保存C3A与L-02细胞72 h仍然可以满足生物人工肝支持系统的需要. 以L-02细胞为材料的人工肝可能更适用于肝衰竭合并肝性脑病, 以C3A细胞为材料的人工肝可能更适用于肝衰竭合并低白蛋白血症.
引文著录: 沙杭, 李庆勇, 张清华, 蒋知新, 李安全, 林虎, 高德禄, 张鋆歆, 高毅. 生物人工肝用C3A与L-02肝细胞零下非结冰保存后的生物学特性比较. 世界华人消化杂志 2010; 18(33): 3559-3564
Revised: August 29, 2010
Accepted: September 7, 2010
Published online: November 28, 2010
AIM: To evaluate the biological features of C3A and L-02 hepatocytes undergoing subzero nonfreezing storage in University of Wisconsin (UW) solution for use in bioartificial liver support systems (BALSS).
METHODS: C3A and L-02 hepatocytes were cultured, digested with 0.25% trypsin, prepared into a cell suspension, adjusted to a density of 2 × 106/mL, and stored in UW solution. After 0, 24, 48 and 72 h of hypothermic storage (-0.8 ℃), cell viability and apoptosis, LDH and AST release, and urea synthesis and albumin secretion were measured.
RESULTS: Hypothermic storage decreased cell viability, urea synthesis and albumin secretion, but increased apoptosis and AST and LDH release in both C3A and L-02 hepatocytes. After 72 h of hypothermic storage, C3A hepatocytes had higher viability (86.49% ± 2.80% vs 70.17% ± 2.82%, P < 0.001) and albumin secretion (2 060 mg/L ± 220 mg/L vs 9.04 mg/L ± 0.53 mg/L, P < 0.001) but lower apoptosis rate (1.26% ± 0.84% vs 5.73% ± 1.68%, P < 0.001), LDH and AST release (4.61 U/L ± 0.43 U/L vs 6.22 U/L ± 0.65 U/L, P < 0.001; 86.10 U/L ± 11.10 U/L vs 113.88 U/L ± 5.64 U/L, P < 0.001) and urea synthesis (1.01 mmol/L ± 0.14 mmol/L vs 0.60 mmol/L ± 0.06 mmol/L, P < 0.001) than L-02 hepatocytes.
CONCLUSION: Both C3A and L-02 hepatocytes could be stored for more than 72 h in UW solution. C3A hepatocytes are more probably suitable for BALSS for management of liver failure with hepatic encephalopathy, while L-02 hepatocytes are more probably suitable for BALSS for management of liver failure with low albuminemia.
- Citation: Sha H, Li QY, Zhang QH, Jiang ZX, Li AQ, Lin H, Gao DL, Zhang JX, Gao Y. Comparison of biological features of C3A and L-02 hepatocytes undergoing subzero nonfreezing storage for use in bioartificial liver support system. Shijie Huaren Xiaohua Zazhi 2010; 18(33): 3559-3564
- URL: https://www.wjgnet.com/1009-3079/full/v18/i33/3559.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i33.3559
生物人工肝支持系统(bioartificial liver support system, BALSS)为肝衰竭的治疗开辟了新的途径[1], 而功能好的肝细胞是BALSS的核心, 所以探索出一种可靠的肝细胞低温保存方法, 建立一个(ready to use)肝细胞库是BALSS推广的基础[2]. 温度是影响保存效果的关键因素, 温度越低, 细胞代谢活性越低, 一般而言保存时间就越长[3]. 零下非结冰温度(subzero nonfreezing temperature, SZNFT)是指0 ℃到溶液冰点之间的温度范围, 可使代谢降至最低同时避免"冰晶形成"冻存损伤[4], 保存效果优于常规4 ℃及0 ℃低温保存[5]. C3A细胞是一种人源性高分化肝肿瘤细胞, 具备氨基清除和白蛋白分泌等功能, 以C3A作为生物材料的体外肝辅助装置(extracorporeal liver-assist device, ELAD)系统已经进入Ⅲ期临床试验[6]. L-02细胞是国内构建的一种永生化肝细胞株, 具备增殖迅速、传代稳定和氨基清除等功能, 已有学者用其进行BALSS的基础研究[7,8]. 有关C3A与L-02肝细胞零下非结冰保存后细胞功能变化及细胞功能差异尚不明确. 因此, 我们用UW液(冰点-1 ℃)-0.8 ℃保存C3A与L-02肝细胞, 以比较低温保存后C3A与L-02细胞的生物学特性及其BALSS应用倾向性.
C3A肝细胞株(ATCC, 美国), L-02永生化肝细胞株(中国医学科学院); DMEM/F-12培养基、优级胎牛血清(FBS)、青霉素/链霉素溶液(100×)、0.25%胰酶及PBS缓冲液(Invitrogen, 美国); UW液(Bristol-Myers Squibb); 50 mL培养瓶、2 mL冻存管及6孔培养板(Costar Corning); 氯化铵(Sigma); 人白蛋白ELISA试剂盒(R&D, 美国), Mode1450型酶标仪(Bio-Rad, 美国); CK2型倒置显微镜(Olympus, 日本); Annexin V-FITC凋亡试剂盒(南京凯基); DXC800型全自动生化仪及FACScan型流式细胞仪(Beckman coulter, 美国); MIR-151型微电脑程控低温培养箱[(-10 ℃至60 ℃)±0.1 ℃]及MCO-175型二氧化碳培养箱(SANYO, 日本); 海尔智能温度记录仪[(-100 ℃至120 ℃)±0.1 ℃]. 超净工作台(北京昌平长城空气净化工程公司).
1.2.1 分组: 实验分2组, C3A肝细胞组和L-02肝细胞组.
1.2.2 冰点测定: 1 mL蒸馏水(或者UW液)置于2 mL冻存管中, 将智能温度计电极插入溶液中(避免与管壁接触), 然后将冻存管置于-10 ℃程控低温培养箱内, 每1 min记录1次温度值, 绘制成时间温度曲线(-10 ℃至10 ℃).
1.2.3 细胞培养及制备: 所用基础培养液为DMEM/F-12, 添加青霉素: 10 kU/L, 链霉素: 10 g/L, 100 mL/L FBS. 于37 ℃, 50 mL/L CO2, 100%湿度的培养箱内培养. 内壁长满后, 0.25%胰酶消化, 制备成细胞悬液, 血细胞计数板计数, 最终将细胞浓度调至2×109/L, 分装至2 mL冻存管中.
1.2.4 低温保存及复温: 冻存管内培养液置换为UW液, 保存0、24、48及72 h后每组取6个标本, 放入37 ℃水浴中震荡l-2 min. 复温后将UW液置换为培养液2 mL, 培养箱内培养30 min.
1.2.5 复温后指标测定: 取l mL细胞悬液, 加到1 mL含4 mmol/L氯化铵培养液的6孔培养板中, 培养箱内培养24 h后, 取上清, 2 000 r/min, 离心20 min, 测定尿素的浓度、AST、LDH及人白蛋白含量. 另l mL细胞悬液, 1 000 r/min, 离心2 min, 沉淀细胞于流式细胞仪定量测定细胞存活率、凋亡率及死亡率.
统计学处理 采用SPSS13.0统计软件. 计量资料以mean±SD表示. 两组样本均数比较采用完全随机样本的t检验, 以P<0.05为差异有意义.
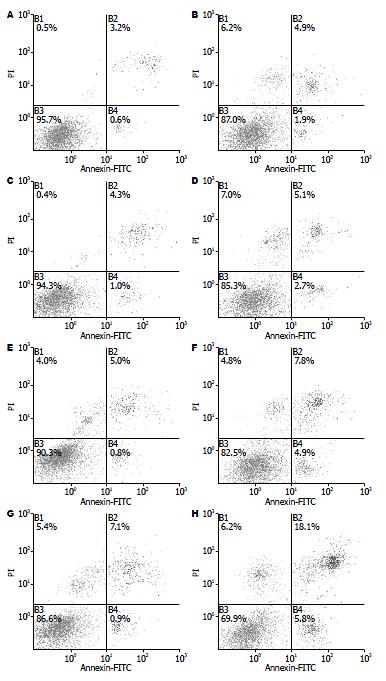
随低温保存时间的延长, 细胞存活率呈下降趋势, 细胞凋亡率呈上升趋势, 低温保存72 h, 细胞存活率较48 h明显下降. 但是, 各时间点C3A细胞存活率均高于L-02细胞, C3A细胞凋亡率均低于L-02细胞(均P<0.01, 表1, 图1).
| 分组 | 细胞存活率 | 细胞凋亡率 | ||||||
| 0 h | 24 h | 48 h | 72 h | 0 h | 24 h | 48 h | 72 h | |
| C3A细胞组 | 95.26±0.45 | 94.23±0.74 | 90.24±1.48 | 86.49±2.80 | 0.70±0.18 | 0.81±0.21 | 1.05±0.57 | 1.26±0.84 |
| L-02细胞组 | 86.95±1.43 | 84.53±1.38 | 82.00±1.57 | 70.17±2.82 | 1.73±0.20 | 3.22±1.24 | 4.53±0.83 | 5.73±1.68 |
| t值 | 15.61 | 17.07 | 10.06 | 10.76 | 10.31 | 5.46 | 9.32 | 6.59 |
| P值 | <0.001 | <0.001 | <0.001 | <0.001 | <0.001 | <0.001 | <0.001 | <0.001 |
随着低温下保存时间的延长, 反应细胞损伤程度的AST、LDH释放量呈上升的趋势. 但是, 各时间点C3A细胞释放LDH、AST均低于L-02细胞(均P<0.05, 表2).
| 分组 | LDH释放(U/L) | AST释放(U/L) | ||||||
| 0 h | 24 h | 48 h | 72 h | 0 h | 24 h | 48 h | 72 h | |
| C3A细胞组 | 30.59±6.24 | 43.26±4.23 | 61.39±9.85 | 86.10±11.10 | 3.26±0.37 | 3.44±0.31 | 4.04±0.35 | 4.61±0.43 |
| L-02细胞组 | 49.52±5.57 | 53.97±4.50 | 84.80±6.84 | 113.88±5.64 | 3.83±0.48 | 5.38±1.15 | 5.85±0.90 | 6.22±0.65 |
| t值 | 5.87 | 4.02 | 4.97 | 5.57 | 2.52 | 4.61 | 5.22 | 5.60 |
| P值 | <0.001 | 0.008 | <0.001 | <0.001 | 0.030 | <0.001 | <0.001 | <0.001 |
随低温保存时间的延长, 反应细胞功能的尿素合成与白蛋白分泌呈下降的趋势. 各时间点L-02细胞的尿素合成功能均明显优于C3A细胞, 而白蛋白分泌功能C3A细胞则明显优于L-02(表3, 4).
| 分组 | 0 h | 24 h | 48 h | 72 h |
| C3A细胞组 | 1.07±0.05 | 0.99±0.11 | 0.88±0.10 | 0.60±0.06 |
| L-02细胞组 | 2.63±0.46 | 2.02±0.44 | 1.58±0.24 | 1.01±0.14 |
| t值 | 9.12 | 5.66 | 6.78 | 7.34 |
| P值 | <0.001 | <0.001 | <0.001 | <0.001 |
| 分组 | 0 h | 24 h | 48 h | 72 h |
| C3A细胞组(g/L) | 2.41±0.26 | 2.29±0.24 | 2.16±0.19 | 2.06±0.22 |
| L-02细胞组(mg/L) | 11.90±0.39 | 10.78±0.53 | 9.85±0.56 | 9.04±0.53 |
| t值 | 54.48 | 40.33 | 36.84 | 33.72 |
| P值 | <0.001 | <0.001 | <0.001 | <0.001 |
BALSS要代替肝脏, 除细胞材料必须具有肝脏特异性功能外, 还需要大量肝细胞, 即约109个数量级才有临床意义. 为了满足临床对肝细胞数量的需求, 传统上采取传代培养或者微载体高密度培养的方法, 但其工作量大、易污染、费用高且肝细胞经多次传代后活性下降. 因此探索出一种可靠的肝细胞低温保存方法, 建立一个(ready to use)肝细胞库, 可以克服肝细胞多次传代培养的缺点, 这是短期内获得大量肝细胞的较好方法[9]. 低温保存是基于低温可以延缓细胞代谢速率、阻止细胞能量枯竭从而长时间保存细胞. 为获得较高的细胞存活率及延长低温保存时间, 许多学者对多种冻存保护剂进行了研究, 但是"细胞内冰晶"、"渗透性休克"是深低温冻存无法逾越的障碍[4]. 4 ℃常规低温保存肝细胞48 h后细胞存活率明显下降, 因此研究者[10,11]开始把肝细胞低温保存转向SZNFT保存. 不同溶液的冰点与SZNFT不同[5], 为了避免低温保存过程中冰晶形成, 我们用UW液于-0.8 ℃低温保存C3A细胞, 缓慢降温(4 ℃降至-0.8 ℃时间约60 min).
BALSS所用肝细胞的来源至今尚未得到满意解决. 理论上原代肝细胞最理想, 但原代肝细胞因来源有限、体外培养和扩增困难等而难以作为BALSS的细胞材料. 人胎肝细胞具有一定的增殖活性, 但其分化不成熟, 功能不完善, 并涉及伦理学问题也难以广泛应用[12]. 猪肝细胞是BALSS比较常用的细胞, 但猪肝细胞存在免疫排斥及异种病毒感染等安全隐患[13]. 人源性永生化肝细胞可以有效地克服上述细胞不足, 以其为材料的BALSS是目前研究的热点. C3A是一种人源性永生化肿瘤细胞, 具有良好的增殖活性及肝细胞特异功能, 如分泌ALB, 参与尿素合成与糖原合成等[6]. L-02肝细胞是国内使用正常人肝细胞构建的一种永生化肝细胞株, 具备氨基清除及分泌白蛋白等功能, 增殖迅速且传代稳定[7,8]. 因此, 我们使用C3A细胞和L-02细胞进行相关研究.
细胞膜及细胞内细胞器质膜的完整性程度是影响细胞功能的重要因素[14]. 我们用Annexin V-FITC/PI双染法, 使用流式细胞仪测定细胞存活率及凋亡率发现, 随低温保存时间的延长, C3A细胞与L-02细胞存活率呈下降的趋势, 但是各时间点C3A细胞的存活率高于L-02细胞, 可能是C3A系高分化肿瘤细胞, 对低温损伤的耐受性强于L-02细胞. 尽管细胞存活率较新鲜时明显下降, 但是SZNFT下保存72 h后C3A及L-02细胞的存活率分别可达到86.49%±2.80%和70.17%±2.82%, 仍然可以满足生物人工肝的需要.
作为BALSS生物材料体外培养的肝细胞, 应具备体内肝细胞氨基清除功能(氯化铵转化实验)及白蛋白分泌等主要功能. 而低温保存对不同种属肝细胞氨基清除能力及白蛋白分泌的影响可能不同: Calligaris等[15]用UW液4 ℃保存鼠肝细胞72 h, 发现低温保存的肝细胞氨基清除能力和尿素合成能力同新鲜细胞无明显差异. 我们用-0.8 ℃保存C3A细胞及L-02细胞, 其氨基清除能力及白蛋白分泌随时间延长呈下降的趋势, 可能系两者为人源性永生化细胞, 其相关酶系分化不完全, 同原代鼠肝细胞相比, 易于因低温而造成细胞损伤.
总之, L-02细胞与C3A细胞是比较合适的BALSS细胞材料. UW液-0.8 ℃保存L-02细胞与C3A细胞72 h仍然可以满足BALSS的需要. 以L-02细胞为材料的BALSS可能更适用于肝功能衰竭合并肝性脑病, 以C3A细胞为材料的BALSS更适用于肝功能衰竭合并低白蛋白血症.
目前肝功能衰竭病死率高达80%左右, 现有病因治疗及支持治疗疗效甚微. 肝移植被认为是最有效的治疗手段, 但存在供体严重不足、终生免疫治疗及费用昂贵等缺点. 生物人工肝的发展为肝衰竭的治疗提供了新的途径.
郑素军, 副主任医师, 首都医科大学附属北京佑安医院人工肝中心
Calligaris等用UW液4 ℃保存鼠肝细胞72 h, 发现低温保存的肝细胞氨基清除能力和尿素合成能力同新鲜细胞无明显差异.
本文首次用UW液零下非结冰保存C3A与L-02肝细胞, 并比较了低温保存后C3A与L-02细胞的生物学特性及其BALSS应用倾向性.
零下非结冰不同于深低温冻存和常规低温保存, 是一种比较新的有效的肝细胞低温保存方法. 零下非结冰保存L-02细胞与C3A细胞72 h仍然可以满足BALSS的需要, 且两种细胞的BLASS的临床应用倾向性不同.
本文选题较新颖, 对于构建有临床使用价值的生物反应器有一定的参考意义.
编辑: 曹丽鸥 电编:何基才
| 1. | Demetriou AA, Brown RS Jr, Busuttil RW, Fair J, McGuire BM, Rosenthal P, Am Esch JS 2nd, Lerut J, Nyberg SL, Salizzoni M, Fagan EA, de Hemptinne B, Broelsch CE, Muraca M, Salmeron JM, Rabkin JM, Metselaar HJ, Pratt D, De La Mata M, McChesney LP, Everson GT, Lavin PT, Stevens AC, Pitkin Z, Solomon BA. Prospective, randomized, multicenter, controlled trial of a bioartificial liver in treating acute liver failure. Ann Surg. 2004;239:660-667; discussion 667-670. [PubMed] [DOI] |
| 2. | Fiegel HC, Kaufmann PM, Bruns H, Kluth D, Horch RE, Vacanti JP, Kneser U. Hepatic tissue engineering: from transplantation to customized cell-based liver directed therapies from the laboratory. J Cell Mol Med. 2008;12:56-66. [PubMed] [DOI] |
| 3. | Llarrull MS, Pizarro MD, Scandizzi AL, Bottai H, Guibert EE, Rodriguez JV. Cold preservation of isolated hepatocytes in UW solution: experimental studies on the respiratory activity at 0 degrees C. Cryo Letters. 2007;28:313-328. [PubMed] |
| 4. | Fleming KK, Hubel A. Cryopreservation of hematopoietic and non-hematopoietic stem cells. Transfus Apher Sci. 2006;34:309-315. [PubMed] [DOI] |
| 5. | 李 庆勇, 张 清华, 蒋 知新, 沙 杭, 林 虎, 李 安全, 龙 炫辉, 高 毅. 生物人工肝用C3A细胞在零下非结冰时的保存. 世界华人消化杂志. 2010;18:428-436. [DOI] |
| 6. | Filippi C, Keatch SA, Rangar D, Nelson LJ, Hayes PC, Plevris JN. Improvement of C3A cell metabolism for usage in bioartificial liver support systems. J Hepatol. 2004;41:599-605. [PubMed] [DOI] |
| 10. | Rodríguez JV, Almada LL, Mamprin ME, Guibert EE, Furno G. Subzero nonfreezing storage of rat hepatocytes using modified University of Wisconsin solution (mUW) and 1,4-butanediol. I- effects on cellular metabolites during cold storage. Ann Hepatol. 2009;8:57-62. [PubMed] |
| 11. | Guibert EE, Almada LL, Mamprin ME, Bellarosa C, Pizarro MD, Tiribelli C, Rodriguez JV. Subzero nonfreezing storage of rat hepatocytes using UW solution and 1,4-butanediol. II- functional testing on rewarming and gene expression of urea cycle enzymes. Ann Hepatol. 2009;8:129-133. [PubMed] |
| 12. | Poyck PP, Hoekstra R, van Wijk AC, Attanasio C, Calise F, Chamuleau RA, van Gulik TM. Functional and morphological comparison of three primary liver cell types cultured in the AMC bioartificial liver. Liver Transpl. 2007;13:589-598. [PubMed] [DOI] |
| 13. | Wang HH, Wang YJ, Liu HL, Liu J, Huang YP, Guo HT, Wang YM. Detection of PERV by polymerase chain reaction and its safety in bioartificial liver support system. World J Gastroenterol. 2006;12:1287-1291. [PubMed] |
| 14. | Katenz E, Vondran FW, Schwartlander R, Pless G, Gong X, Cheng X, Neuhaus P, Sauer IM. Cryopreservation of primary human hepatocytes: the benefit of trehalose as an additional cryoprotective agent. Liver Transpl. 2007;13:38-45. [PubMed] [DOI] |
| 15. | Calligaris SD, Almada LL, Guibert EE, Tiribelli C, Rodriguez JV. Ammonium detoxifying activity is maintained after 72 hours of cold preservation of rat hepatocytes in University of Wisconsin (UW) solution. Cryo Letters. 2002;23:245-254. [PubMed] |