修回日期: 2010-10-21
接受日期: 2010-10-26
在线出版日期: 2010-11-18
目的: 探讨超声内镜联合内镜下黏膜切除术(endoscopic mucosal resection, EMR)或内镜下黏膜剥离术(endoscopic submucosal dissection, ESD)在胃异位胰腺诊断和治疗中的作用, 以提高胃异位胰腺的确诊率.
方法: 对2008-09/2010-02淮安市第一人民医院23例经超声胃镜检查拟诊为胃异位胰腺的病例进行回顾性分析, 病例标本均经HE染色及光学显微镜检查.
结果: 23例病例中19例经EMR治疗, 4例经ESD治疗. 经病理组织学检查13例确诊为胃异位胰腺; 误诊10例. 23例病例中病灶体积最大的为24 mm×20 mm, 体积最小的为5 mm×4 mm; 经超声内镜证实23例中有7例起源于黏膜层, 4例来源于肌层, 12例起源于黏膜下层.
结论: 联合应用超声内镜学和EMR或ESD, 可以提高胃异位胰腺的确诊率, 同时EMR和ESD作为一种微创治疗方法, 减轻了患者必须进行外科手术治疗的痛苦并降低了医疗费用.
引文著录: 周传文, 李倩君. 超声内镜联合EMR或ESD在异位胰腺诊断和治疗中的作用. 世界华人消化杂志 2010; 18(32): 3476-3479
Revised: October 21, 2010
Accepted: October 26, 2010
Published online: November 18, 2010
AIM: To investigate the use of endoscopic ultrasound in combination with endoscopic mucosal resection (EMR)/endoscopic submucosal dissection (ESD) for the diagnosis and treatment of heterotopic pancreas to improve the diagnosis of gastric heterotopic pancreas.
METHODS: The endoscopic and clinicopathologic data for 23 patients with suspected heterotopic pancreas who underwent EMR or ESD from September 2008 to February 2010 at our hospital were retrospectively analyzed. All tissue specimens underwent hematoxylin-eosin staining and observed by optical light microscopy.
RESULTS: Of all the 23 patients included, 19 underwent EMR and 4 underwent ESD; 13 were diagnosed with heterotopic pancreas by postoperative pathological examination and 10 were misdiagnosed.
CONCLUSION: Endoscopic ultrasound in combination with EMR or ESD can improve the diagnosis of gastric heterotopic pancreas.
- Citation: Zhou CW, Li QJ. Endoscopic ultrasound in combination with endoscopic mucosal resection/endoscopic submucosal dissection for diagnosis and treatment of heterotopic pancreas. Shijie Huaren Xiaohua Zazhi 2010; 18(32): 3476-3479
- URL: https://www.wjgnet.com/1009-3079/full/v18/i32/3476.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i32.3476
异位胰腺又被称为迷走胰腺或胰腺异位, 指存在于正常胰腺位置以外的胰腺组织[1], 多起源于胃肠道黏膜下层或肌层, 内镜检查结合病理组织活检往往能够确诊. 近年来随着内镜学的发展, 对胃肠道黏膜下病变, 包括异位胰腺的诊断明显增多. 临床上对异位胰腺的处理方法不尽相同, 本文即通过对23例拟诊胃异位胰腺的回顾性分析, 讨论超声内镜联合内镜下黏膜切除术(endoscopic mucosal resection, EMR)或内镜下黏膜剥离术(endoscopic submucosal dissection, ESD)在临床上诊断、治疗胃异位胰腺的应用.
2007-09/2010-01在淮安市第一人民医院行超声内镜检查拟诊为胃异位胰腺的23例患者, 其中男14例, 女9例, 年龄14-79岁, 平均(55.2±12.6)岁. 临床表现: 腹部不适9例, 腹痛、腹胀8例, 反酸5例, 恶心、呕吐4例, 胃肠道出血2例, 2例患者无临床症状.
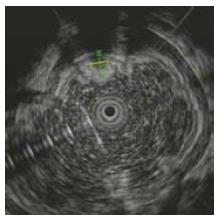
纤维电子胃镜检查采用Olympus 260; EUS检查采Olympus GIF-UM 2000型电子超声内镜, 超声探头频率为12-20 MHz, 采用脱气水充盈法扫描. 记录病灶在纤维电子胃镜下的特点和病灶超声图像的起源层次及病灶回声特点. 超声内镜可以确定胃肠壁各层病变的来源和性质. 异位胰腺的细胞组成中可以有胰腺腺泡、胰岛细胞和导管, 各成分所占的比例在不同病例中有所不同, 导致不同病例的病灶在超声内镜下回声性质不同. 异位胰腺在超声内镜下的特点为边界不清的、形态不一、内部回声不一、可以有导管样结构的多数起源于黏膜下层或肌层的病变[2]. 据此, 起源于肠壁任意一层的低回声、高回声或混合回声病灶, 病变内有不均匀的高回声点、导管状结构、或有微小液性囊肿, 病变中部有脐样凹陷等表现, 则符合异位胰腺的诊断, 并注意与间质瘤、脂肪瘤和血管瘤等病变鉴别. 病灶体积小于15 mm×15 mm者行EMR, 超过15 mm×15 mm者行ESD.
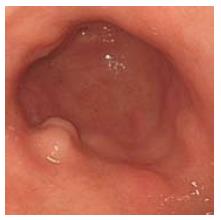
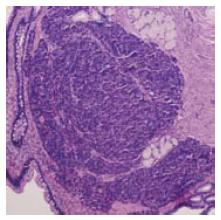
23例中有19例采用了EMR术、4例采用了ESD术; 经病理组织学检查13例确诊为胃异位胰腺; 误诊10例中, 息肉3例, 间质瘤3例, 萎缩性胃炎 2例, 上皮内瘤变1例, 腺癌1例. 23例病例中病灶体积最大的为24 mm×20 mm, 体积最小的为5 mm×4 mm; 经超声内镜证实23例中有7例起源于黏膜层(其中异位胰腺3例, 占42.86%, 在13例异位胰腺中占23.08%), 12例起源于黏膜下层(其中异位胰腺9例, 占75.00%, 在13例异位胰腺中占69.23%), 4例来源于肌层(其中异位胰腺1例, 占25%, 在13例异位胰腺中占7.69%). 23例病例回声结果: 低回声17例(其中异位胰腺10例, 在13例异位胰腺中占76.92%), 混合回声3例(其中异位胰腺2例, 在13例异位胰腺中占15.38%), 高回声3例(其中异位胰腺1例, 在13例异位胰腺中占7.69%)(图1-3, 表1).
| 内镜下特点 | n | 异位胰腺(n = 13) | 萎缩性胃炎(n = 2) | 上皮内瘤变(n = 1) | 息肉(n = 3) | 间质瘤(n = 3) | 腺癌(n = 1) |
| 病变起源层次 | 23 | ||||||
| 黏膜层 | 7 | 3 | 1 | 0 | 2 | 0 | 1 |
| 黏膜下层 | 12 | 9 | 0 | 1 | 0 | 2 | 0 |
| 黏膜肌层 | 4 | 1 | 0 | 1 | 0 | 2 | 0 |
| 回声特点 | 23 | ||||||
| 低回声 | 17 | 10 | 2 | 1 | 1 | 2 | 1 |
| 高回声 | 3 | 1 | 0 | 0 | 1 | 1 | 0 |
| 混合回声 | 3 | 2 | 0 | 0 | 1 | 0 | 0 |
异位胰腺是指一种少见的存在于正常胰腺位置以外的胰腺组织, 与正常胰腺组织无任何解剖和血管联系[1], 可以发生于消化系的任何部位[3], 更倾向发生在胃、十二指肠等上消化系. 首次于1927被发现于回肠憩室. 在尸检中异位胰腺的发病率为0.5%-13.7%, 更易发生于30-50岁的男性[1].
目前对异位胰腺的发生机制有几种不同的看法, 为大家普遍接受的一种机制是当胚胎时期正常的胰腺组织从原始肠基中的胰芽发展成形的过程中, 有部分胰芽残留在肠壁中, 残留下来的胰芽组织随着胃肠道的发展从而演变为异位胰腺组织[4]; 另一种理论认为胚胎时期胰腺组织从内胚层演变的过程中, 有部分发育为胰腺组织的内胚层遗留在胃肠道黏膜下层, 从而发展为异位胰腺[4].
多数情况下, 异位胰腺是没有临床症状的, 但当并发炎症、出血、梗阻或发生恶性变时会出现与并发症相关的临床症状[5]. Armstrong等[6]认为病变>1.5 cm易出现临床症状. 疼痛是异位胰腺较常见的一种症状, 目前认为疼痛产生的可能原因是异位胰腺组织的内、外分泌作用引起胃黏膜的炎症和化学刺激所致[7]. 在本次研究中, 13例经病理确诊为异位胰腺的患者中, 8例有腹痛; 而黏膜的糜烂和溃疡形成是导致胃出血的主要原因[8], 本次研究中, 13例经病理确诊为异位胰腺的患者中, 1例有溃疡.
异位胰腺内镜下特点为: 隆起性病变, 形态大小不一, 表面覆盖绒毛样黏膜, 病变顶端可有脐样凹陷, 并有管样开口[9]. 超声内镜的发明为胃异位胰腺的诊断提供了大量有用的信息. Matsushita等[2]认为异位胰腺在超声内镜下的特点为边界不清的、形态不一、内部回声不一、可以有导管样结构的多数起源于黏膜下层或肌层的病变. 但即使根据典型的内镜或超声内镜下特点, 仍容易导致误诊; 本研究中, 23例拟诊的胃异位胰腺只有13例经病理组织检查所确证.
目前公认的异位胰腺的病理诊断标准为Gaspar-Fuentes[3]分类系统, 具体内容如下: Ⅰ型: 像正常的胰腺组织一样, 在组织标本中发现胰腺腺泡、胰岛细胞和胰腺导管; Ⅱ型: 组织标本中只发现有胰腺导管; Ⅲ型: 组织标本中只发现有具有外分泌功能的胰腺腺泡; Ⅳ型: 组织标本中只发现有具有内分泌功能的胰岛细胞.
本研究中, 所有患者都签署了术前知情同意书, 并进行了EMR或ESD手术. EMR或ESD可以为病理组织活检提供较为完整的病变组织, 避免常规组织检查中取材较浅或局限的问题, 且EMR或ESD作为一种治疗手段不仅可以达到治疗、减轻病痛的目的, 而且避免了患者进行外科手术治疗的痛苦和医疗费用. 但对于病变较深不能进行EMR或ESD手术的拟诊异位胰腺患者, 伴有临床表现者, 亦进行外科手术治疗[7,10,11], 因为异位胰腺与胃肠道间质瘤、胃肠道自主神经瘤、良性肿瘤及淋巴瘤等在影像学检查下易混淆[12,13]且异位胰腺本身可恶变为异位胰腺癌及异位胰岛细胞癌[14,15].
总之, 虽然异位胰腺的发病率较低, 但在临床中遇到有胃肠道黏膜或黏膜下病变时, 应将异位胰腺作为一个鉴别诊断考虑. 尽管我们的医学检查技术在不断的提高, 但对异位胰腺的诊断还存在大量的挑战.
异位胰腺是一种少见的, 可发生于全消化系的疾病, 甚至发生出血、溃疡、胰腺炎甚至发生癌变而危险到人类健康或生命.
韩天权, 教授, 上海交通大学医学院附属瑞金医院外科、上海消化外科研究所
Matsushita等认为异位胰腺在超声内镜下的特点为边界不清的、形态不一、内部回声不一、可以有导管样结构的多数起源于黏膜下层或肌层的病变.
本文科学性较好, 为异位胰腺的诊断提供了新方法.
编辑 李军亮 电编 何基才
| 1. | Mulholland KC, Wallace WD, Epanomeritakis E, Hall SR. Pseudocyst formation in gastric ectopic pancreas. JOP. 2004;5:498-501. [PubMed] |
| 2. | Matsushita M, Hajiro K, Okazaki K, Takakuwa H. Gastric aberrant pancreas: EUS analysis in comparison with the histology. Gastrointest Endosc. 1999;49:493-497. [PubMed] [DOI] |
| 3. | Christodoulidis G, Zacharoulis D, Barbanis S, Katsogridakis E, Hatzitheofilou K. Heterotopic pancreas in the stomach: a case report and literature review. World J Gastroenterol. 2007;13:6098-6100. [PubMed] [DOI] |
| 4. | Chandan VS, Wang W. Pancreatic heterotopia in the gastric antrum. Arch Pathol Lab Med. 2004;128:111-112. [PubMed] |
| 5. | Rimal D, Thapa SR, Munasinghe N, Chitre VV. Symptomatic gastric heterotopic pancreas: clinical presentation and review of the literature. Int J Surg. 2008;6:e52-e54. [PubMed] [DOI] |
| 6. | Armstrong CP, King PM, Dixon JM, Macleod IB. The clinical significance of heterotopic pancreas in the gastrointestinal tract. Br J Surg. 1981;68:384-387. [PubMed] [DOI] |
| 7. | Ormarsson OT, Gudmundsdottir I, Mårvik R. Diagnosis and treatment of gastric heterotopic pancreas. World J Surg. 2006;30:1682-1689. [PubMed] [DOI] |
| 8. | Canbaz H, Colak T, Düşmez Apa D, Sezgin O, Aydin S. An unusual cause of acute abdomen: mesenteric heterotopic pancreatitis causing confusion in clinical diagnosis. Turk J Gastroenterol. 2009;20:142-145. [PubMed] |
| 9. | Hsia CY, Wu CW, Lui WY. Heterotopic pancreas: a difficult diagnosis. J Clin Gastroenterol. 1999;28:144-147. [PubMed] [DOI] |
| 10. | Ayantunde AA, Pinder E, Heath DI. Symptomatic pyloric pancreatic heterotopia: report of three cases and review of the literature. Med Sci Monit. 2006;12:CS49-CS52. [PubMed] |
| 11. | Erkan N, Vardar E, Vardar R. Heterotopic pancreas: report of two cases. JOP. 2007;8:588-591. [PubMed] |
| 12. | Yuan Z, Chen J, Zheng Q, Huang XY, Yang Z, Tang J. Heterotopic pancreas in the gastrointestinal tract. World J Gastroenterol. 2009;15:3701-3703. [PubMed] [DOI] |
| 13. | Jiang LX, Xu J, Wang XW, Zhou FR, Gao W, Yu GH, Lv ZC, Zheng HT. Gastric outlet obstruction caused by heterotopic pancreas: A case report and a quick review. World J Gastroenterol. 2008;14:6757-6759. [PubMed] [DOI] |
| 14. | Eisenberger CF, Gocht A, Knoefel WT, Busch CB, Peiper M, Kutup A, Yekebas EF, Hosch SB, Lambrecht W, Izbicki JR. Heterotopic pancreas--clinical presentation and pathology with review of the literature. Hepatogastroenterology. 2004;51:854-858. [PubMed] |
| 15. | Inoue Y, Hayashi M, Arisaka Y, Higuchi K, Egashira Y, Tanigawa N. Adenocarcinoma arising in a heterotopic pancreas (Heinrich type III): a case report. J Med Case Rep. 2010;4:39. [PubMed] [DOI] |