修回日期: 2010-09-26
接受日期: 2010-10-13
在线出版日期: 2010-11-18
目的: 研究血管生成素样蛋白3(angiopoietin-like protein 3, ANGPTL3)在肝细胞癌(hepatocellular carcinoma, HCC)中的表达及其与血管生成的关系.
方法: 应用免疫组织化学方法检测96例肝癌组织和癌旁组织中ANGPTL3和VEGF的表达, 同时检测其肝癌组织内微血管密度(microvessel density, MVD). 应用Western blot方法检测肝癌组织和癌旁组织中ANGPTL3和VEGF的表达.
结果: 肝癌组织中ANGPTL3和VEGF表达与癌旁组织中比较显著增加(62.50% vs 32.29%; 81.25% vs 29.17%, P<0.05). HCC组织中存在活跃的血管生成(67.71% vs 31.25%, P<0.05), 血管生成与ANGPTL3表达相关. Western blot提示肝癌组织中ANGPTL3和VEGF蛋白的表达明显高于癌旁组织, 且表达呈正相关.
结论: HCC中ANGPTL3高表达是肿瘤血管生成的重要因素.
引文著录: 李德宇, 陈孝平. ANGPTL3在肝细胞癌中的表达及其与肿瘤血管生成的关系. 世界华人消化杂志 2010; 18(32): 3471-3475
Revised: September 26, 2010
Accepted: October 13, 2010
Published online: November 18, 2010
AIM: To investigate the correlation between the expression of angiopoietin-like protein 3 (ANGPTL3) and tumor angiogenesis in hepatocellular carcinoma (HCC).
METHODS: The expression of ANGPTL3 and VEGF proteins in 96 HCC specimens and matched tumor-adjacent specimens was detected by immunohistochemistry and Western blot. Immunohistochemical staining for CD34 was performed in the above specimens to evaluate microvessel density (MVD).
RESULTS: The positive rates of ANGPTL3 and VEGF expression in HCC were significantly higher than that in tumor-adjacent tissue (62.50% vs 32.29%; 81.25% vs 29.17%, both P < 0.05). Active angiogenesis was detected in HCC compared to tumor-adjacent tissue (67.71% vs 31.25%, P < 0.05). Tumor angiogenesis was related with ANGPTL3 expression in HCC. The expression of ANGPTL3 and VEGF protein was significantly up-regulated in HCC compared with matched tumor-adjacent noncancerous tissue.
CONCLUSION: High expression of ANGPTL3 is associated with tumor angiogenesis in HCC.
- Citation: Li DY, Chen XP. Correlation between ANGPTL3 expression and tumor angiogenesis in hepatocellular carcinoma. Shijie Huaren Xiaohua Zazhi 2010; 18(32): 3471-3475
- URL: https://www.wjgnet.com/1009-3079/full/v18/i32/3471.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i32.3471
原发性肝癌(primary hepatic carcinoma, PHC)是我国最常见的恶性肿瘤之一, 近年来发病率和死亡率都有明显上升趋势, 对人们的健康构成了很大威胁. PHC早期缺乏典型的临床表现, 早期就可能就存在肝内转移, 导致术后的复发率居高不下. 此外肝癌患者多伴有肝炎、肝硬化背景, 容易造成严重的肝功能损害, 使得肝癌的生存率低下, 即使是根治性手术切除, 5年生存率仅为20%-30%[1]. 肝癌的发生、发展及浸润转移与肿瘤血管的形成有密不可分的关系. 血管生成素样蛋白3(angiopoietin-like protein 3, ANGPTL3)是一种分泌性蛋白因子, 具有促进肿瘤新生血管形成的作用[2]. 本研究通过免疫组化方法, 检测ANGPTL3在肝细胞癌(hepatocellular carcinoma, HCC)中的表达, 探讨ANGPTL3与肿瘤血管生成的关系.
收集河南省人民医院2007-01/2009-11术后病理诊断为HCC的手术切除肿瘤组织、癌旁组织标本96例, 患者术前均未经化学治疗或放射治疗. 其中男64例, 女32例, 年龄33-74(平均56.3±6.2)岁. 免疫组织检测试剂盒是美国Invitrogen公司最新推出的第3代二步法免疫组织化学检测试剂, 其他试剂均为进口超纯级或国产分析纯以上级产品. 鼠抗人CD34内皮细胞免疫组织化学单克隆抗体(产品编号: MAB-0034)为福州迈新生物技术开发有限公司产品.
1.2.1 免疫组织化学: 用自动切片机将石蜡标本切成5 μm厚度切片, 脱水、透明、中性树胶封片. 严格按照产品说明书进行SP免疫组织化学染色. 取已知含有待检抗原的切片作为阳性对照, 用PBS缓冲液代替第一抗体, 采用同样的方法染色. DAB显色, Mayer氏苏木素复染核, 进行免疫组织化学, 检测ANGPTL3在人肝癌组织、癌旁组织中的表达差异. ANGPTL3表达以每张切片≥3个视野中的细胞内棕黄色颗粒状染色, 且着色明显高于背景或背景不着色而细胞着色者为阳性表达. 按染色强度(未着色、弱、中、强)及染色阳性细胞的百分数(0%, 1%-25%, 26%-50%, >50%), 分别积分为0, 1, 2, 3, 两项分数之和为0-2分者计为染色阴性, 3-6分者计为染色阳性[3].
1.2.2 微血管密度计数: 肿瘤组织CD34免疫组织化学染色后, 计算肿瘤内着色的毛细血管和微小血管数. 凡呈现棕黄色单个或成群无管腔的染色细胞均作为个微血管计数, 而管腔>8个红细胞大小(管腔直径>50 µm)及肌层较厚的血管不计数. 计数方法为: 每张切片先在低倍视野下观察整张切片的血管分布情况, 然后选取癌灶的5个微血管最丰富的区域, 在400倍视野下进行计数, 取其平均值[4].
1.2.3 Western blot: 称取组织100 mg, 按组织和细胞裂解液1∶10的比例加入全细胞裂解液, 于冰上匀浆器充分匀浆后15 000 r/min 4 ℃低温离心10 min, 取上清提取总蛋白. 用酶标仪592 nm波长, BCA法蛋白定量. 按每孔100 μg蛋白上样, 煮沸变性5 min后, 以12%聚丙烯酞胺凝胶电泳, 80 V电压浓缩胶至分离胶后改为180 V电压至分离胶底部, 后经湿转法300 mA 1.5 h电转移至NC膜, 5%脱脂奶粉室温封闭2 h, NC膜置于鼠抗人一抗稀释液(1∶1 000稀释)中4 ℃过夜, PBST及PBS洗膜10 min×4次, 再置于羊抗鼠二抗稀释液(1∶1 000稀释)中室温孵育2 h及PBS洗膜10 min×4次, 最后用DAB显色10-12 min, 直至膜上出现棕色条带, 显色适度时蒸馏水漂洗中止显色反应, 拍摄滤膜照片. 用Quantity One 4.31凝胶图像分析系统扫描灰度值, 取相应蛋白的灰度值与相应内参β-actin的比值, 代表相应蛋白的相对表达水平进行统计学分析.
统计学处理 应用SPSS13.0统计软件包进行多个独立样本非参数Kreskas-Wallis H检验和两独立样本非参数Mann-Whitney U检验.
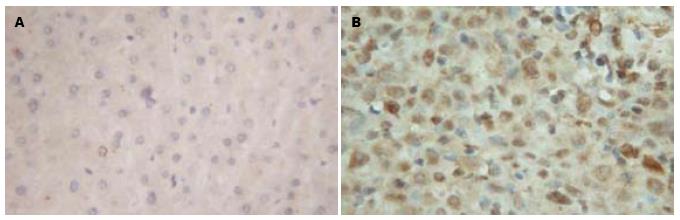
本研究96例标本肝癌肿瘤组织与癌旁肝组织的免疫组织化学检测结果显示, ANGPTL3阳性表达产物主要分布于细胞的胞质内, 在癌旁肝组织中ANGPTL3表达率为32.29%; 而在肝癌肿瘤组织中表达为62.50%. 肿瘤组织ANGPTL3阳性率远高于癌旁组织, 有显著性差异(P<0.05, 图1, 表1).
| 分组 | ANGPTL3蛋白表达(n) | 阳性率(%) | P值 | |
| - | + | |||
| 癌旁组织 | 65 | 31 | 32.29 | |
| 肿瘤组织 | 36 | 60 | 62.50 | 0.032 |
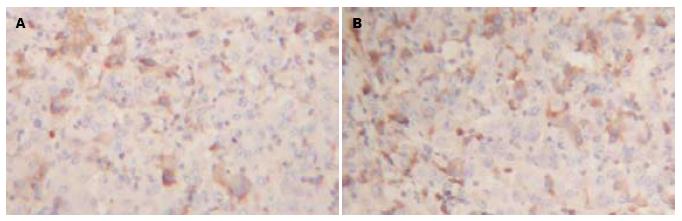
本研究96例标本肝癌肿瘤组织与癌旁肝组织的免疫组织化学检测结果显示, 血管内皮生长因子(vascular endothelial growth factor, VEGF)阳性表达产物主要分布于细胞的胞质内, 在癌旁肝组织中VEGF表达率为29.17%; 而在肝癌肿瘤组织中表达为81.25%. 肿瘤组织VEGF阳性率远高于癌旁组织, 有显著性差异(P<0.05, 图2, 表2).
| 分组 | VEGF蛋白表达(n) | 阳性率(%) | P值 | |
| - | + | |||
| 癌旁组织 | 68 | 28 | 29.17 | |
| 肿瘤组织 | 18 | 78 | 81.25 | 0.022 |
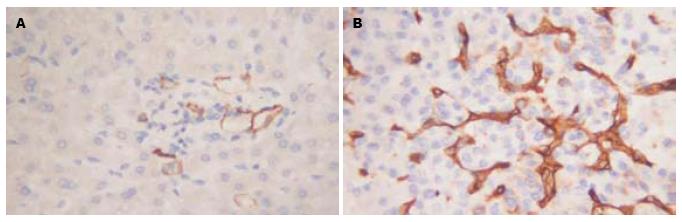
肿瘤组织免疫组织化学染色结果, 微血管密度为56-183(平均104.2±56.7), 以均数104.2为界, 将他们分为多血管组(微血管密度>104.2)和少血管组(微血管密度<104.2). 结果显示, 肿瘤的新生血管生成和ANGPTL3在肿瘤组织中高表达相关(图3, 表3).
| 分组 | 多血管组(n) | 少血管组(n) | 阳性率(%) | P值 |
| 癌旁组织 | 20 | 76 | 31.25 | |
| 肿瘤组织 | 65 | 31 | 67.71 | 0.026 |
统计学分析各病理因素与ANGPTL3的关系, 结果显示ANGPTL3的阳性表达和淋巴结转移及TNM分期相关(P<0.05), 而与组织学分级、肿瘤体积、浸润深度、远处转移、AFP等临床病理因素无相关性(P>0.05, 表4).
| 临床病理因素 | n | +(n) | -(n) | 阳性率(%) | P值 |
| 年龄 | |||||
| ≤60 | 64 | 38 | 26 | 59.4 | 0.206 |
| >60 | 32 | 22 | 10 | 68.7 | |
| 性别 | |||||
| 男 | 64 | 42 | 22 | 65.6 | 0.527 |
| 女 | 32 | 18 | 14 | 56.2 | |
| 组织学分级 | |||||
| Ⅰ | 14 | 8 | 6 | 57.1 | 0.623 |
| Ⅱ | 46 | 32 | 14 | 69.6 | |
| Ⅲ | 36 | 20 | 16 | 55.6 | |
| 肿瘤体积 | |||||
| T≤5 cm | 50 | 28 | 22 | 56.0 | 0.505 |
| 5 cm<T≤10 cm | 28 | 18 | 10 | 64.3 | |
| T≥10 cm | 18 | 14 | 4 | 77.8 | |
| 浸润深度 | |||||
| pT1 | 8 | 4 | 4 | 50.0 | 0.254 |
| pT2 | 28 | 14 | 14 | 50.0 | |
| pT3 | 60 | 42 | 18 | 70.0 | |
| 淋巴结转移 | |||||
| - | 28 | 8 | 20 | 28.6 | 0.003 |
| + | 68 | 52 | 16 | 76.5 | |
| 远处转移 | |||||
| - | 66 | 38 | 28 | 57.6 | 0.296 |
| + | 30 | 22 | 8 | 73.3 | |
| TNM分期 | |||||
| Ⅰ+Ⅱ | 28 | 10 | 18 | 35.7 | 0.031 |
| Ⅲ | 38 | 26 | 12 | 68.4 | |
| Ⅳ | 30 | 24 | 6 | 80.0 | |
| AFP | 96 | ||||
| ≤400 kU/L | 38 | 24 | 14 | 63.2 | 0.547 |
| >400 kU/L | 68 | 36 | 22 | 61.8 |
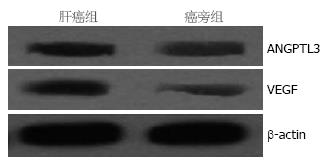
Western blot结果表明肝癌组织中ANGPTL3和VEGF表达均增加, 且表达呈正相关(P<0.05, 图4).
肝癌的发生、发展、转移与肿瘤新生血管有着密切的联系, 新生血管是肿瘤赖以生长和生存的物质基础, 是影响肿瘤生物学行为的重要因素之一. 肿瘤血管生成是指血管内皮细胞从现有的血管系统中分化、迁移而形成新的微血管的复杂生物学过程, 有多种生长因子、胞外基质成分、蛋白水解酶和细胞黏附分子参与此过程[5]. 恶性肿瘤发生侵袭和转移是肿瘤治疗失败的主要原因, 而肿瘤血管生成在其转移的起始及终末阶段发挥着重要作用. 血管新生和丰富的血流是肿瘤迅速生长和发生转移的病理基础和重要条件[6,7]. 故如何抑制早期血管生成、破坏肿瘤血管已经成为肿瘤治疗研究的热点和突破口. 有研究表明[8,9], 对肿瘤组织中已经存在的血管和/或正在血管生成的肿瘤进行干预, 阻断诱导血管生成的通路, 能够有效地抑制肿瘤增殖和生长, 使其处于休眠状态. 近年来研究表明[10], 血管生成是包括HCC在内的许多实体瘤生长和转移的关键因素. 目前认为, 肿瘤组织微血管密度作为间接测量肿瘤血管生成的一项指标, 与多种肿瘤临床分期、病理分级、淋巴结转移, 以及患者预后有关[11].
ANGPTL3是一种分泌性蛋白因子即人ANGPTL3是由Ip31编码的460个氨基酸组成的多肽, 其蛋白结构由分泌信号肤、N-端螺旋形卷曲结构域和C-端FBN样区组成. 最先发现在发育的肝脏中特异的表达, 成人肝脏中也有少量持续表达. 和促血管生成素家族不同, ANGPTL3的FBN区和他们只有37%-39%的同源区, 故不能和Tic2受体结合, 但其FBN样区可以和整合素ανβ3结合. Camenisch等[2]研究发现ANGPTL3通过和内皮细胞表面整合素ανβ3结合, 导致内皮细胞黏附、迁移, 刺激整合素信号转导途径包括AKT, MAPK, FAK磷酸化. 已经发现整合素ανβ3不仅可以影响肿瘤细胞的增殖和迁移, 也和肿瘤血管的生成相关, 国外已有通过抑制其表达来治疗肿瘤的临床实验研究. 此外ανβ3还和肝星形细胞的增殖和凋亡相关, 因此也可能影响肝纤维化过程. 动物实验发现ANGPTL3和VEGF具有相似的促进鼠角膜血管生长活性. 可能和VEGF一样, ANGPTL3同样具有促进肿瘤新生血管形成, 从而诱发侵袭转移作用. 其中ANGPTL3和肿瘤新生血管形成的关系尚未见报道. 宋其同等[12,13]还发现, ANGPTL3 mRNA表达和肿瘤新生血管生成, 癌栓的形成和肿瘤分级相关, 而和肿瘤大小, 包膜的完整性无明显相关, 因此认为ANGPTL3在HCC的侵袭和转移中发挥重要作用, ANGPTL3可以促进肿瘤血管形成以及HCC的侵袭和转移; 可以通过ANGPTL3的表达强度判断HCC的预后, 设想通过调控ANGPTL3 的表达以控制血糖, 并抑制肿瘤血管生成, 从而达到延长肝癌患者生存时间的目的.
本研究结果显示, ANGPTL3在人肝癌组织、癌旁肝组织中均表达, 但在肝癌组织中表达明显高于癌旁组织. 同时发现肿瘤血管密度较高的肿瘤组织, 其ANGPTL3表达也较高. 研究表明ANGPTL3的表达与肿瘤血管生成呈正相关, 表明其可能在促进HCC的发生、发展及转移过程中起着重要作用.
原发性肝癌(PHC)早期缺乏典型的临床表现, 早期就可能就存在肝内转移, 导致术后的复发率居高不下. 此外肝癌患者多伴有肝炎、肝硬化背景, 容易造成严重的肝功能损害, 使得肝癌的生存率低下, 即使是根治性手术切除, 5年生存率仅为20%-30%.
徐泱, 副教授, 上海复旦大学附属中山医院肝肿瘤外科
血管新生和丰富的血流是肿瘤迅速生长和发生转移的病理基础和重要条件. 故如何抑制早期血管生成、破坏肿瘤血管已经成为肿瘤治疗研究的热点和突破口.
Camenisch等研究发现ANGPTL3通过和内皮细胞表面整合素ανβ3结合, 导致内皮细胞黏附、迁移, 刺激整合素信号转导途径包括AKT, MAPK, FAK磷酸化. 已经发现整合素ανβ3不仅可以影响肿瘤细胞的增殖和迁移, 也和肿瘤血管的生成相关.
ANGPTL3的表达与肿瘤血管生成呈正相关, 表明其可能在促进HCC的发生、发展及转移过程中起着重要作用.
本文创新性一般, 对于肝癌的基础及临床研究具有一定的参考价值.
编辑 曹丽鸥 电编 何基才
| 1. | Guruvayoorappan C. Tumor versus tumor-associated macrophages: how hot is the link? Integr Cancer Ther. 2008;7:90-95. [PubMed] [DOI] |
| 2. | Camenisch G, Pisabarro MT, Sherman D, Kowalski J, Nagel M, Hass P, Xie MH, Gurney A, Bodary S, Liang XH. ANGPTL3 stimulates endothelial cell adhesion and migration via integrin alpha vbeta 3 and induces blood vessel formation in vivo. J Biol Chem. 2002;277:17281-17290. [PubMed] [DOI] |
| 3. | 卫 小红, 杜 凤兰, 王 鸿雁, 陆 婉玲. 血管内皮生长因子与转化生长因子β在非小细胞肺癌的表达及其相关性. 西安交通大学学报(医学版). 2003;24:43-46. |
| 4. | Vermeulen PB, Gasparini G, Fox SB, Toi M, Martin L, McCulloch P, Pezzella F, Viale G, Weidner N, Harris AL. Quantification of angiogenesis in solid human tumours: an international consensus on the methodology and criteria of evaluation. Eur J Cancer. 1996;32A:2474-2484. [PubMed] [DOI] |
| 5. | Yance DR, Sagar SM. Targeting angiogenesis with integrative cancer therapies. Integr Cancer Ther. 2006;5:9-29. [PubMed] [DOI] |
| 6. | Purushothaman A, Uyama T, Kobayashi F, Yamada S, Sugahara K, Rapraeger AC, Sanderson RD. Heparanase-enhanced shedding of syndecan-1 by myeloma cells promotes endothelial invasion and angiogenesis. Blood. 2010;115:2449-2457. [PubMed] [DOI] |
| 7. | Zheng K, Li HY, Su XL, Wang XY, Tian T, Li F, Ren GS. Chemokine receptor CXCR7 regulates the invasion, angiogenesis and tumor growth of human hepatocellular carcinoma cells. J Exp Clin Cancer Res. 2010;29:31. [PubMed] [DOI] |
| 8. | Chen JC, Uang BJ, Lyu PC, Chang JY, Liu KJ, Kuo CC, Hsieh HP, Wang HC, Cheng CS, Chang YH. Design and synthesis of alpha-ketoamides as cathepsin S inhibitors with potential applications against tumor invasion and angiogenesis. J Med Chem. 2010;53:4545-4549. [PubMed] [DOI] |
| 9. | Manikandan P, Murugan RS, Priyadarsini RV, Vinothini G, Nagini S. Eugenol induces apoptosis and inhibits invasion and angiogenesis in a rat model of gastric carcinogenesis induced by MNNG. Life Sci. 2010;86:936-941. [PubMed] [DOI] |
| 10. | Blagosklonny MV. Antiangiogenic therapy and tumor progression. Cancer Cell. 2004;5:13-17. [PubMed] [DOI] |