修回日期: 2010-08-16
接受日期: 2010-08-24
在线出版日期: 2010-11-18
目的: 研究磷酸化黏着斑激酶(focal adhesion kinase, FAK)和桩蛋白(Paxillin)在胃腺癌及正常组织中的表达及其临床意义.
方法: 应用免疫组织化学SP法分别检测P-FAK和Paxillin在85例胃腺癌及20例正常组织中的表达, 采用Spearman分析二者之间表达的相关性.
结果: P-FAK和Paxillin在胃腺癌组织中的表达明显高于正常组织(47% vs 5%; 70% vs 30%, 均P<0.05), 且与胃腺癌分化程度、浸润深度、淋巴结转移及临床分期有关(P<0.05), 与年龄和性别无关(P>0.05); 胃腺癌组织中P-FAK和Paxillin的表达升高, 呈协同关系(r = 0.505, P<0.05).
结论: P-FAK和Paxillin在胃腺癌的发生、发展、转移及预后中发挥重要作用, 可考虑作为胃腺癌临床评价肿瘤生物学行为及评估预后的指标.
引文著录: 李山林, 王进, 杨丽敏, 刘丽. 磷酸化FAK、Paxillin在胃腺癌中的表达及其意义. 世界华人消化杂志 2010; 18(32): 3467-3470
Revised: August 16, 2010
Accepted: August 24, 2010
Published online: November 18, 2010
AIM: To investigate the expression of phosphorylated focal adhesion kinase (p-FAK) and paxillin in gastric adenocarcinoma and to analyze their clinical significance.
METHODS: Immunohistochemistry was used to detect the expression of p-FAK and paxillin in 85 gastric adenocarcinoma specimens and 20 normal gastric specimens.
RESULTS: The positive rates of both p-FAK and paxillin expression in gastric carcinoma were significantly higher than those in normal gastric tissue (47% vs 5%; 70% vs 30%, both P < 0.05). Both p-FAK and paxillin expression was related to tumor differentiation, invasion depth, lymph node metastasis and clinical stage (all P < 0.05), but not to age and gender (both P > 0.05). A positive correlation was also noted between the expression of p-FAK and paxillin in gastric carcinoma (r = 0.505, P < 0.05).
CONCLUSION: P-FAK and paxillin play significant roles in the development and progression of gastric adenocarcinoma. Expression of p-FAK and paxillin can be used as useful parameters for clinical assessment of tumor biological behavior and prognosis in patients with gastric adenocarcinoma.
- Citation: Li SL, Wang J, Yang LM, Liu L. Significance of expression of p-FAK and paxillin in gastric adenocarcinoma. Shijie Huaren Xiaohua Zazhi 2010; 18(32): 3467-3470
- URL: https://www.wjgnet.com/1009-3079/full/v18/i32/3467.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i32.3467
胃癌是在世界范围内最常见的恶性肿瘤之一, 我国每年新发胃癌患者约40万例. 因此研究胃癌细胞的发生、发展、黏附、迁移的分子学机制, 用来指导临床显得极为重要. 最近发现磷酸化黏着斑激酶(phosphorylated focal adhesion kinase, P-FAK)和桩蛋白(Paxillin)在胃腺癌、胰腺癌、结肠癌等恶性肿瘤的增殖、浸润和转移过程中发挥着极其重要的作用[1]. 目前, P-FAK和Paxillin在胃腺癌中表达的研究国内尚无报道, 本文采用免疫组织化学SP法检测P-FAK和Paxillin在胃腺癌及正常组织的表达, 观察其与临床病理参数的关系, 旨在探讨其与胃腺癌细胞的发生、浸润和转移的相关性.
收集郑州大学第一附属医院病理科2008-01/2009-12经病理证实为胃腺癌的手术切除标本85例, 患者术前均未接受化学、放射治疗及免疫治疗. 其中男63例、女22例, 中位年龄55.5岁. TNM分期: Ⅰ期15例, Ⅱ期20例, Ⅲ期22例, Ⅳ期28例; 病理分型: 高分化腺癌10例, 中分化腺癌40例, 低分化腺癌35例; 浸润深度未超过浆膜层者40例, 超过浆膜层者45例; 伴淋巴结转移者50例, 不伴淋巴结转移者35例; 同期手术标本20例正常胃组织作为对照组. P-FAK(Y397)多克隆抗体来自Bioworld科技股份有限公司; 鼠抗人Paxillin单克隆抗体购自美国纽马克有限公司; 即用型SP试剂盒、DAB显色试剂盒及EDTA抗原修复液均购自北京中杉金桥有限公司.
1.2.1 P-FAK和Paxillin的检测: 严格按免疫组织化学SP说明书操作, 以已知P-FAK(Y397)、Paxillin阳性胃腺癌组织切片作阳性对照, 以PBS代替一抗作为阴性对照. Paxillin, P-FAK(Y397)一抗工作浓度均为1∶50.
1.2.2 结果判定: (1)Paxillin染色阳性信号定位于细胞质或细胞膜上, 高倍镜下随机观察5个视野, 每个视野计数200个细胞, 共计1 000个, 以细胞无棕黄色或与背景一致的浅棕黄色为阴性细胞, 细胞中出现明显棕黄色颗粒为阳性细胞. 计算每张切片阳性细胞百分率, 根据Speiser[2]的判定标准: 切片中阳性细胞数<10%为阴性片, ≥10%为阳性片. (2)P-FAK免疫组织化学阳性产物呈棕黄色细颗粒状, 定位于细胞质内, 局限性表达于肿瘤浸润面. 参照文献[3]进行判定: 计数500个细胞, 按照染色强度计分, 0分为无色, 1分为淡黄色, 2分为棕黄色, 3分为棕褐色. 按阳性细胞所占百分比计分: 0分为无阳性细胞, 1分为阳性细胞≤10%, 2分为阳性细胞12%-50%, 3分为阳性细胞51%-75%, 4分为阳性细胞>75%. 染色强度与阳性细胞计分乘积0-2分计为(-), 3-5分计为(+), 6-9分计为(++), 10-12分计为(+++).
统计学处理 数据采用SPSS13.0软件进行分析处理, 组间比较采用χ2检验, 各指标间的相关性研究采用Spearman相关性分析, 检验水准为α = 0.05.
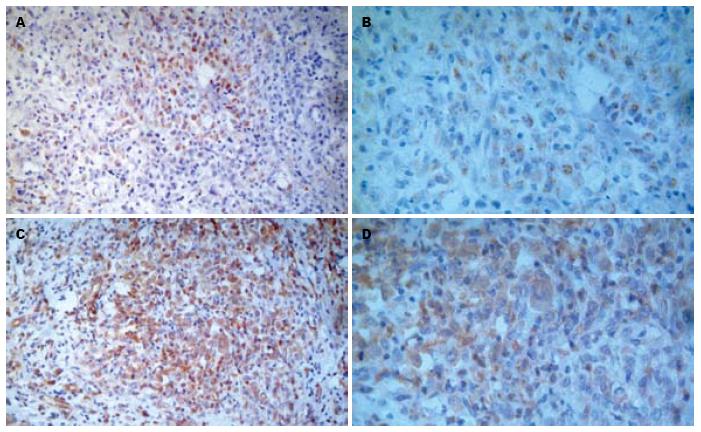
胃腺癌及正常组织中P-FAK阳性率分别为47%(40/85)、5%(1/20), Paxillin阳性率分别为70%(60/85)、30%(6/20). 其中P-FAK和Paxillin共阳性的胃癌组织有38例; 单纯P-FAK阳性的胃癌组织2例; 单纯Paxillin阳性的胃癌有22例(图1).
胃腺癌组织中P-FAK和Paxillin的表达与癌组织的分化程度、浸润深度、临床分级、淋巴结转移有关(P<0.05), 与性别、年龄无关(P>0.05, 表1).
| 临床病理参数 | n | Paxillin阳性n(%) | χ2值 | P值 | P-FAK阳性n(%) | χ2值 | P值 |
| 性别 | |||||||
| 男 | 63 | 45(71) | 0.083 | >0.05 | 33(52) | 2.767 | >0.05 |
| 女 | 22 | 15(68) | 7(31) | ||||
| 年龄(岁) | |||||||
| ≥55 | 51 | 35(68) | 0.236 | >0.05 | 22(43) | 0.787 | >0.05 |
| ≤55 | 34 | 25(73) | 18(52) | ||||
| 组织学分级 | |||||||
| 高、中分化 | 50 | 40(80) | 5.181 | <0.05 | 15(30) | 14.184 | <0.05 |
| 低分化 | 35 | 20(57) | 25(71) | ||||
| 浸润深度 | |||||||
| 未超浆膜层 | 40 | 20(50) | 15.426 | <0.05 | 11(27) | 11.602 | <0.05 |
| 超过浆膜层 | 45 | 40(88) | 29(64) | ||||
| 淋巴结转移 | |||||||
| 有 | 50 | 45(90) | 22.039 | <0.05 | 32(64) | 13.989 | <0.05 |
| 无 | 35 | 15(42) | 8(22) | ||||
| TNM分级 | |||||||
| Ⅰ-Ⅱ | 35 | 20(76) | 5.181 | <0.05 | 10(53) | 8.163 | <0.05 |
| Ⅲ-Ⅳ | 50 | 40(50) | 30(25) |
Spearman相关性分析显示胃腺癌组织中P-FAK和Paxillin的表达呈正相关(r = 0.505, P<0.05).
FAK的N-末端和催化部位相连处为Tyr397, 是自身磷酸化和Tyr磷酸化的主要位点[4], Tyr397自身磷酸化后形成了高亲和力的Src的SH2结构域结合位点[5], 即激活的FAK与Src的SH2结合, 消除了自体抑制而使Src激活, 活化的Src催化FAK其他磷酸化位点化活化, 使FAK完全活化[6], 接着通过复杂的信号传递, 激活Ras蛋白, 后者活化丝裂原活化蛋白激酶(mitogen activited protein kinase, MAPK)[7], 进而引起级联反应, 参与细胞的增殖与迁移等. P-FAK也可以与癌基因p130cas结合形成p130cas/Crk, 而p130cas/Crk复合物的激活是生长因子引起细胞迁移的主要特征; 同时P-FAK可以结合并活化PI-3K, 而PI-3K可以促使细胞膜上整联蛋白与配体的亲和力增强, 进一步增强细胞的迁移能力, 因此P-FAK活性在一定程度上决定细胞的迁移能力[8,9]. 总之, P-FAK通过Paxillin及PI-3K等与信号转导有关的分子, 激活多条信号转导通路, 启动下游重要事件发生, 从而参与肿瘤细胞的增殖、黏附及迁移. 本试验发现, 在胃腺癌组织中P-FAK的阳性表达率明显高于正常组织, 并随肿瘤分化程度的降低、浸润度的加深、淋巴结转移及临床分期的增高而增高, 与相关文献[10]报道相符, 提示P-FAK在促进胃腺癌的发生、发展、浸润和转移过程中起着重要作用, 而且可能为判断胃腺癌的恶性程度提供依据.
Paxillin是细胞骨架上的一种磷酸蛋白, 定位于人染色体12q24, 相对分子质量为68 000 Da[11], 是迄今发现的唯一能与癌基因结合的含Tyr的黏附调节蛋白[12], 含5个LD模体和4个LIM结构域[13](其中第3个是Paxillin结合到FAK的关键结构), 其中LD模体所含的丰富的亮氨酸易形成疏水性界面, 提供与其他蛋白相互结合的平台, 从而成为FAK的结合位点. Paxillin的上述结构加上其分子中散在的Tyr、丝氨酸和苏氨酸磷酸化位点使其在参与黏着斑的组装、细胞黏附和迁移过程中发挥重要作用. Paxillin的基序可与多种致瘤性蛋白结合, 形成特异的信号分子复合物, 将信号向下游传递, 扰乱甚至误导正常黏附和控制细胞增殖所需的生长因子信号级联, 并使组织中细胞骨架效应发生改变, 这种改变是肿瘤转移的重要分子机制之一[5]. 研究发现[14], Paxillin介导细胞外基质和细胞骨架之间的黏附, 与之结合的细胞骨架蛋白与损伤修复、细胞迁移、肿瘤转移有关, 而癌的浸润和转移与细胞的黏附力、移动力的改变直接相关, 因此, Paxillin与肿瘤的浸润和转移密切相关. 本研究显示Paxillin在低分化胃腺癌组织中表达显著高于高、中分化腺癌, 表明Paxillin与胃腺癌的分化程度有关; Paxillin在伴有淋巴结转移的胃腺癌组中表达的阳性率显著高于不伴有淋巴结转移者, 表明Paxillin可能对胃腺癌细胞的移动起促进作用, 这与田素芳等[15]研究结果一致.
本研究发现, P-FAK和Paxillin在胃腺癌组织中的表达呈正相关, 提示P-FAK的表达可能促进了Paxillin参与的胃腺癌的发生、发展、侵袭、转移等生物学行为, 因此, P-FAK和Paxillin可考虑作为判断胃腺癌生物学行为、预测肿瘤发展趋势的生物标志, 从而为临床提供依据.
胃癌是世界范围内最常见的恶性肿瘤之一, 其恶性程度高、病变进展快. 因而, 需要有更好的检测手段来评价胃腺癌的生物学行为及其预后, 指导治疗.
张锦生, 教授, 复旦大学上海医学院病理学系
目前关于胃腺癌的发生、发展及转移变化备受关注, 也是胃癌研究领域的热点, 有关P-FAK和Paxillin具体发展机制有待于进一步阐明.
杨红军等研究发现, Paxillin介导细胞外基质和细胞骨架之间的黏附, 与之结合的细胞骨架蛋白与损伤修复、细胞迁移、肿瘤转移有关, 而癌的浸润和转移与细胞的黏附力、移动力的改变直接相关, 因此, Paxillin与肿瘤的浸润和转移密切相关.
本文研究P-FAK和Paxillin在胃腺癌中的表达, 结果显示, 二者在胃腺癌的生长及转移过程中起了重要作用, 联合检测可用于评价胃腺癌的预后, 指导治疗.
本文选题恰当, 有一定的新意, 具有较好的学术意义和潜在的临床应用价值.
编辑 曹丽鸥 电编 何基才
| 1. | Pelagalli A, Scibelli A, Lombardi P, d'Angelo D, Tortora G, Staiano N, Avallone L. Expression of the focal adhesion protein paxillin in normal and breast cancer tissues. Vet Res Commun. 2003;27 Suppl 1:343-346. [PubMed] [DOI] |
| 5. | Siesser PM, Meenderink LM, Ryzhova L, Michael KE, Dumbauld DW, García AJ, Kaverina I, Hanks SK. A FAK/Src chimera with gain-of-function properties promotes formation of large peripheral adhesions associated with dynamic actin assembly. Cell Motil Cytoskeleton. 2008;65:25-39. [PubMed] [DOI] |
| 6. | Razandi M, Pedram A, Park ST, Levin ER. Proximal events in signaling by plasma membrane estrogen receptors. J Biol Chem. 2003;278:2701-2712. [PubMed] [DOI] |
| 7. | 苏 荣健, 李 贞, 李 宏丹, 宋 慧娟, 程 留芳. 肝细胞生长因子对肝细胞癌细胞系SMMC-7721黏着斑激酶的影响. 世界华人消化杂志. 2009;17:2070-2073. [DOI] |
| 8. | Cary LA, Chang JF, Guan JL. Stimulation of cell migration by overexpression of focal adhesion kinase and its association with Src and Fyn. J Cell Sci. 1996;109:1787-1794. [PubMed] |
| 9. | Brakebusch C, Bouvard D, Stanchi F, Sakai T, Fässler R. Integrins in invasive growth. J Clin Invest. 2002;109:999-1006. [PubMed] |
| 10. | Giaginis CT, Vgenopoulou S, Tsourouflis GS, Politi EN, Kouraklis GP, Theocharis SE. Expression and clinical significance of focal adhesion kinase in the two distinct histological types, intestinal and diffuse, of human gastric adenocarcinoma. Pathol Oncol Res. 2009;15:173-181. [PubMed] [DOI] |
| 13. | Brown MC, Turner CE. Paxillin: adapting to change. Physiol Rev. 2004;84:1315-1339. [PubMed] [DOI] |