修回日期: 2010-09-07
接受日期: 2010-09-13
在线出版日期: 2010-11-18
目的: 探讨肿瘤坏死因子α(TNF-α)对肝细胞株LO2细胞线粒体融合蛋白基因2(Mfn2)基因表达的调节作用以及对线粒体形态和细胞三磷酸腺苷(ATP)、活性氧(ROS)生成的影响.
方法: 利用脂质体Lipofectamine 2000将Mfn2基因荧光表达载体(pEGFP-Mfn2)转染肝细胞株LO2细胞, 以终浓度为500 kU/L的TNF-α作用LO2细胞株和稳定高表达Mfn2的LO2细胞株12 h, 逆转录-聚合酶链反应(RT-PCR)和Western blot检测各组细胞Mfn2 mRNA转录水平以及蛋白的表达水平, 线粒体绿色荧光探针(Mito-Tracker Green)染色观察线粒体形态变化, 荧光素酶ADP/ATP发光法检测各组细胞ATP含量, 荧光探针DCFH-DA测定细胞ROS生成水平.
结果: 经TNF-α处理后LO2细胞中Mfn2基因的mRNA及蛋白表达水平显著低于空白对照组(0.279±0.026 vs 0.742±0.018; 0.196±0.024 vs 0.580±0.011, P<0.05); 对照组及转染Mfn2基因组肝细胞线粒体形态主要为丝状网络或长柱状, TNF-α处理后未转染肝细胞线粒体断裂成点状碎片, 但转染组线粒体形态则无明显改变; TNF-α处理后LO2细胞内ATP浓度显著下降(2.00 µmol/g±0.15 µmol/g vs 5.81 µmol/g±0.31 µmol/g, P<0.05), 而ROS生成水平较空白对照组显著升高(FI: 80.68±4.02 vs 65.44±3.47, P<0.05), 但转染组细胞内ATP下降水平要显著低于未转染组, 而未转染组ROS升高程度则显著高于转染组(P<0.05).
结论: TNF-α通过抑制肝细胞Mfn2的表达诱导线粒体形态改变及线粒体功能障碍.
引文著录: 张勇, 江隆昌, 胡文君, 胡青钢, 郑启昌. TNF-α对人肝细胞Mfn2基因表达的调节及对线粒体形态功能的影响. 世界华人消化杂志 2010; 18(32): 3452-3456
Revised: September 7, 2010
Accepted: September 13, 2010
Published online: November 18, 2010
AIM: To investigate the influence of treatment with tumor necrosis factor-alpha (TNF-α) on the expression of mitofusin 2 (Mfn2) and mitochondrial morphology and function in hepatic LO2 cells.
METHODS: After pEGFP-Mfn2 plasmid was transfected into LO2 cells with Lipofectamine 2000, transfected LO2 cells were incubated with TNF-α for 12 h. The expression of Mfn2 mRNA and protein was detected by reverse transcriptase-polymerase chain reaction (RT-PCR) and Western blot, respectively. MitoTracker Mitochondrion-Selective Probes were used to detect the changes in mitochondrial morphology. ATP synthesis and reactive oxygen species (ROS) production were measured to assess mitochondrial function.
RESULTS: RT-PCR and Western blot analyses showed that Mfn2 was highly expressed in LO2 cells. After treatment of LO2 cells with TNF-α, Mfn2 expression was significantly suppressed (0.279 ± 0.026 vs 0.742 ± 0.018; 0.196 ± 0.024 vs 0.580 ± 0.011, P < 0.05), ATP level decreased (2.00 µmol/g ± 0.15 µmol/g vs 5.81 µmol/g ± 0.31 µmol/g, P < 0.05), ROS production increased (80.68 ± 4.02 vs 65.44 ± 3.47, P < 0.05), and the normal tubular network of mitochondria was fragmented into short rods or spheres when compared to control cells. In contrast, these changes were not significant in Mfn2-transfected LO2 cells.
CONCLUSION: TNF-α treatment may alter mitochondrial morphology and impair mitochondrial function by decreasing the expression of Mfn2 in hepatic LO2 cells.
- Citation: Zhang Y, Jiang LC, Hu WJ, Hu QG, Zheng QC. TNF-α treatment alters Mfn2 expression and mitochondrial morphology and function in hepatic LO2 cells. Shijie Huaren Xiaohua Zazhi 2010; 18(32): 3452-3456
- URL: https://www.wjgnet.com/1009-3079/full/v18/i32/3452.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i32.3452
肿瘤坏死因子α(tumor necrosis factor α, TNF-α)是病毒性肝炎[1]、酒精性及非酒精性脂肪肝病[2,3]、缺血再灌注损伤[4]等损伤性病变时肝细胞损伤的主要细胞因子. 研究发现TNF-α能引起细胞线粒体损伤, 抑制线粒体的呼吸功能并增加线粒体活性氧(reactive oxygen species, ROS)和过氧化脂质的形成[5,6], 但具体分子机制并不十分清楚. 线粒体融合蛋白基因2(mitofusin-2 gene, Mfn2)能促进线粒体的融合, 与线粒体形态、结构和功能有着密切联系[7]. TNF-α是否影响Mfn2基因的表达尚未见报道, 我们通过体外实验, 探讨TNF-α对人肝细胞Mfn2基因表达的调节作用以及对线粒体形态和功能的影响.
绿色荧光蛋白-Mfn2基因表达载体(pEGFP-Mfn2)由本实验室构建并保存, 肝细胞株LO2细胞购自武汉大学中国典型培养物保藏中心; TRIzol RNA抽提试剂、RT-PCR试剂盒、RPMI 1640培养基、新生牛血清等购自美国Gibco公司; TNF-α购自Invitrogen公司; Western blot化学发光试剂、硝酸纤维素膜、Mfn2单克隆抗体购自美国Sigma公司; BCA蛋白定量试剂、荧光素酶ADP/ATP发光检测试剂盒、7'-二氯荧光黄双乙酸酯(DCFH-DA)荧光探针、ROS测定试剂盒购自美国Biomiga公司; 活体组织ROS初级荧光测定试剂盒购自GENMED公司; Mfn2引物由上海生物工程公司合成: 5'-ATGCATCCCCACTTAAGCAC-3', 5'-CCAGAGGGCAGAACTTTGTC-3', 内参GAPDH由ToYoBo公司试剂盒提供.
1.2.1 细胞培养及pEGFP-Mfn2转染: 将人肝癌细胞株LO2细胞转入含100 mL/L血清、100 kU/L青霉素、100 mg/L链霉素的RPMI 1640培养液中培养, 3 d传代1次. 取5×105个细胞/孔接种6孔培养板, 在培养箱中过夜培养至铺满孔底面积80%以上, 采用脂质体介导方法转染pEGFP-Mfn2, 转染方法参照说明书. 每孔加入3 µL脂质体包裹的siRNA(终浓度为10 nmol/L), 每孔最终体积是1 mL. 40 h后更换含血清培养基进行分析.
1.2.2 TNF-α处理细胞: 将细胞分为TNF-α组、TNF-α+Mfn2转染组、Mfn2转染组和空白对照组, 每组细胞取5×105个细胞/孔接种6孔培养板, 在培养箱中过夜培养至铺满孔底面积80%以上, 前两组分别加入含TNF-α(400 kU/L)的新鲜培养液作用12 h, 然后收集细胞检测, 每组均设4个重复.
1.2.3 Mfn2基因RT-PCR分析: 将约1×106细胞用TRIzol试剂提取各组细胞总RNA, 使用紫外分光光度计调整RNA浓度为1 g/L. 在9 µL无RNA酶水中加入1 µg RNA, Oligo(dT)20 1 µL, 温度65 ℃, 10 min后立即置于冰上. 加入5×RT Buffer 4 µL, dNTP mixture(各10 mmol/L)2 µL, RNase inhibitor(10 U/µL)1 µL, ReverTra Ace 1 µL. 反应条件: 42 ℃ 20 min, 85 ℃ 5 min, 4 ℃ 5 min. 瞬间离心后置-20 ℃保存. 在25 µL PCR体系中加入Cdc42上下游引物各1 µL, Taq DNA聚合酶1 µL, 循环条件: 94 ℃ 1 min预变性, 94 ℃ 30 s, 58 ℃(GAPDH为55 ℃)30 s, 72 ℃ 30 s共35个循环, 72 ℃延伸1 min. PCR产物25 µL琼脂糖凝胶电泳, 50 V, 30-45 min后照相.
1.2.4 各组细胞Mfn2 Western blot定量分析: 将约1×106细胞加60 µL去污剂裂解液进行匀浆. 置于冰上30 min, 4 ℃下12 000 r/min离心5 min, 取上清液即为总蛋白抽提物. BCA试剂盒测定蛋白浓度, 蛋白样品(每泳道60 µg)及蛋白分子量标准进行120 g/L SDS-PAGE电泳, 再将蛋白质点转移到纤维素(NC)膜上, 置于含50 g/L脱脂奶粉的TBST(50 mmol/L Tris-HCL, pH7.6; 150 mmol/L NaCl; 0.1% Tween20)中4 ℃过夜; 加入以TBST稀释的抗Mfn2单克隆抗体(1∶200, V/V, 兔抗鼠)和抗GAPDH抗体(1∶500, V/V, 兔抗鼠)后4 ℃过夜; 次日加入辣根过氧化物酶标记二抗(1∶2 000, V/V, 羊抗兔IgG), 37 ℃摇床下杂交1 h, 洗膜后用ECL试剂盒检测, X光胶片曝光、照相. 图像运用Quantitive one软件进行分析.
1.2.5 线粒体绿色荧光探针染色观察线粒体形态变化: 收集各组细胞用PBS洗涤细胞2次, PBS配制的3.7%甲醛溶液室温固定细胞10 min. 含0.1% Triton X-100的PBS洗涤2-4次, 每次约5 min, 免疫荧光染色二抗稀释液(P0108)按照1∶200的比例稀释绿色荧光探针(Mito-Tracker Green), 把Mito-Tracker Green染色工作液按照每个片子约200 μL的比例滴加到片子上, 室温避光孵育20-60 min. 用免疫染色洗涤液洗2-4次, 每次约5 min, 后用荧光显微镜进行观察.
1.2.6 LO2细胞荧光素酶ADP/ATP发光检测: 取1×106细胞, 加入1 mL裂解液后匀浆. 4 ℃ 12 000 r/min离心10 min, 保留上清. 冰浴上溶解待用试剂, ATP标准溶液稀释成0.001﹑0.01﹑0.1、10和1 μmol/L 5个浓度. 按照1∶100的比例用ATP检测试剂稀释液稀释ATP检测试剂. 在检测孔或检测管内加上10 μL样品或标准品, 迅速混匀, 间隔6 s后立即用液闪仪测定相对光单位(relative light unit, RLU)值. 根据标准曲线计算出样品中ATP的浓度, 每组均设4个重复. 各组组织蛋白定量, 把ATP的浓度换算成μmol/g蛋白的形式.
1.2.7 LO2细胞荧光探针DCFH-DA测定ROS: 使用活体组织ROS初级荧光测定试剂盒, 试剂B置于冰槽融化, 试剂C 37 ℃恒温水浴预热. 取10 μL试剂B及990 μL试剂C于1.5 mL离心管中, 置入暗室. 取1×106细胞消化离心后加入5 mL预冷的试剂C置入15 mL锥形离心管, 震荡5 s. 移取5 μL细胞裂解液进行蛋白定量检测. 移取50 μL细胞裂解液或50 μL试剂C(背景对照)到1 mL石英比色杯中, 加入950 μL GENMED染色工作液, 37 ℃恒温水浴20 min, 避免光照. 荧光分光光度仪检测: 激发波长490 nm, 散发波长520 nm. 样品RFU-对照RFU = 实际RFU, 其增加表明ROS含量升高, 每组均设4个重复.
统计学处理 全部资料用SPSS10.0软件进行统计分析, 计量资料用mean±SD表示, 各组及组间比较用t检验.
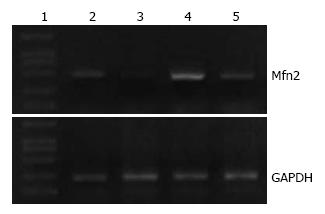
TNF-α处理LO2细胞后Mfn2基因条带灰度值显著低于空白对照组细胞条带灰度值, 两组转录水平有显著差异(0.279±0.026 vs 0.742±0.018, n = 4, P<0.05), pEGFP-Mfn2转染组细胞中条带灰度值显著高于空白对照组(1.209±0.021 vs 0.742±0.018, n = 4, P<0.05), TNF-α处理转染组细胞后, Mfn2表达较处理前下降(0.911±0.020), 但仍高于其他各组(n = 4, 均P<0.05, 图1).
转染pEGFP-Mfn2质粒后Mfn2蛋白的表达水平显著增高(0.813±0.027 vs 0.580±0.011, n = 4, P<0.05), 经TNF-α处理LO2细胞后Mfn2蛋白表达显著下降(0.196±0.024 vs 0.580±0.011, n = 4, P<0.05), 而转染组细胞蛋白表达较空白对照组无明显差异(n = 4, P>0.05, 图2).
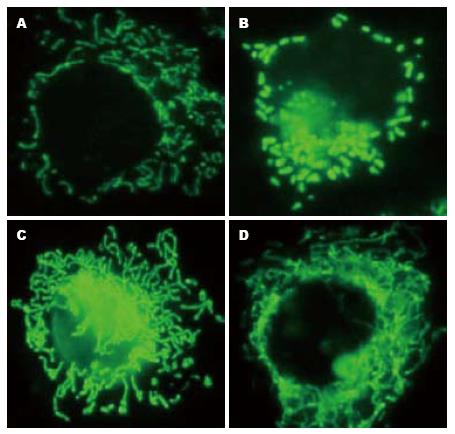
荧光显微镜观察发现空白对照组细胞线粒体成长柱状或网状, TNF-α处理细胞后线粒体破坏成短棒状或者点状, pEGFP-Mfn2质粒后线粒体主要为网状, 转染组细胞经TNF-α处理后线粒体改变并不显著(图3).
ATP标准荧光发光曲线以6 s发光强度积分值的对数为纵坐标, ATP浓度的对数为横坐标, 按以下浓度配置ATP标准曲线测定液: 0.001、0.010、0.100、1.000、10.000 μmol/g. 经线性回归分析后所得标准曲线为: Y = 0.703X+8.699, R2 = 0.9874.
TNF-α处理后LO2细胞内ATP浓度显著下降(P<0.05), 而ROS生成水平则显著升高(P<0.05); 转染pEGFP-Mfn2质粒后, 细胞内ATP浓度显著升高(P<0.05), 而ROS生成水平较前均显著下降 (P<0.05), TNF-α处理转染组细胞后ATP下降水平要显著低于未转染组, 而未转染组ROS升高程度则显著高于转染组(P<0.05, 表1).
TNF-α是一种具有广泛生物学功能的多肽类细胞因子, 参与内毒素性休克、炎症、免疫调节、细胞增生、细胞毒活性和抗病毒等过程. 肝脏细胞表面含有丰富的TNF-α受体, 是其作用的主要靶器官. 在各种肝脏损伤性疾病损伤过程中, TNF-α作为炎症反应的始发细胞因子, 其作用越来越引起人们的关注[8]. TNF-α参与肝损伤的病理过程途径主要有两种: 一种为细胞外途径, 由肝细胞表面的受体介导; 另一种为细胞内途径, 主要由线粒体损伤介导, 但具体分子机制并不清楚.
肝脏是体内最大的代谢器官, 线粒体是肝细胞代谢的核心. 线粒体是高度动态的细胞器, 他们在细胞内彼此连接呈三位网络状. 同时, 线粒体在细胞内发生着频繁的融合与分裂, 线粒体融合对线粒体正常功能的发挥具有非常重要的作用. Mfn2是我国学者陈光慧利用差异显示技术得到的一个新基因, 在哺乳动物中, Mfn2对于线粒体融合事件是必需的[9,10], 阻断Mfn2可导致葡萄糖氧化的减少、细胞呼吸、线粒体的基质渗漏和膜电位[11], Mfn2通过维持线粒体的网状结构影响线粒体的新陈代谢. 我们研究发现, TNF-α可以显著抑制肝细胞Mfn2基因的转录与表达, 并使LO2细胞线粒体从长管状或网状变成小球形或点状, 而高表达Mfn2可以逆转线粒体形态的破坏, 可见抑制Mfn2基因表达是TNF-α诱导肝细胞线粒体形态变化的重要途径之一.
线粒体的正常呼吸、生成ATP的功能对维持组织器官功能和细胞结构的完整至关重要. ATP含量决定了细胞对应激的反应能力, 如果其含量降低, 会导致细胞对应激的反应不足而引起肝细胞的严重损伤. 因此组织中ATP的水平与组织细胞功能状态及其生命力直接相关[12]. 而线粒体功能障碍导致的ROS产生增加在人类各种肝脏损伤性疾病中都能被观察到. 线粒体既是ROS形成的主要部位, 也是ROS攻击的首要靶点. ROS通过传递1个或2个电子, 氧化大分子物质, 引起DNA损害、蛋白质和脂质等氧化和再氧化损害[13]. 研究证实TNF-α能诱导各种类型细胞ROS的生成[14-16], 该过程具体机制并不十分清楚. 本实验结果显示, TNF-α能显著抑制肝细胞ATP生成水平并大量诱导ROS生成, 但转染Mfn2基因后能显著抑制这一过程, 说明TNF-α可通过抑制Mfn2基因导致线粒体功能损伤. Chen等[9]发现Mfn2表达缺失时细胞呼吸率下降, 进一步检测发现呼吸链中复合体Ⅰ、Ⅲ、Ⅳ的电子转移率下降. 这种变化将导致ATP生成减少, 细胞内能量障碍使还原性谷胱甘肽减少, 对ROS产物清除能力下降, 使ROS水平升高. 本实验结果说明Mfn2基因可能是TNF-α导致细胞ATP生成减少及ROS水平升高的关键因子.
总之, 通过实验我们发现TNF-α能显著下调肝细胞Mfn2的表达, 导致线粒体融合障碍及功能损伤, 而高表达Mfn2能抑制TNF-α对肝细胞线粒体的破坏作用. 该结果揭示了TNF-α介导线粒体损伤新的分子机制, 为治疗TNF-α所导致的肝脏损伤性疾病提供了新的药物治疗靶点, 但TNF-α是通过何种机制调控Mfn2基因表达尚有待深入研究.
肿瘤坏死因子α(TNF-α)是病毒性肝炎、酒精性及非酒精性脂肪肝病、缺血再灌注损伤等损伤性病变时肝细胞损伤的主要细胞因子. 研究发现TNF-α能引起细胞线粒体损伤, 抑制线粒体的呼吸功能并增加线粒体活性氧(ROS)和过氧化脂质的形成, 但具体分子机制并不十分清楚.
潘兴华, 副主任医师, 中国人民解放军成都军区昆明总医院病理实验科
线粒体是细胞内高度动态变化的细胞器, 其在细胞内不断运动、融合、分裂并形成动态平衡的网状结构. 线粒体形态对于细胞维持正常生理代谢和机体发育起着重要的作用, 一旦调控出现障碍会导致严重的疾病, 因此防止或修复线粒体损伤是目前的研究热点.
Chen等发现Mfn2表达缺失时细胞呼吸率下降, 进一步检测发现呼吸链中复合体Ⅰ、Ⅲ、Ⅳ的电子转移率下降.
本研究发现TNF-α能显著下调肝细胞Mfn2的表达, 导致线粒体融合障碍及功能损伤, 而高表达Mfn2能抑制TNF-α对肝细胞线粒体的破坏作用, 为治疗TNF-α所致的肝脏损伤性疾病提供了新的药物治疗靶点.
本文创新性较好, 具有一定的临床参考价值.
编辑 李军亮 电编 何基才
| 1. | Domm S, Cinatl J, Mrowietz U. The impact of treatment with tumour necrosis factor-alpha antagonists on the course of chronic viral infections: a review of the literature. Br J Dermatol. 2008;159:1217-1228. [PubMed] [DOI] |
| 2. | Auguet T, Vidal F, López-Dupla M, Broch M, Gutiérrez C, Olona M, Oltra C, Aguilar C, González E, Quer JC. A study on the TNF-alpha system in Caucasian Spanish patients with alcoholic liver disease. Drug Alcohol Depend. 2008;92:91-99. [PubMed] [DOI] |
| 3. | Polyzos SA, Kountouras J, Zavos C. Nonalcoholic fatty liver disease: the pathogenetic roles of insulin resistance and adipocytokines. Curr Mol Med. 2009;9:299-314. [PubMed] [DOI] |
| 4. | El-Ghoneimi A, Cursio R, Schmid-Alliana A, Tovey M, Lasfar A, Michiels JF, Rossi B, Gugenheim J. Pentoxifylline inhibits liver expression of tumor necrosis factor alpha mRNA following normothermic ischemia-reperfusion. HPB (Oxford). 2007;9:112-119. [PubMed] |
| 5. | Moe GW, Marin-Garcia J, Konig A, Goldenthal M, Lu X, Feng Q. In vivo TNF-alpha inhibition ameliorates cardiac mitochondrial dysfunction, oxidative stress, and apoptosis in experimental heart failure. Am J Physiol Heart Circ Physiol. 2004;287:H1813-H1820. [PubMed] [DOI] |
| 6. | Mariappan N, Soorappan RN, Haque M, Sriramula S, Francis J. TNF-alpha-induced mitochondrial oxidative stress and cardiac dysfunction: restoration by superoxide dismutase mimetic Tempol. Am J Physiol Heart Circ Physiol. 2007;293:H2726-H2737. [PubMed] [DOI] |
| 7. | Honda S, Aihara T, Hontani M, Okubo K, Hirose S. Mutational analysis of action of mitochondrial fusion factor mitofusin-2. J Cell Sci. 2005;118:3153-3161. [PubMed] [DOI] |
| 8. | Ding WX, Yin XM. Dissection of the multiple mechanisms of TNF-alpha-induced apoptosis in liver injury. J Cell Mol Med. 2004;8:445-454. [PubMed] [DOI] |
| 9. | Chen H, Detmer SA, Ewald AJ, Griffin EE, Fraser SE, Chan DC. Mitofusins Mfn1 and Mfn2 coordinately regulate mitochondrial fusion and are essential for embryonic development. J Cell Biol. 2003;160:189-200. [PubMed] [DOI] |
| 10. | Chen H, Chomyn A, Chan DC. Disruption of fusion results in mitochondrial heterogeneity and dysfunction. J Biol Chem. 2005;280:26185-26192. [PubMed] [DOI] |
| 11. | Cartoni R, Léger B, Hock MB, Praz M, Crettenand A, Pich S, Ziltener JL, Luthi F, Dériaz O, Zorzano A. Mitofusins 1/2 and ERRalpha expression are increased in human skeletal muscle after physical exercise. J Physiol. 2005;567:349-358. [PubMed] [DOI] |
| 12. | Selzner M, Selzner N, Jochum W, Graf R, Clavien PA. Increased ischemic injury in old mouse liver: an ATP-dependent mechanism. Liver Transpl. 2007;13:382-390. [PubMed] [DOI] |
| 13. | Schwabe RF, Brenner DA. Mechanisms of Liver Injury. I. TNF-alpha-induced liver injury: role of IKK, JNK, and ROS pathways. Am J Physiol Gastrointest Liver Physiol. 2006;290:G583-G589. [PubMed] [DOI] |
| 14. | Suematsu N, Tsutsui H, Wen J, Kang D, Ikeuchi M, Ide T, Hayashidani S, Shiomi T, Kubota T, Hamasaki N. Oxidative stress mediates tumor necrosis factor-alpha-induced mitochondrial DNA damage and dysfunction in cardiac myocytes. Circulation. 2003;107:1418-1423. [PubMed] [DOI] |
| 15. | Li J, Li Q, Xie C, Zhou H, Wang Y, Zhang N, Shao H, Chan SC, Peng X, Lin SC. Beta-actin is required for mitochondria clustering and ROS generation in TNF-induced, caspase-independent cell death. J Cell Sci. 2004;117:4673-4680. [PubMed] [DOI] |
| 16. | Takano H, Zou Y, Hasegawa H, Akazawa H, Nagai T, Komuro I. Oxidative stress-induced signal transduction pathways in cardiac myocytes: involvement of ROS in heart diseases. Antioxid Redox Signal. 2003;5:789-794. [PubMed] [DOI] |