修回日期: 2010-08-16
接受日期: 2010-08-29
在线出版日期: 2010-11-18
目的: 探讨胃癌KATOⅢ细胞系内皮素受体B(EDNRB)基因启动子甲基化状态及mRNA表达在临床中的应用.
方法: 提取正常健康人外周血和胃癌KATOⅢ细胞系总DNA和总RNA, 分别进行亚硫酸氢盐测序PCR(bisulfite sequencing PCR, BSP)和逆转录PCR(reverse transcriptase PCR, RT-PCR)扩增, 以正常健康人外周血为对照, 比较EDNRB基因启动子甲基化状态和mRNA表达差异.
结果: 胃癌KATOⅢ细胞系1-9、14和15等CG位点表现为无甲基化或低甲基化状态(≤20%), 其余位点表现高甲基化状态(≥50%), 正常健康人外周血EDNRB基因启动子除第22个CG甲基化率为10%外, 其余位点均表现为无甲基化状态, 胃癌KATOⅢ细胞系甲基化发生率显著高于健康人外周血, 且其mRNA表达明显受到抑制.
结论: EDNRB基因启动子甲基化在胃癌发病机制中扮演重要角色.
引文著录: 孙文早, 韩高雄. EDNRB基因启动子甲基化状态在胃癌KATOⅢ细胞系中的检测. 世界华人消化杂志 2010; 18(32): 3448-3451
Revised: August 16, 2010
Accepted: August 29, 2010
Published online: November 18, 2010
AIM: To detect the promoter methylation status and mRNA expression of the endothelin receptor type B (EDNRB) gene in human gastric cancer cell line KATO III and to analyze their clinical significance.
METHODS: Genomic DNA and total RNA were extracted from healthy adult peripheral blood samples and KATO III cells. Bisulfite sequencing PCR and reverse transcription-PCR were performed to analyze the promoter methylation status and mRNA expression of the EDNRB gene, respectively.
RESULTS: In KATO III cells, some CG loci (≤20%) were not or lowly methylated, while some others (≥50%) were hypermethylated. In healthy adult peripheral blood samples, only one CG locus (10%) was methylated, while the others were not methylated. The promoter methylation extent of the EDNRB gene in KATO III cells was higher than that in healthy adult peripheral blood samples. The mRNA expression was inhibited significantly in KATO III cells compared with healthy adult peripheral blood samples.
CONCLUSION: EDNRB gene promoter is hypermethylated in KATO III cells. The promoter methylation of the EDNRB gene may play an important role in the pathogenesis of gastric cancer.
- Citation: Sun WZ, Han GX. Detection of the promoter methylation status of the EDNRB gene in human gastric cancer cell line KATO III. Shijie Huaren Xiaohua Zazhi 2010; 18(32): 3448-3451
- URL: https://www.wjgnet.com/1009-3079/full/v18/i32/3448.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i32.3448
EDNRB基因编码产物为含有442个氨基酸的内皮素受体B(endothelin receptor type B, EDNRB), 属于G蛋白偶联受体A家族, 该蛋白质位于细胞膜表面, 与配体内皮素结合后将细胞外信号传导至细胞内[1], 调控许多重要的生物过程, 包括血管的发育与收缩功能、某些激素的产生和刺激细胞生长和分化, 在Waardenburg综合征、先天性巨结肠和癌症发病机制中起到关键作用[2,3]. 目前很多文献报道表明EDNRB基因启动子在鼻咽癌[4]、淋巴瘤[5]、前列腺癌[6,7]、食管癌[8]和口腔鳞状细胞癌[9]等患者中呈现高度甲基化状态, 而在胃癌患者中未见报道. 胃癌作为我国最常见的恶性肿瘤之一, 检测和研究胃癌患者中EDNRB基因启动子甲基化状态对阐明胃癌发病机制具有极其重要的意义, 在胃癌早期检测和治疗指导、预后评估中有重要作用.
胃癌KATOⅢ购自中国典型培养物保藏中心(武汉大学保藏中心). 对照为正常健康人外周血. 胎牛血清、DMEM(高糖)为Gibco产品, DNA提取纯化与质粒提取试剂盒购自天根生化科技(北京)有限公司, TaKaRa Ex Taq Hot Start Version、pMD18-T Vector、RNAiso Plus和PrimeScript One Step RT-PCR Kit购自TaKaRa公司, EpiTect Bisulfite Kit购自QIAGEN. 甲基化引物合成及测序由宝生物工程(大连)公司完成, PCR仪器为ABI 9700.
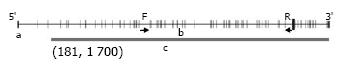
1.2.1 亚硫酸氢盐测序PCR检测EDNRB基因启动子甲基化状态: 在PubMed的GenBank上检索人类EDNRB基因序列, 以转录起始点上游1 500 bp为启动子区域, 延伸至转录起始点下游200 bp, 按照CpG岛的定义预测其中181-1 700 bp为CpG岛. 用Methyl Primer Express v1.0设计亚硫酸氢盐测序PCR(bisulfite sequencing PCR, BSP)引物, 甲基化引物: forward primer, 5'-AAAAGTATTTGTTTGATGGTAGTAGAGATT-3', reverse primer, 5'-CCTTCCTAATACCCTCTCAACTATTTT-3', 扩增产物长度为809 bp, 含有45个CG位点. CpG岛与引物设计位点见图1.
按照DNA提取试剂盒操作说明提取胃癌KATOⅢ细胞系和正常健康人外周血总DNA, 重亚硫酸盐将未甲基化C转化为U, BSP总反应体系为25 μL, 其中引物各1 μL, 甲基化修饰后的DNA 2 μL, BSP反应条件为: 95 ℃预变性5 min, 95 ℃变性30 s, 65 ℃退火90 s, 72 ℃延伸90 s, 循环35个周期后, 最后72 ℃延伸10 min结束, BSP后的产物采用TA克隆将其连接到pMD18-T质粒载体, 转化至DH5α感受态细胞后挑选10个阳性克隆测序, 测序结果采用BiQ Analyzer[10]分析.
1.2.2 RT-PCR检测EDNRB基因mRNA表达: 按照RNAiso plus提取正常健康人外周血和胃癌KATOⅢ细胞系总RNA后进行RT-PCR扩增, 引物为: forward primer, 5'-CATCAAGCTGCTGGCAGAGG-3', reverse primer, 5'-GATTCGCAGATAACTTTTGTAG-3'. 整个RT-PCR反应体系为50 μL, RT-PCR反应条件为: 热启动94 ℃ 5 min, 94 ℃变性30 s, 52 ℃退火30 s, 72 ℃延伸30 s, 循环35个周期后, 最后72 ℃延伸10 min结束. 甘油醛-3-磷酸脱氢酶(glyceraldehyde 3-phosphate dehydrogenase, GADPH)作为内对照, 产物进行琼脂糖凝胶电泳后检测.
正常健康人外周血EDNRB基因启动子除第22个CG甲基化率为10%外, 其余位点均表现为无甲基化状态, 胃癌KATOⅢ细胞系1-9、14和15等CG位点表现为无甲基化或低甲基化状态(≤20%), 其余位点表现高甲基化状态(≥50%), 甲基化发生率显著高于健康人外周血, 高甲基化状态主要位于转录起始点上游, 预示该区域可能为EDNRB基因核心启动子(图2).
健康人外周血EDNRB基因mRNA表达显著高于胃癌KATOⅢ细胞系, 后者表达明显受到抑制(图3).
DNA甲基化是最早发现的基因转录前修饰途径之一. 在DNA甲基转移酶作用催化下, 5'CpG中的胞嘧啶加上甲基基团而变成5'mCpG[10]. 在真核生物基因组中接近80%的CpG位点均被甲基化, 这些甲基化主要位于启动子区域的CpG岛[11]. 大量研究表明, DNA甲基化能引起染色质结构、DNA构象、DNA稳定性及DNA与蛋白质相互作用方式的改变, 从而调控基因表达, 已经成为表观遗传学修饰的最重要的作用方式[12].
DNA甲基化在癌症的发生机制中扮演重要角色[13], 许多文献报道DNA启动子区域高甲基化状态抑制或完全灭活基因表达而产生癌症, 大多数肿瘤细胞呈现高甲基化状态, DNA甲基化已经成为肿瘤诊断中的生物标志物[14]. EDNRB基因介导细胞信号传递, 调控细胞增殖分化, 启动子区域甲基化状态抑制基因表达而导致细胞发生恶性增殖, 最终产生癌症, 目前研究表明鼻咽癌、前列腺癌和结直肠癌等众多癌症与EDNRB启动子高甲基化相关. 胃癌KATOⅢ细胞系建系于1978年, 属于腺癌细胞系[16], 目前已经成为研究胃癌发病机制的重要细胞系之一. 本实验结果显示在胃癌KATOⅢ细胞系中, EDNRB基因表现为高甲基化状态, 转录起始点上游核心启动子区域甲基化程度更高(甲基化率接近100%), 其显著抑制EDNRB转录活性而导致mRNA表达降低, 该结果预示胃癌患者EDNRB基因可能呈现高甲基化状态, 检测该基因启动子甲基化程度可能为胃癌早期发现、治疗评估和预后预测提供一个重要的生物标志物.
EDNRB基因编码产物属于G蛋白偶联受体A家族, 位于细胞膜表面, 与配体内皮素结合后将细胞外信号传导至细胞内, 调控许多重要的生物过程, 包括血管的发育与收缩功能、某些激素的产生和刺激细胞生长和分化, 在Waardenburg综合征、先天性巨结肠和肿瘤发病机制中起到关键作用.
崔莲花, 副教授, 青岛大学医学院公共卫生系
EDNRB基因启动子甲基化改变导致肿瘤的发病机制是目前消化系肿瘤领域的研究热点, 亟待解决的是EDNRB基因启动子区域每个CG位点甲基化状态.
目前众多文献报道EDNRB基因启动子在鼻咽癌、淋巴瘤、前列腺癌、食管癌和口腔鳞状细胞癌等患者肿瘤组织中呈高度甲基化状态, 其基因甲基化灭活直接与肿瘤发病机制相关.
本文首次研究揭示EDNRB基因启动子45个CG位点甲基化状态, 证明EDNRB基因启动子甲基化灭活与基因表达缺失之间相关, 对胃癌发病机制的进一步研究提供参考数据.
本文选题新颖, 对胃癌的临床治疗有一定的指导价值.
编辑 李军亮 电编 何基才
| 1. | Barton M, Yanagisawa M. Endothelin: 20 years from discovery to therapy. Can J Physiol Pharmacol. 2008;86:485-498. [PubMed] [DOI] |
| 2. | Sánchez-Mejías A, Fernández RM, López-Alonso M, Antiñolo G, Borrego S. New roles of EDNRB and EDN3 in the pathogenesis of Hirschsprung disease. Genet Med. 2010;12:39-43. [PubMed] [DOI] |
| 4. | Zhou L, Feng X, Shan W, Zhou W, Liu W, Wang L, Zhu B, Yi H, Yao K, Ren C. Epigenetic and genetic alterations of the EDNRB gene in nasopharyngeal carcinoma. Oncology. 2007;72:357-363. [PubMed] [DOI] |
| 5. | Hsiao PC, Liu MC, Chen LM, Tsai CY, Wang YT, Chen J, Hsu LS. Promoter methylation of p16 and EDNRB gene in leukemia patients in Taiwan. Chin J Physiol. 2008;51:27-31. [PubMed] |
| 6. | Phé V, Cussenot O, Rouprêt M. Methylated genes as potential biomarkers in prostate cancer. BJU Int. 2010;105:1364-1370. [PubMed] [DOI] |
| 7. | Ellinger J, Bastian PJ, Jurgan T, Biermann K, Kahl P, Heukamp LC, Wernert N, Müller SC, von Ruecker A. CpG island hypermethylation at multiple gene sites in diagnosis and prognosis of prostate cancer. Urology. 2008;71:161-167. [PubMed] [DOI] |
| 8. | Zhao BJ, Sun DG, Zhang M, Tan SN, Ma X. Identification of aberrant promoter methylation of EDNRB gene in esophageal squamous cell carcinoma. Dis Esophagus. 2009;22:55-61. [PubMed] [DOI] |
| 9. | Kaur J, Demokan S, Tripathi SC, Macha MA, Begum S, Califano JA, Ralhan R. Promoter hypermethylation in Indian primary oral squamous cell carcinoma. Int J Cancer. 2010;127:2367-2373. [PubMed] [DOI] |
| 10. | Bock C, Reither S, Mikeska T, Paulsen M, Walter J, Lengauer T. BiQ Analyzer: visualization and quality control for DNA methylation data from bisulfite sequencing. Bioinformatics. 2005;21:4067-4068. [PubMed] [DOI] |
| 11. | Nagase H, Ghosh S. Epigenetics: differential DNA methylation in mammalian somatic tissues. FEBS J. 2008;275:1617-1623. [PubMed] [DOI] |
| 12. | Feng J, Fan G. The role of DNA methylation in the central nervous system and neuropsychiatric disorders. Int Rev Neurobiol. 2009;89:67-84. [PubMed] [DOI] |
| 13. | Zhang TY, Meaney MJ. Epigenetics and the environmental regulation of the genome and its function. Annu Rev Psychol. 2010;61:439-66, C1-3. [PubMed] |
| 14. | Grønbaek K, Hother C, Jones PA. Epigenetic changes in cancer. APMIS. 2007;115:1039-1059. [PubMed] [DOI] |
| 15. | Qureshi SA, Bashir MU, Yaqinuddin A. Utility of DNA methylation markers for diagnosing cancer. Int J Surg. 2010;8:194-198. [PubMed] [DOI] |
| 16. | Sekiguchi M, Sakakibara K, Fujii G. Establishment of cultured cell lines derived from a human gastric carcinoma. Jpn J Exp Med. 1978;48:61-68. [PubMed] |