修回日期: 2010-11-05
接受日期: 2010-11-10
在线出版日期: 2010-11-18
目的: 探讨氧化苦参碱(OM)对人胰腺癌细胞株SW1990的杀伤作用及机制.
方法: 取人胰腺癌细胞SW1990为研究对象, 随机分为对照(control)组和OM组, OM组再按照OM剂量不同, 分为1、2、4 g/L 3组. 用RT-PCR和Western blot检测血管内皮生长因子(VEGF) mRNA和蛋白的表达变化, 用四甲基偶氮唑蓝(MTT)比色法检测OM对SW1990细胞的杀伤作用, 细胞侵袭力测定试剂盒检测细胞侵袭力.
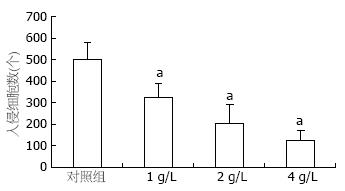
结果: RT-PCR显示VEGF mRNA在SW1990细胞中的表达, OM组较control组显著降低(0.648±0.043, 0.395±0.012, 0.317±0.031 vs 0.889±0.028, P<0.05), 在VEGF蛋白检测中, 也得到同样结果(1.668±0.212, 1.523±0.345, 1.388±0.187 vs 1.876±0.327, 均P<0.05). 细胞侵袭力测定显示OM各组侵袭过Matrigel胶的细胞数显著低于control组(325±64.43, 206±84.76, 124±46.78 vs 498±78.54, P<0.05), OM组细胞侵袭能力较对照组显著降低.
结论: OM可能通过下调VEGF的表达, 抑制胰腺癌细胞侵袭转移能力.
引文著录: 冀润利, 夏时海, 李飞, 邸瑶. 氧化苦参碱对人胰腺癌细胞血管内皮生长因子表达的影响. 世界华人消化杂志 2010; 18(32): 3402-3406
Revised: November 5, 2010
Accepted: November 10, 2010
Published online: November 18, 2010
AIM: To observe the influence of oxymatrine (OM) treatment on vascular endothelial growth factor (VEGF) expression in human pancreatic carcinoma SW1990 cells and to assess the mechanism behind the cytotoxicity of OM against SW1990 cells.
METHODS: Cultured SW1990 cells were divided into two groups: control group and OM group. The OM group was further divided into three subgroups and treated with 1, 2 and 4 g/L OM, respectively. The mRNA and protein expression of VEGF in SW1990 cells was analyzed by real-time polymerase chain reaction (RT-PCR) and Western blot, respectively. The changes in the cytotoxicity of OM against SW1990 cells were assessed by MTT assay. The effect of OM on the invasiveness of SW1990 cells was analyzed using cell invasion assay kit.
RESULTS: The expression levels of VEGF mRNA in SW1990 cells were significantly lower in the three OM subgroups than in the control group (0.648 ± 0.043, 0.395 ± 0.012, 0.317 ± 0.031 vs 0.889 ± 0.028, all P < 0.05). Similar results were obtained for the protein expression of VEGF (1.668 ± 0.212, 1.523 ± 0.345, 1.388 ± 0.187 vs 1.876 ± 0.327, all P < 0.05). The invasion of SW1990 cells in the OM subgroups was markedly lower than that in the control group (325 ± 64.43, 206 ± 84.76, 124 ± 46.78 vs 498 ± 78.54, all P < 0.05).
CONCLUSION: OM is able to reduce the invasion of SW1990 cells possibly by down-regulating the expression of VEGF.
- Citation: Ji RL, Xia SH, Li F, Di Y. Oxymatrine down-regulates VEGF expression in human pancreatic carcinoma SW1990 cells. Shijie Huaren Xiaohua Zazhi 2010; 18(32): 3402-3406
- URL: https://www.wjgnet.com/1009-3079/full/v18/i32/3402.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i32.3402
胰腺癌是一种恶性程度高、易转移且预后极差的消化系肿瘤[1]. 近年来胰腺癌的发病率在国内外均呈显著上升趋势[2-4]. 肿瘤的发生发展是一个多因素、多基因、多步骤的复杂过程[5], 侵袭转移行为是胰腺癌等恶性肿瘤最本质的特性, 早期出现侵袭转移行为严重影响了胰腺癌患者生存率的提高[6]. 癌的侵袭转移是一个复杂的过程, 但肿瘤的生长和转移很大程度上依赖肿瘤血管的形成[7]. 血管内皮生长因子(vascular endothelial growth factor, VEGF)具有特异性促内皮细胞有丝分裂、促血管通透性增加的活性作用, 有利于肿瘤的转移和扩散[8,9]. VEGF可能与胰腺癌预后相关, 在胰腺癌的发展、浸润和转移中起着重要作用[10]. 因此应用血管形成抑制剂, 防治肿瘤的侵袭、转移是降低肿瘤死亡率的重要途径之一[11,12]. 氧化苦参碱(oxymatrine, OM)是从中药苦参、苦豆子、广豆根中提取的一种生物碱[13], 有多方面的药理作用[14]. 研究发现OM不但对肿瘤细胞和血管内皮细胞(vascular endothelial cell, VEC)增殖本身有一定的抑制作用, 而且对肿瘤细胞诱导的VEC增殖具有较强的抑制作用[15]. 本文以人胰腺癌细胞株SW1990为研究对象, 研究OM对SW1990中VEGF蛋白及mRNA表达的影响, 探讨OM对SW1990体外侵袭转移能力的影响作用, 为中药OM治疗胰腺癌提供实验数据.
优质胎牛血清购自中科院天津血液学研究所; RPMI 1640培养基购自Gibco公司; OM购自正大天晴公司, VEGF抗体购自Santa Cruz公司; Triol购自Invitrogen公司; PCR Marker、RT-PCR试剂盒购自大连宝生物公司; Matrigel胶购自BD Biosciences公司、Transwell小室购自Millipore公司、VEGF引物合成购自Invitrogen生物技术公司.
1.2.1 细胞培养: SW1990细胞由协和医科大学基础学院细胞中心提供, 细胞生长于含100 mL/L小牛血清的DMEM培养液中, 置于37 ℃、50 mL/L CO2的孵育箱(相对湿度为95%)中培养.
1.2.2 分组: 随机分为对照组和OM组. 经预实验证明, 在培养液中加入1-4 g/L OM均可抑制细胞生长, 故OM组再随机分为1, 2, 4 g/L 3组. 选用含100 mL/L FBS的RPMI 1640完全培养基, 待细胞长满培养瓶底部70%-80%时, 用0.25%胰蛋白酶和0.03% EDTA(1∶1)消化传代, 取对数生长期细胞用于实验.
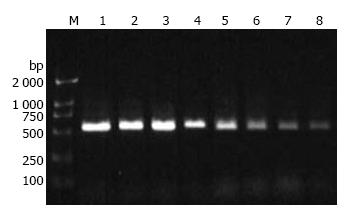
1.2.3 RT-PCR: 采用Triol试剂从细胞中提取总RNA, 检测RNA的含量和纯度(A260/A280 = 1.8-2.0). 以1%琼脂糖凝胶电泳鉴定其完整性(28S和18S RNA条带比值≥2.0). 用1 μg细胞总RNA进行逆转录, PCR反应条件如表1.
| VEGF | β-actin |
| FP: 5'-CTACCTCCACCATGCCAAGT-3' | FP: 5'-TGTTTGAGACCTTCAACACCC-3' |
| RP: 5'-TCTCTCCTATGTGCTGGCCT-3' | RP: 5'-AGCACTGTGTTGGCGTACAGG-3' |
| 扩增片段505 bp | 扩增片段540 bp |
| 94 ℃, 1 min | 94 ℃, 1 min |
| 61 ℃, 45 s | 58 ℃, 30 s |
| 72 ℃, 1 min | 72 ℃, 1 min |
| 30个循环 | 30个循环 |
1.2.4 细胞侵袭实验: 收集对数生长期细胞, 分别用含有PBS(对照组), 和1, 2, 4 g/L OM的DMEM培养基悬浮细胞, 制成1×106/mL的单细胞悬液, 按照细胞侵袭测定试剂盒说明书操作. 细胞在小室内培养48 h后, 染色并拍照, 显微镜下观察穿过膜的细胞数, 计数中间及四周5个高倍(×400)镜下视野细胞数, 计算平均数.
统计学处理 数据采用SPSS11.5统计分析软件进行处理, 所得数值以mean±SD表示, 组间比较采用方差分析和t检验, P<0.05为具有统计学意义.
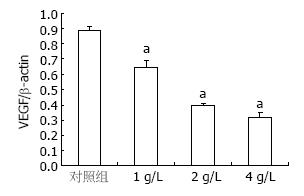
结果显示SW1990细胞在基因水平有VEGF mRNA的表达. 不同浓度的OM(1, 2, 4 g/L)作用于胰腺癌细胞SW1990 24 h, VEGF mRNA表达量与对照组相比显著降低(0.648±0.043, 0.395±0.012, 0.317±0.031 vs 0.889±0.028, 均P<0.05,图1, 2).
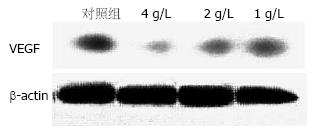
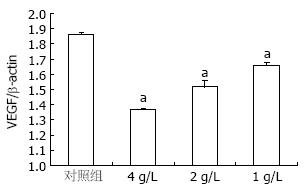
不同浓度的OM作用于胰腺癌细胞SW1990 24 h后, VEG蛋白表达与对照组比较显著减低(1.668±0.212, 1.523±0.345, 1.388±0.187 vs 1.876±0.327, 均P<0.05, 图3, 4).
OM处理SW1990细胞48 h后, 侵袭力测定显示不同浓度OM组侵袭过细胞Matrigel胶的细胞数显著低于对照组(325±64.43, 206±84.76, 124±46.78 vs 498±78.54), OM各组的细胞侵袭力均显著低于对照组(P<0.05). OM各组进入微孔膜内的细胞数也显著低于对照组(385±58.9, 287±79.8, 186±60.9 vs 586±85.8, 均P<0.05, 图5, 6).
现已证实肿瘤血管生成是实体瘤产生、发展、转移过程中一个关键步骤. 血管是瘤细胞生命线及迁移通道, 肿瘤的血管生成极为复杂, 其中VEGF对血管生成的调控作用较强, 且特异性高[16], 在肿瘤血管生成、肿瘤生长和转移中起到重要作用[17,18]. 胰腺癌血管生成是指在原有血管的基础上通过内皮细胞增殖、基底膜与细胞外基质(extracellular matrix, ECM)降解、内皮细胞迁移、重构以"出芽"的方式形成新的毛细血管[19]. 在这个过程中有多种生长因子、ECM组分、蛋白水解酶和细胞黏附分子等因素参与血管生成的调控[20]. 抗血管生成治疗可减少胰腺癌的血供, 从而抑制胰腺癌的生长和转移, 作为辅助治疗已显示出其重要作用[21].
目前已进入Ⅱ-Ⅲ期临床试验的抗血管生成药物有两大类, 分别是VEGF抑制剂, 如烟曲霉素衍生物(TNP-470、SU6668、SU5416等), 以及碱性成纤维细胞生长因子抑制剂, 如干扰素, 反应停等. 还有一些抑制癌细胞黏附、移行的药物亦在研究之中. 这些化合物经临床前研究发现均有一定抗肿瘤侵袭、转移作用, 临床试验表明VEGF抑制剂疗效较好. 以VEGF为靶点的抗肿瘤血管新生治疗是目前研究的热点. 国内外已有多项研究证实应用VEGF抗体、VEGF受体拮抗剂, 抑制VEGF的表达或阻断其信号传导途径, 可以明显地减少肿瘤的血管新生、抑制肿瘤的生长[22,23].
目前的抗血管生成药通过增加剂量可以完全抑制肿瘤的生长[24,25], 但他们中多数用在人体内不理想, 存在着吸收、降解、毒性等问题[26], 比如在抑制肿瘤生长的同时, 也容易损失正常组织和血管, 包括心血管、内分泌和神经系统. 如bevacizumab(商品名Avastin)[27]会增加高血压、血栓形成、胃肠道穿孔和出血的危险[28], 且随着剂量的增加, 不良反应会更明显. 因此寻找一种降低胰腺癌侵袭转移力且毒性较小的抗血管生成药物, 有着不可估量的临床价值和现实意义.
OM化学分子式C15H24N2O2, 相对分子质量282, 是苦参型生物碱的主要活性成分, 有抗菌、抗炎、抗风湿、抗肿瘤、抗过敏、免疫及生物反应调节作用等[29]. 大量的文献表明OM可以抑制肿瘤细胞的增殖、转移, 诱导其凋亡、及向正常细胞分化, 具有抗肿瘤的活性[30]. OM在代谢水平对肿瘤细胞发生影响, 通过调节抑癌基因和癌基因的表达, 影响癌细胞的代谢, 抑制其增殖[31-33].
本实验研究表明OM对人胰腺癌细胞SW1990具有杀伤作用. 已有大量的研究证明, 在胰腺癌组织和细胞中存在VEGF的高表达[34,35], 且VEGF的表达于胰腺癌的转移密切相关. 我们的研究亦证实, 在SW1990细胞中存在VEGF的高表达, 通过划痕实验证明OM可以明显抑制肿瘤细胞的迁移能力, 以及肿瘤细胞对基底膜的穿透性. OM作用SW1990细胞48 h后, VEGF mRNA及其蛋白的表达明显下调, 且随着OM浓度增大, 其表达逐渐降低. 提示OM可以抑制胰腺癌SW1990细胞VEGF的表达, 抑制血管的生成, 降低SW1990细胞的侵袭力, 阻止肿瘤生长和转移.
OM的毒性较小, 且具有提高白细胞数的作用, 因此, OM有望成为新的抗肿瘤血管生成药物, 如加强联合用药的研究, 更能充分发挥传统中药在抗肿瘤方面的独特效用, 为临床治疗肿瘤提出新的思路. 大力研发具有我国自主知识产权的抗转移药物, 具有不可估量的经济利益和战略利益.
胰腺癌是一种恶性程度高的消化系肿瘤, 其发病率呈显著上升趋势. 早期出现侵袭转移行为严重影响了胰腺癌患者生存率的提高, 应用血管形成抑制剂, 防治肿瘤的侵袭、转移是降低肿瘤死亡率的重要途径之一.
郭晓钟, 教授, 中国人民解放军沈阳军区总医院消化内科
以VEGF为靶点的抗肿瘤血管新生治疗是目前研究的热点. 国内外研究证实VEGF抗体、VEGF受体拮抗剂可以明显减少肿瘤的血管新生、抑制肿瘤的生长, 但他们中多数用在人体内不理想, 存在着吸收、降解、毒性等问题, 因此寻找一种降低胰腺癌侵袭转移力且毒性较小的抗血管生成药物, 有着不可估量的临床价值和现实意义.
Griffin等的实验证实胰腺癌模型动物在注射VEGF-R抑制剂后, 肿瘤血供减少50%, 胰腺癌的生长受到抑制.
本文以人胰腺癌细胞株SW1990为研究对象,研究OM对SW1990中VEGF蛋白及mRNA表达的影响, 探讨OM对SW1990体外侵袭转移干预作用的影响, 为中药OM治疗胰腺癌提供实验数据.
OM有望成为新的抗肿瘤血管生成药物, 为临床治疗肿瘤提出新的思路.
本文创新性较好, 研究结果可靠, 为今后OM治疗胰腺癌的临床应用奠定了基础.
编辑 曹丽鸥 电编 何基才
| 1. | Rosenberg L. Pancreatic cancer: a review of emerging therapies. Drugs. 2000;59:1071-1089. [PubMed] |
| 3. | Jemal A, Siegel R, Xu J, Ward E. Cancer statistics, 2010. CA Cancer J Clin. 2010;60:277-300. [PubMed] [DOI] |
| 7. | Fanelli M, Locopo N, Gattuso D, Gasparini G. Assessment of tumor vascularization: immunohistochemical and non-invasive methods. Int J Biol Markers. 1999;14:218-231. [PubMed] |
| 8. | Duff SE, Jeziorska M, Kumar S, Haboubi N, Sherlock D, O'Dwyer ST, Jayson GC. Lymphatic vessel density, microvessel density and lymphangiogenic growth factor expression in colorectal cancer. Colorectal Dis. 2007;9:793-800. [PubMed] [DOI] |
| 9. | Ferrara N. VEGF as a therapeutic target in cancer. Oncology. 2005;69 Suppl 3:11-16. [PubMed] [DOI] |
| 10. | 唐 来, 刘 煦禾, 赵 永春, 杜 媛, 李 峰. VEGF在胰腺癌组织芯片中的表达及其临床意义的研究. 苏州大学学报(医学版). 2009;29:733-735. |
| 12. | Bagri A, Berry L, Gunter B, Singh M, Kasman I, Damico LA, Xiang H, Schmidt M, Fuh G, Hollister B. Effects of anti-VEGF treatment duration on tumor growth, tumor regrowth, and treatment efficacy. Clin Cancer Res. 2010;16:3887-3900. [PubMed] [DOI] |
| 14. | 王 昱良, 郑 永青, 夏 时海, 汪 海燕, 苏 丽婷, 吴 双. 氧化苦参碱对慢性胰腺炎胰腺组织中Ⅰ型胶原及α-SMA的影响. 世界华人消化杂志. 2010;18:1331-1336. [DOI] |
| 15. | Ho JW, Ngan Hon PL, Chim WO. Effects of oxymatrine from Ku Shen on cancer cells. Anticancer Agents Med Chem. 2009;9:823-826. [PubMed] |
| 17. | Alvarez RH, Valero V, Hortobagyi GN. Emerging targeted therapies for breast cancer. J Clin Oncol. 2010;28:3366-3379. [PubMed] [DOI] |
| 18. | Tabernero J. The role of VEGF and EGFR inhibition: implications for combining anti-VEGF and anti-EGFR agents. Mol Cancer Res. 2007;5:203-220. [PubMed] [DOI] |
| 21. | Schomber T, Kopfstein L, Djonov V, Albrecht I, Baeriswyl V, Strittmatter K, Christofori G. Placental growth factor-1 attenuates vascular endothelial growth factor-A-dependent tumor angiogenesis during beta cell carcinogenesis. Cancer Res. 2007;67:10840-10848. [PubMed] [DOI] |
| 22. | Belotti D, Calcagno C, Garofalo A, Caronia D, Riccardi E, Giavazzi R, Taraboletti G. Vascular endothelial growth factor stimulates organ-specific host matrix metalloproteinase-9 expression and ovarian cancer invasion. Mol Cancer Res. 2008;6:525-534. [PubMed] [DOI] |
| 23. | Qian F, Engst S, Yamaguchi K, Yu P, Won KA, Mock L, Lou T, Tan J, Li C, Tam D. Inhibition of tumor cell growth, invasion, and metastasis by EXEL-2880 (XL880, GSK1363089), a novel inhibitor of HGF and VEGF receptor tyrosine kinases. Cancer Res. 2009;69:8009-8016. [PubMed] [DOI] |
| 24. | Loges S, Schmidt T, Carmeliet P. Mechanisms of resistance to anti-angiogenic therapy and development of third-generation anti-angiogenic drug candidates. Genes Cancer. 2010;1:12-25. [PubMed] [DOI] |
| 25. | Sato Y. [Anti-angiogenic drugs]. Nihon Rinsho. 2010;68:1054-1058. [PubMed] |
| 26. | Huang KW, Wu HL, Lin HL, Liang PC, Chen PJ, Chen SH, Lee HI, Su PY, Wu WH, Lee PH. Combining antiangiogenic therapy with immunotherapy exerts better therapeutical effects on large tumors in a woodchuck hepatoma model. Proc Natl Acad Sci U S A. 2010;107:14769-1474. |
| 27. | Brar VS, Sharma RK, Murthy RK, Chalam KV. Bevacizumab neutralizes the protective effect of vascular endothelial growth factor on retinal ganglion cells. Mol Vis. 2010;16:1848-1853. [PubMed] |
| 28. | Van Meter ME, Kim ES. Bevacizumab: current updates in treatment. Curr Opin Oncol. 2010;22:586-591. [PubMed] [DOI] |