修回日期: 2010-07-27
接受日期: 2010-08-24
在线出版日期: 2010-11-08
目的: 探讨黄连素对结肠上皮隐窝细胞基底膜cAMP依赖的钾通道[IK(cAMP)]的影响, 以研究其治疗分泌性腹泻的机制.
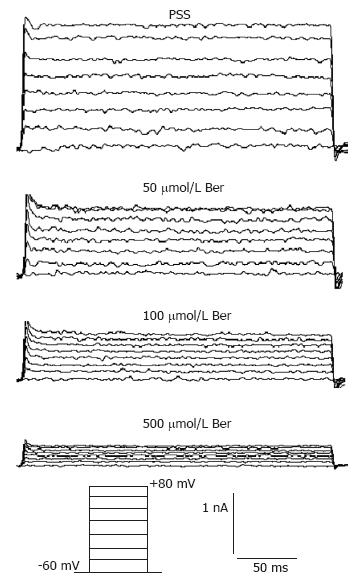
方法: 用EDTA溶液分离结肠上皮隐窝细胞, 以-60 mV为钳制电压钳制细胞, 20 mV为阶跃, 用EPC10膜片钳放大器测量全细胞模式下50、100、500 µmol/L的黄连素对结肠上皮细胞基底膜IK(cAMP)的影响.
结果: 50、100、500 µmol/L的黄连素可显著抑制大鼠结肠上皮隐窝细胞基底膜IK(cAMP)(P<0.05), 且抑制效应具有浓度依赖性. 当阶跃刺激为+80 mV时, 其IK(cAMP)分别为生理盐水对照组的78.55%±5.72%, 60.42%±6.33%, 43.78%±6.47% (P<0.05).
结论: 黄连素能抑制大鼠结肠隐窝细胞基底膜cAMP依赖的钾通道开放, 这可能是其治疗分泌性腹泻的机制之一.
引文著录: 尹琬凌, 罗和生, 韩肇木. 黄连素对大鼠结肠隐窝细胞钾通道的影响. 世界华人消化杂志 2010; 18(31): 3343-3346
Revised: July 27, 2010
Accepted: August 24, 2010
Published online: November 8, 2010
AIM: To clarify the mechanism behind therapeutic effects of berberine against secretory diarrhea by investigating the effects of berberine on basolateral cAMP-activated potassium current [IK (cAMP)] in rat colonic crypt cells.
METHODS: Intact colonic crypt cells were isolated using an EDTA solution. The effects of berberine on IK (cAMP) in isolated colonic crypt cells were detected using the conventional whole-cell patch-clamp technique.
RESULTS: Berberine could significantly inhibit IK (cAMP) in rat colonic crypt cells (P < 0.05). At concentrations of 50, 100 and 500 µmol/L, berberine reduced IK (cAMP) to 71.43% ± 3.61%, 54.56% ± 5.13% and 38.66% ± 3.85% of that in control cells when depolarizing at +80 mV.
CONCLUSION: Berberine exerts therapeutic effects against secretory diarrhea possibly by inhibiting IK (cAMP) in rat colonic crypt cells.
- Citation: Yin WL, Luo HS, Han ZM. Berberine inhibits basolateral potassium current in rat colonic crypt cells. Shijie Huaren Xiaohua Zazhi 2010; 18(31): 3343-3346
- URL: https://www.wjgnet.com/1009-3079/full/v18/i31/3343.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i31.3343
黄连素(又称小檗碱, Berberine, Ber)是从毛莨科黄连属植物根状茎中提取的一种异喹啉生物碱, 是一种作用范围广、价格低廉、使用方便、不良反应少的止泻药物, 在临床上主要用于治疗感染引起的分泌性腹泻. 近年来不少研究发现, Ber具有抑制肠黏膜分泌的作用[1,2], 但对Ber治疗分泌性腹泻的离子转运机制不甚明了. 本实验采用膜片钳技术探讨Ber对大鼠结肠上皮隐窝细胞基底膜环磷酸腺苷(cyclic adenosine monophosphate, cAMP)依赖的钾通道[IK(cAMP)]的影响, 以研究其治疗分泌性腹泻的离子转运机制.
SD大鼠购自华中科技大学同济医学院. 黄连素、小牛血清白蛋白购自Sigma公司.
1.2.1 结肠上皮隐窝细胞的分离: 健康SD大鼠1只, ♂, 8-12 wk, 断颈处死, 迅速取近端结肠, 沿肠系膜纵向切开, 用通有体积分数为950 mL/L O2和50 mL/L CO2的预冷的克-汉二氏溶液(krebs-henseleit solution, KHS)将组织的黏膜面冲洗干净, 黏膜面朝下固定在底部铺有硅胶的容器中, 容器中盛有上述通入混合气的溶液. 在解剖显微镜下, 将黏膜下层、肌层和浆膜层与黏膜层钝性分离, 得到上皮层和一些粘连的结缔组织[4]. 将黏膜剪成1 mm×1 mm的小块, 转入EDTA中7-9 min, 振荡30 s, 用高钾台式液(high K+ tyrode)收集, 保存在4 ℃冰箱备用, 实验前用吸管反复吹打直至液体浑浊, 取上清液即可得到单个结肠上皮隐窝细胞[5].
1.2.2 IK(cAMP)的记录: 取细胞悬液约0.1 mL于细胞灌流槽中, 放置30 min使细胞自然沉降、贴壁, PSS灌流20 min. 用IK(cAMP)电极内液[3]充灌玻璃微电极(上海神经生物研究所). 在倒置显微镜(IX71-Olympus, 日本)下通过微操纵器(MWO-3 Narishige, 日本)调节电极封接细胞. 当细胞膜与玻璃微电极形成高阻封接(封接电阻>1 GΩ)后电击破细胞膜, 然后分别用PSS(对照组)和含Ber 50、100、500 µmol/L的PSS灌流, 以-60 mV为钳制电压钳制细胞, 20 mV为阶跃, 用EPC10膜片钳放大器(HEKA, Darmstadt, 德国)检测IK(cAMP). 每次测定一个浓度的Ber后均用PSS洗脱1 min, 只有当洗脱后其IK(cAMP)才能恢复原来水平, 此数据才能用于统计[6].
统计学处理 实验结果均以mean±SD表示, 采用单因素方差分析, 用膜片钳数据软件Clampfit8.0和统计软件SPSS11.5进行统计分析.
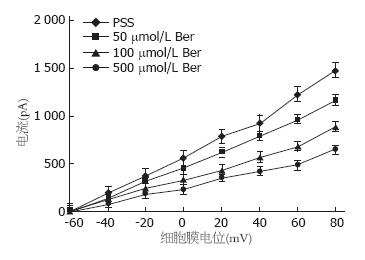
Ber对大鼠结肠上皮隐窝细胞基底膜IK(cAMP)的影响: 在全细胞模式下, 将膜电位钳制在-60 mV, 以每20 mV阶跃去极化至+80 mV, 维持200 ms, 刺激间隔为10 s, 记录IK(cAMP)(表1). 在阶跃刺激下, Ber能显著性抑制IK(cAMP), 其效应呈浓度依赖性, 差异有统计学意义(n = 8, P<0.05, 图1). 不同浓度Ber作用后, 绘出IK(cAMP)电流-电压曲线(图2). 当阶跃刺激为+80 mV时, 浓度为50、100、500 µmol/L Ber作用后的IK(cAMP)与对照组相比, 分别为对照组的78.55%±5.72%, 60.42%±6.33%, 43.78%±6.47%, 差异均有显著意义(n = 8, P<0.05).
| 分组 | 阶跃刺激(mV) | |||||||
| -60 | -40 | -20 | 0 | 20 | 40 | 60 | 80 | |
| PSS对照组 | 0 | 185.23 | 365.23 | 556.23 | 782.23 | 925.23 | 1 220.23 | 1 478.69 |
| 50 μmol/L Ber组 | 0 | 136.23 | 310.25 | 440.44 | 615.23 | 790.25 | 956.23 | 1 161.51 |
| 100 μmol/L Ber组 | 0 | 115.25 | 240.23 | 320.13 | 432.00 | 562.32 | 678.95 | 893.42 |
| 500 μmol/L Ber组 | 0 | 85.23 | 200.55 | 268.13 | 380.55 | 480.12 | 520.89 | 707.97 |
Ber是黄连的主要有效成分, 是一种传统的物美价廉的止泻药物, 主要用于治疗细菌感染引起的分泌性腹泻. 研究证明, Ber治疗腹泻的机制有很多, 如Ber是一种广谱抗菌药, 能抑制细菌对蛋白的合成; Ber可恢复肠道致病菌对抗生素的敏感性; Ber可通过抑制豚鼠结肠平滑肌细胞膜钙离子激活钾通道和延迟整流钾通道, 降低平滑肌的收缩和肠道运动, 治疗动力性腹泻[6]. 长期以来, 对于Ber治疗分泌性腹泻的机制研究很多[1,2,7,8], 但其离子转运机制尚不明了.
细菌毒素引起分泌性腹泻的机制是: 内毒素先与上皮细胞刷状缘上的受体结合继而激活了肠黏膜细胞内的腺苷酸环化酶, 使细胞内第二信使cAMP、环磷酸鸟苷(cyclic guanosine monophosphate, cGMP)及钙离子增加, 促进细胞内一系列酶反应的进行, 使细胞分泌功能大大强化, 引起水及电解质大量分泌. 大量无蛋白等渗液及电解质分泌入肠腔, 其碳酸氢根含量是血浆的2倍, 其氯离子含量是血浆的5倍.
由此可见, 分泌性腹泻主要是大量阴离子分泌到肠腔引起的. 而阴离子分泌到细胞外需要两个前提条件, 即细胞膜上存在有阴离子通道和促分泌的驱动力. 因为细胞内的阴离子浓度低于肠腔, 促使阴离子分泌到细胞外的驱动力不是化学梯度, 而是膜电位差. 研究表明结肠上皮引起的阴离子分泌能被基底膜非选择性的K通道阻断剂Ba2+完全阻断[11], 表明基底膜的K+通道对阴离子的分泌起着重要的作用, 而cAMP依赖的钾通道是结肠上皮隐窝细胞中主要存在的基底膜钾通道之一[2], 因此该通道与结肠分泌有十分密切的关系. Cl-是细胞内主要的阴离子, Cl-分泌的过程是首先通过基底膜钠-钾-氯共转运体进入细胞内, 由于要维持离子电荷平衡, K+通过基底膜的K+通道由上皮细胞内转运到细胞外, 导致膜的超极化, 然后Cl-依靠这种基底膜K+的跨基底膜运动使膜超级化所提供电驱动力, 经顶膜的Cl-通道分泌到肠腔. K+的这种跨基底膜运动为维持Cl-分泌提供必需的电驱动力, 这种作用是肠腔Cl-分泌的必要条件[2,4,9,10]. 说明这种K+通道可能是分泌性腹泻的离子转运基础之一.
本实验结果表明, 50、100、500 µmol/L的Ber能明显抑制大鼠结肠上皮细胞基底膜IK(cAMP), 并呈浓度依赖性. 据此可推测, Ber有可能是通过抑制这种钾通道, 减少K+通过基底膜的K+通道转运到细胞外, 减少维持阴离子分泌的电驱动力, 从而减少阴离子的分泌来发挥治疗分泌性腹泻的作用. 由此可见, Ber对结肠上皮细胞基底膜K+通道的作用可能是其治疗分泌性腹泻的机制之一, 要深入探讨其作用机制, 还应研究Ber对结肠上皮细胞膜Cl-及碳HCO3-分泌的影响.
黄连素即小檗碱, 在中国及印度被用做止泻药已有三千余年的历史, 中医上他属清热解毒药, 临床上主要用于治疗肠道细菌的感染性疾病. 近年来国内外学者研究发现, 黄连素具有抑制小肠黏膜分泌的作用, 但其治疗分泌性腹泻的相关研究甚少.
黄颖秋, 教授, 本溪钢铁(集团)有限责任公司总医院消化内科
陈明锴等发现, 黄连素可抑制豚鼠回肠正常电解质分泌, 对霍乱毒素所致的回肠黏膜电解分泌亢进亦有逆转作用, 能有效地治疗分泌性腹泻.
本实验采用膜片钳技术研究黄连素对大鼠结肠上皮隐窝细胞基底膜cAMP依赖的钾通道[IK(cAMP)]的影响, 以探讨其治疗分泌性腹泻的离子转运机制.
本研究证实, 黄连素有可能是通过抑制大鼠结肠上皮细胞基底膜cAMP依赖钾通道, 减少K+通过基底膜的K+通道转运到细胞外, 减少维持阴离子分泌的电驱动力, 从而减少阴离子的分泌来发挥治疗分泌性腹泻的作用.
本文学术价值较好, 为黄连素治疗分泌性腹泻的药理机制提供了实验依据.
编辑 曹丽鸥 电编 何基才
| 2. | Taylor CT, Winter DC, Skelly MM, O'Donoghue DP, O'Sullivan GC, Harvey BJ, Baird AW. Berberine inhibits ion transport in human colonic epithelia. Eur J Pharmacol. 1999;368:111-118. [PubMed] [DOI] |
| 3. | Barrière H, Rubera I, Belfodil R, Tauc M, Tonnerieux N, Poujeol C, Barhanin J, Poujeol P. Swelling-activated chloride and potassium conductance in primary cultures of mouse proximal tubules. Implication of KCNE1 protein. J Membr Biol. 2003;193:153-170. [PubMed] [DOI] |
| 4. | Hintz KK, Ren J. Tetramethylpyrazine elicits disparate responses in cardiac contraction and intracellular Ca(2+) transients in isolated adult rat ventricular myocytes. Vascul Pharmacol. 2003;40:213-217. [PubMed] [DOI] |
| 5. | Perry MD, Sandle GI. Regulation of colonic apical potassium (BK) channels by cAMP and somatostatin. Am J Physiol Gastrointest Liver Physiol. 2009;297:G159-G167. [PubMed] [DOI] |
| 8. | Wang F, Zhou HY, Zhao G, Fu LY, Cheng L, Chen JG, Yao WX. Inhibitory effects of berberine on ion channels of rat hepatocytes. World J Gastroenterol. 2004;10:2842-2845. [PubMed] |
| 9. | Sandle GI, Warhurst G, Butterfield I, Higgs NB, Lomax RB. Somatostatin peptides inhibit basolateral potassium channels in human colonic crypts. Am J Physiol. 1999;277:G967-G975. [PubMed] |
| 10. | Joiner WJ, Basavappa S, Vidyasagar S, Nehrke K, Krishnan S, Binder HJ, Boulpaep EL, Rajendran VM. Active K+ secretion through multiple KCa-type channels and regulation by IKCa channels in rat proximal colon. Am J Physiol Gastrointest Liver Physiol. 2003;285:G185-G196. [PubMed] |
| 11. | Lam RS, Shaw AR, Duszyk M. Membrane cholesterol content modulates activation of BK channels in colonic epithelia. Biochim Biophys Acta. 2004;1667:241-248. [PubMed] |