修回日期: 2010-09-20
接受日期: 2010-09-27
在线出版日期: 2010-11-08
目的: 研究甘草酸二铵(DG)对大鼠溃疡性结肠炎(UC)的疗效及对大鼠外周血单个核细胞中Foxp3 mRNA表达的影响, 继而从自身免疫方面探讨DG治疗大鼠UC的作用机制.
方法: 用2, 4, 6-三硝基苯磺酸(TNBS)/乙醇灌肠复制大鼠UC模型, 健康雌性SD大鼠随机分为正常对照组、模型组、DG组[40 mg/(kg•d)], 每组10只. 造模10 d后, 收集标本, 观察大鼠疾病活动指数(DAI)、组织学改变, 应用RT-PCR半定量检测大鼠外周血单个核细胞中Foxp3 mRNA的表达水平.
结果: 正常对照组、模型组和DG组的DAI评分分别为0.3±0.6, 7.1±0.2, 3.1±0.6; 组织学损伤评分分别为0.9±0.2, 6.7±0.5, 3.3±0.4, 与正常对照组相比, DG组、模型组上述指标评分均显著增高(P<0.05); 而与模型组相比, DG组能显著改善UC症状(P<0.05). 模型组大鼠Foxp3 mRNA水平低于正常组(0.51±0.34 vs 1.09±0.38, P<0.05); 与模型组相比, DG组Foxp3 mRNA的表达显著升高(0.92±0.53 vs 0.51±0.34, P<0.05).
结论: DG可显著改善大鼠UC, 通过上调外周血单个核细胞中Foxp3 mRNA的表达抑制自身反应性T淋巴细胞的增殖可能是其机制之一.
引文著录: 原皓, 崔慎茹, 李时光. 甘草酸二铵对溃疡性结肠炎大鼠Foxp3 mRNA表达的影响. 世界华人消化杂志 2010; 18(31): 3301-3305
Revised: September 20, 2010
Accepted: September 27, 2010
Published online: November 8, 2010
AIM: To evaluate the protective effect of diammonium glycyrrhizinate (DG) against ulcerative colitis in rats and to investigate potential mechanisms involved.
METHODS: Thirty Sprague-Dawley (SD) rats were equally randomized into normal control group, model group and DG group. Ulcerative colitis was induced in the DG group and model group by rectal administration of trinitrobenzene sulphonic acid (TNBS). Disease activity index (DAI) and histological damage were evaluated, and the expression of forkhead box P3 (Foxp3) mRNA in peripheral blood mononuclear cells (PBMCs) was detected by reverse transcription-polymerase chain reaction (RT-PCR).
RESULTS: Both DAI and histological damage score were significantly higher in the model group than in the normal control group (DAI: 7.1 ± 0.2 vs 0.3 ± 0.6, P < 0.05; histological damage score: 6.7 ± 0.5 vs 0.9 ± 0.2, P < 0.05). Compared with the model group, DAI and histological damage score were significantly improved in the DG group (DAI: 3.1 ± 0.6 vs 7.1 ± 0.2, P < 0.05; histological damage score: 3.3 ± 0.4 vs 6.7 ± 0.5, P < 0.05). Compared with the normal control group, the expression of Foxp3 mRNA was down-regulated in PBMCs in the model group (0.51 ± 0.34 vs 1.09 ± 0.38, P < 0.05). DG treatment significantly up-regulated the expression of Foxp3 mRNA in PBMCs (0.92 ± 0.53 vs 0.51 ± 0.34, P < 0.05).
CONCLUSION: DG can ameliorate colonic inflammation in rats with ulcerative colitis possibly by increasing the expression of Foxp3 mRNA in PBMCs.
- Citation: Yuan H, Cui SR, Li SG. Diammonium glycyrrhizinate up-regulates the expression of Foxp3 mRNA in rats with ulcerative colitis. Shijie Huaren Xiaohua Zazhi 2010; 18(31): 3301-3305
- URL: https://www.wjgnet.com/1009-3079/full/v18/i31/3301.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i31.3301
溃疡性结肠炎(ulcerative colitis, UC)是一种慢性、非特异性结肠炎症性肠病, 主要累及结肠黏膜和黏膜下层, 病因和发病机制至今仍不明确, 目前认为主要与遗传、感染、环境、免疫等多因素有关[1-3]. 其传统治疗药物有氨基水杨酸制剂、糖皮质激素以及免疫抑制剂等, 虽能控制大多数患者的症状, 但长期使用不良反应比较大[4,5]. 甘草酸二铵(diammonium glycyrrhizinate, DG)是甘草有效成分的第3代提取物, 并且是甘草活性成分甘草次酸的左旋构型, 目前主要用于治疗肝炎等疾病, 该药不仅有与皮质类固醇类似的非特异性抗炎作用, 而且有镇痛、保护膜结构、抗脂质氧化、改善肝功能及调节免疫等生物活性[6]. 其特点是疗效好, 不良反应小, 更主要的是激素样的不良反应小. 我们初步的研究已证实DG对UC有明显的治疗作用[7-9]. 本实验旨在进一步明确DG对UC大鼠的治疗作用, 并通过研究其对UC大鼠外周血单个核细胞叉头状/翅膀状螺旋转录因子(forkhead/winged helix transcription factor, Foxp3)mRNA的表达水平的影响, 继而从免疫方面探讨DG治疗大鼠UC可能的作用机制, 为其治疗UC提供一定的理论依据.
健康♀Spragur-Dawley(SD)大鼠, 体质量230 g±10 g, 购自山东中医药大学实验动物中心. 主要试剂: 2, 4, 6-三硝基苯磺酸(TNBS)购自Sigma公司; DG注射液(商品名: 甘利欣, 批号: H10940190, 江苏正大天晴药业股份有限公司); 大鼠淋巴细胞分离液(CLS1083)、PCR(Taq)扩增试剂盒(SK2501, 上海生工公司); GAPDH、Foxp3引物(上海生工公司合成).
1.2.1 造模及分组: 将30只健康♀SD大鼠适应性喂养1 wk后随机分为3组, 每组10只, 禁食不禁水24 h, 10%水合氯醛4.5 mL/kg腹腔注射麻醉, 参照文献方法, TNBS与无水乙醇以1∶1比例混匀, 根据大鼠禁食后体质量将TNBS以50-60 mg/kg计算出DG组和模型组每只大鼠所需的混合药液体积, 用聚乙烯导管经肛门缓慢插入结肠8 cm后, 将混合药液注入肠腔, 正常对照组大鼠仅灌注等量生理盐水. 根据人与大鼠的药物剂量折算系数算出DG的应用剂量, 并用生理盐水稀释至2 mL, 腹腔注入; 造模当天作为第1天, DG组第1-10天腹腔注射DG[(40 mg/(kg•d)]; 模型组第1-10天腹腔注射2 mL生理盐水; 正常对照组第1-10天腹腔注射2 mL生理盐水.
1.2.2 标本的制备: 造模10 d时, 进行组织学评分, 后用10%水合氯醛腹腔注射麻醉大鼠, 心脏采血1 mL, 肝素抗凝, 稀释后的血液缓慢加入等体积的淋巴细胞分离液中, 2 000 r/min离心20 min, 分离出单个核细胞, 再加入5倍体积9 g/L生理盐水, 2 000 r/min离心10 min, 洗涤2次, 加入TRIzol(Invitrogen公司)后, -80 ℃保存. 处死动物, 取距肛门约8 cm的结肠组织, 沿肠系膜纵轴剪开, 冷生理盐水冲洗干净, 肉眼进行大体形态观察, 滤纸吸干称质量, 4%多聚甲醛固定, HE染色观察组织学改变.
1.2.3 结肠炎症的评价: 采用疾病活动指数(disease activity index, DAI)及组织学损伤评分来评价结肠炎症. (1)DAI评分: 造模后10 d, 综合大鼠体质量下降百分率(体质量不变为0, 1-5为1分, 6-10为2分, 11-15为3分, >15为4分), 大便黏稠度(正常为0, 松散大便为2分, 腹泻为4分)和大便出血(正常0分, 隐血阳性为2分, 显性出血为4分)进行积分[10]. (2)组织学损伤评分: 选10个视野(×100)平均评分. 评分标准: 正常结肠黏膜记0分; 隐窝缺损1/3时记1分; 隐窝缺损2/3记2分; 固有层覆盖单层上皮伴轻度炎性细胞浸润记3分; 黏膜糜烂、溃疡伴显著炎性细胞浸润记4分.
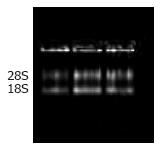
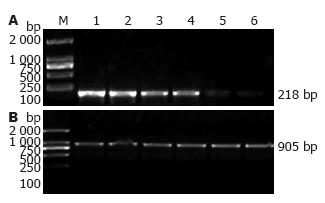
1.2.4 RT-PCR半定量检测外周血单个核细胞Foxp3 mRNA的表达: 标本27例, 其中DG组10例, 模型组7例(造模过程中有3例死亡), 正常对照组10例. (1)总RNA的提取: 从-80 ℃冰箱中取出外周血单个核淋巴细胞, 彻底混匀, 室温静置5 min, 加入0.2 mL氯仿, 震动15 s, 室温静置2 min; 4 ℃ 12 000 r/min离心15 min, 轻吸出上层水相至另一EP管, 加等体积异丙醇, 混匀静置10 min; 4 ℃ 12 000 r/min离心5 min; 弃上清, 加入0.7 mL 70%乙醇洗涤沉淀, 4 ℃ 12 000 r/min离心2 min; 吸干乙醇, 空气中干燥; 加入20 μL无RNA酶水溶解RNA. (2)RNA纯度和含量的测定: 取5 μL抽提的RNA样品上样电泳, 在12 g/L普通琼脂糖凝胶图谱中显示28S, 18S两条带, 且28S带亮度为18S带亮度两倍者入选. 紫外分光光度计检测RNA在260 nm, 280 nm波长处的吸光度值, 并计算A260/A280值和RNA浓度[浓度(mg/L) = A260×40×稀释倍数]. (3)cDNA的合成: 配置20 μL逆转录反应体系, 其中M-MLV逆转录酶1 μL, DNTP l μL. Oligo(dT)1 μL, Buffer 4 μL, 无RNA水10 μL, 标本RNA 3 μL, 加入EP管中, 15 000 r/min 4 ℃离心10 min, 弃上清, 加入适量无RNA水, 反复吹打至沉淀溶解. 瞬时离心后, 放入PCR仪, 37 ℃ 1 h. 95 ℃灭活5 min, 制作标本cDNA. (5)RT-PCR产物的检测: DNA扩增后, 琼脂糖凝胶电泳检测. 上游引物: 5'-GCTTGTTTGCTGTGCGGAGAC-3', 下游引物: 5'-GTTTCTGAAGTAGGCGAACAT-3', 扩增片段为218 bp, 在紫外线分析仪上观察结果, 分析RT-PCR产物的相对对含量. 设GAPDH作为内参照, 上游引物: 5'-AGTGGATATTGTTGCCATCAATG-3',下游引物: 5'-CCATGAGGTCCACCACCCTG-3', 扩增片段为905 bp. 为了消除样本提取、反转录和PCR反应过程中造成的差异, 以Foxp3 mRNA和GAPDH mRNA含量的比值, 作为Foxp3 mRNA的相对表达水平, 他是评价Foxp3 mRNA表达水平的指标.
统计学处理 数据用mean±SD表示, 用SPSS16.0软件进行统计分析. P<0.05为差异有统计学意义.
大鼠于造模后出现活动逐渐减少, 进食明显减少, 体质量减轻, 大便稀并有脓血便, 肛周污秽. 治疗后, DG组大鼠上述症状明显减轻, 5-7 d后粪便基本恢复正常, 肛周干净. 与正常对照组相比, DG组、模型组的DAI评分均显著增高(3.1±0.6, 7.1±0.2 vs 0.3±0.6, P<0.05); 而与模型组相比, DG组显著改善(P<0.05).
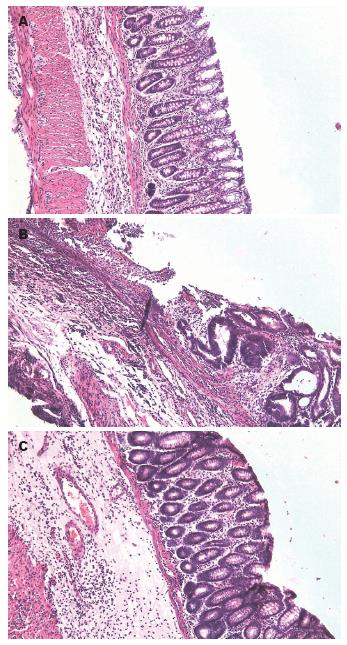
模型组大鼠结肠黏膜充血水肿, 局部形成浅表溃疡, 病变严重区呈黑褐色, 本实验成功复制了大鼠UC模型. DG组大鼠结肠轻度肿胀, 溃疡较浅, 较模型组明显减轻(图1).
正常组大鼠结肠黏膜上皮完整, 无溃疡, 间质可见少量白细胞. 模型组大鼠结肠部分肠上皮脱落, 大量炎性细胞浸润, 溃疡形成. DG组大鼠结肠上皮已得到不同程度修复, 炎性细胞浸润明显减轻. 与正常对照组相比, DG组、模型组的组织学损伤评分均显著增高(3.3±0.4, 6.7±0.5 vs 0.9±0.2, P<0.05); 而与模型组相比, DG组显著改善(图2).
模型组大鼠单个核细胞中Foxp3 mRNA的含量较正常组降低, 差异有统计学意义(0.51±0.34 vs 1.09±0.38, P<0.05); 与模型组相比, DG组单个核细胞中Foxp3 mRNA的含量增高, 差异有统计学意义(0.92±0.53 vs 0.51±0.34, P<0.05, 图4).
UC以腹痛、腹泻、黏液血便、里急后重为主要临床表现[11], 病情漫长者有发生癌变的可能性[12]. 流行病资料提示, UC的发病率不论是在国内和国外都有逐年增高的趋势[13,14], 但临床上至今没有特异性根治措施, 问题的关键是对其确切发病机制仍不清楚. 目前对炎症性肠病病因和发病机制的认识可概括为: 环境因素作用于遗传易感者, 在肠道菌丛(或者目前尚未明确的特异性微生物)的参与下, 启动了肠道免疫及非免疫系统, 最终导致免疫反应和炎症过程. 可能由于抗原的持续刺激和(或)免疫反应调节紊乱, 这种免疫反应表现为过度亢进和难于自限.
TNBS是一种半抗原物质, 乙醇作为有机溶剂溶解肠黏膜表面的黏液, 破坏肠黏膜屏障, 使TNBS与组织中大分子蛋白质结合后成为完全抗原, 导致针对肠黏膜的免疫反应, 从而诱发UC[15-17], 本实验成功复制了UC大鼠模型.
Foxp3是新近发现的转录因子, 属于forkhead家族成员, 通过其forkhead结构域与DNA特定位点结合, 调节目的基因的活化和表达[18], 主要表达于胸腺、脾脏和淋巴结等淋巴器官和组织, 在鼠类特异性表达于CD4+CD25+ Treg细胞[19,20], 其主要功能在于影响CD4+CD25+ Treg细胞的发育, CD4+CD25+ Treg细胞通过抑制性调节CD4+和CD8+ T淋巴细胞的活化与增殖, 而具有免疫的负向调节作用[21-24]. 近年来, 免疫紊乱参与了UC的发病机制这一认识已得到了基本的肯定[25-27], 因此, 研究Foxp3有利于从自身免疫方面探讨UC的发病机制.
在本实验中, 模型组大鼠外周血单个核细胞中Foxp3的表达比对照组低, 这与以往的研究检测UC患者单个核细胞中Foxp3 mRNA的表达结果一致[28,29]. 模型组大鼠外周血单个核细胞中Foxp3 mRNA的表达减少, 表明模型组大鼠体内存在表达Foxp3 mRNA的Treg细胞减少和(或)功能降低. 而与模型组相比, DG组却有明显的改善, Foxp3 mRNA的表达增加. 实验结果显示, DG能显著改善UC大鼠炎症, 上调外周血单个核细胞中Foxp3 mRNA的表达, 因此推测CD4+CD25+ Treg细胞通过Foxp3 mRNA的表达抑制自身反应性T淋巴细胞的增殖, 最终缓解病情, 这也表明DG对自身免疫方面有明显的抑制作用, 从而起到治疗UC的作用, 这一实验结果为该药的临床应用提供了一定的理论依据.
甘草酸二铵(DG)具有抗炎、调节免疫、抗过敏等药理作用, 目前临床上主要用于肝炎的治疗. 但探讨其治疗溃疡性结肠炎(UC)的作用及机制的报道不多.
戈之铮, 教授, 上海交通大学医学院附属仁济医院消化科
UC的传统治疗药物疗效确切, 但严重的副作用限制了其长期应用. 因此,寻找毒副作用小、适合于长期服用的治疗药物一直是研究的热点之一.
近年来研究发现, 免疫紊乱在UC的发病机制中起重要作用, 并且有研究证实, 消化性溃疡患者外周血及组织中有Foxp3基因的过量表达.
本研究用DG治疗UC, 并通过研究其对UC大鼠外周血单个核细胞Foxp3 mRNA表达水平的影响, 继而从免疫方面探讨其治疗大鼠UC可能的作用机制, 为其治疗UC提供一定的理论依据.
本研究发现, DG对大鼠UC有良好的治疗作用, 有可能成为UC有效而又不良反应小的治疗药物, 可扩大其临床应用范围.
本文设计合理, 为甘草酸二铵治疗UC提供一定的理论依据.
编辑 李薇 电编 何基才
| 1. | Brannigan AE, O'Connell PR, Hurley H, O'Neill A, Brady HR, Fitzpatrick JM, Watson RW. Neutrophil apoptosis is delayed in patients with inflammatory bowel disease. Shock. 2000;13:361-366. [PubMed] [DOI] |
| 2. | Neurath MF, Finotto S, Fuss I, Boirivant M, Galle PR, Strober W. Regulation of T-cell apoptosis in inflammatory bowel disease: to die or not to die, that is the mucosal question. Trends Immunol. 2001;22:21-26. [PubMed] [DOI] |
| 3. | Suzuki A, Sugimura K, Ohtsuka K, Hasegawa K, Suzuki K, Ishizuka K, Mochizuki T, Honma T, Narisawa R, Asakura H. Fas/Fas ligand expression and characteristics of primed CD45RO+ T cells in the inflamed mucosa of ulcerative colitis. Scand J Gastroenterol. 2000;35:1278-1283. [PubMed] [DOI] |
| 5. | Martínez-Montiel MP, Muñoz-Yagüe MT. Biologic therapies for chronic inflammatory bowel disease. Rev Esp Enferm Dig. 2006;98:265-291. [PubMed] |
| 8. | Yuan H, Ji WS, Wu KX, Jiao JX, Sun LH, Feng YT. Anti-inflammatory effect of Diammonium Glycyrrhizinate in a rat model of ulcerative colitis. World J Gastroenterol. 2006;12:4578-4581. [PubMed] |
| 10. | Porter SN, Howarth GS, Butler RN. An orally administered growth factor extract derived from bovine whey suppresses breath ethane in colitic rats. Scand J Gastroenterol. 1998;33:967-974. [PubMed] [DOI] |
| 11. | Kornbluth A, Sachar DB. Ulcerative colitis practice guidelines in adults: American College Of Gastroenterology, Practice Parameters Committee. Am J Gastroenterol. 2010;105:501-23; quiz 524. [PubMed] [DOI] |
| 12. | Eaden J, Abrams K, Ekbom A, Jackson E, Mayberry J. Colorectal cancer prevention in ulcerative colitis: a case-control study. Aliment Pharmacol Ther. 2000;14:145-153. [PubMed] [DOI] |
| 13. | Russel MG. Changes in the incidence of inflammatory bowel disease: what does it mean? Eur J Intern Med. 2000;11:191-196. [PubMed] [DOI] |
| 14. | Jiang XL, Cui HF. An analysis of 10218 ulcerative colitis cases in China. World J Gastroenterol. 2002;8:158-161. [PubMed] |
| 16. | Kunin S, Gallily R. Recognition and lysis of altered-self cells by macrophages. I. Modification of target cells by 2,4,6-trinitrobenzene sulphonic acid. Immunology. 1983;48:265-272. [PubMed] |
| 17. | Grisham MB, Volkmer C, Tso P, Yamada T. Metabolism of trinitrobenzene sulfonic acid by the rat colon produces reactive oxygen species. Gastroenterology. 1991;101:540-547. [PubMed] |
| 18. | Bassuny WM, Ihara K, Sasaki Y, Kuromaru R, Kohno H, Matsuura N, Hara T. A functional polymorphism in the promoter/enhancer region of the FOXP3/Scurfin gene associated with type 1 diabetes. Immunogenetics. 2003;55:149-156. [PubMed] [DOI] |
| 19. | Anderson MS, Venanzi ES, Klein L, Chen Z, Berzins SP, Turley SJ, von Boehmer H, Bronson R, Dierich A, Benoist C. Projection of an immunological self shadow within the thymus by the aire protein. Science. 2002;298:1395-1401. [PubMed] [DOI] |
| 20. | Ramsdell F. Foxp3 and natural regulatory T cells: key to a cell lineage? Immunity. 2003;19:165-168. [PubMed] [DOI] |
| 21. | Coffer PJ, Burgering BM. Forkhead-box transcription factors and their role in the immune system. Nat Rev Immunol. 2004;4:889-899. [PubMed] [DOI] |
| 22. | Brunkow ME, Jeffery EW, Hjerrild KA, Paeper B, Clark LB, Yasayko SA, Wilkinson JE, Galas D, Ziegler SF, Ramsdell F. Disruption of a new forkhead/winged-helix protein, scurfin, results in the fatal lymphoproliferative disorder of the scurfy mouse. Nat Genet. 2001;27:68-73. [PubMed] [DOI] |
| 23. | Fontenot JD, Rudensky AY. A well adapted regulatory contrivance: regulatory T cell development and the forkhead family transcription factor Foxp3. Nat Immunol. 2005;6:331-337. [PubMed] [DOI] |
| 24. | Morgan ME, van Bilsen JH, Bakker AM, Heemskerk B, Schilham MW, Hartgers FC, Elferink BG, van der Zanden L, de Vries RR, Huizinga TW. Expression of FOXP3 mRNA is not confined to CD4+CD25+ T regulatory cells in humans. Hum Immunol. 2005;66:13-20. [PubMed] [DOI] |
| 25. | Kirsner JB. Historical origins of current IBD concepts. World J Gastroenterol. 2001;7:175-184. [PubMed] |
| 26. | Wu HG, Zhou LB, Shi DR, Liu SM, Liu HR, Zhang BM, Chen HP, Zhang LS. Morphological study on colonic pathology in ulcerative colitis treated by moxibustion. World J Gastroenterol. 2000;6:861-865. [PubMed] |
| 27. | MacDonald TT, Monteleone G, Pender SL. Recent developments in the immunology of inflammatory bowel disease. Scand J Immunol. 2000;51:2-9. [PubMed] [DOI] |
| 29. | Maul J, Loddenkemper C, Mundt P, Berg E, Giese T, Stallmach A, Zeitz M, Duchmann R. Peripheral and intestinal regulatory CD4+ CD25(high) T cells in inflammatory bowel disease. Gastroenterology. 2005;128:1868-1878. [PubMed] [DOI] |