修回日期: 2009-12-19
接受日期: 2009-12-21
在线出版日期: 2010-01-28
目的: 探讨长期应用川芎嗪对大鼠结肠黏膜阴离子分泌的影响.
方法: 健康SD大鼠分为两组: 川芎嗪组[腹腔注射川芎嗪40 mg/(kg•d)]和对照组(腹腔注射等量生理盐水), 7 d后剥离结肠黏膜, 采用短路电流技术并运用吲哚美辛和forsklin观察大鼠结肠黏膜阴离子的分泌.
结果: 对照组和川芎嗪组结肠黏膜的基础电流相比有显著差异(23.4 µA/cm2±2.2 µA/cm2vs 18.1 µA/cm2±2.2 µA/cm2, P<0.05); 预先加入前列腺素环化酶抑制剂-吲哚美辛后, 对照组和川芎嗪组结肠黏膜的基础电流相比无显著差异; 对照组和川芎嗪组分别加入腺苷酸环化酶的激动剂-forskolin后, 30 min内转运的电荷数的增加量有显著差异(47.9 mC/cm2±3.6 mC/cm2vs 27.1 mC/cm2±2.6 mC/cm2, P<0.01); 而川芎嗪组结肠黏膜30 min内转运的电荷数与川芎嗪组单纯加入forskolin后的短路电流相比差异无显著性.
结论: 川芎嗪可通过抑制结肠黏膜对前列腺素的自发分泌来降低阴离子的分泌.
引文著录: 段东晓, 刘素芳, 赵文超, 朱进霞, 邢莹. 长期应用川芎嗪对大鼠结肠黏膜阴离子分泌的影响. 世界华人消化杂志 2010; 18(3): 290-293
Revised: December 19, 2009
Accepted: December 21, 2009
Published online: January 28, 2010
AIM: To investigate the effects of long-term use of ligustrazine on anion secretion in rat colonic mucosa.
METHODS: Healthy Sprague-Dawley rats were divided into two groups: ligustrazine treatment group and control group. The treatment group and control group were injected intraperitoneally with ligustrazine [40 mg/(kg•d)] and normal saline [2 mL/(kg•d)], respectively. After treatment for 7 consecutive days, the anion secretion in colonic mucosa was investigated using short-circuit current (Isc) technique.
RESULTS: The basal current (BC) in colonic mucosa in the ligustrazine treatment group was significantly lower than that in the control group (23.4 µA/cm2 ± 2.2 µA/cm2vs 18.1 µA/cm2 ± 2.2 µA/cm2, P < 0.05). However, no significant difference was noted in the BC in colonic mucosa pretreated with indomethacin (10 µmoL/L), a prostaglandin synthesis inhibitor, between the two groups. After addition of forskolin, an activator of adenylyl cyclase, the increase in charge density in 30 minutes was higher in the control group than in the ligustrazine treatment group(47.9 mC/cm2 ± 3.6 mC/cm2vs 27.1 mC/cm2 ± 2.6 mC/cm2, P < 0.01). In contrast, no significant difference was noted in forskolin-induced increase in charge density in colonic mucosa pretreated with indomethacin between the two groups.
CONCLUSION: Long-term treatment with ligustrazine inhibits anion secretion in rat colonic mucosa by decreasing the synthesis of prostaglandin.
- Citation: Duan DX, Liu SF, Zhao WC, Zhu JX, Xing Y. Long-term use of ligustrazine suppresses anion secretion in rat colonic mucosa. Shijie Huaren Xiaohua Zazhi 2010; 18(3): 290-293
- URL: https://www.wjgnet.com/1009-3079/full/v18/i3/290.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i3.290
结肠黏膜通过分泌阴离子, 继发性地引起水的分泌, 其可以调节机体的水、电解质平衡, 促进结肠内容物的排出, 中和肠腔内细菌产生的酸, 进而保护肠黏膜. 川芎嗪是中国传统中药川芎所含的一种活性成分, 化学结构为四甲基吡嗪(tetramethylpyrazine, TMP; C8H12N2), 是从中药伞形科植物川芎中分离、提纯的生物碱单体, 其是白凤丸制剂中的活性成分, 因具有活血化淤、抗血小板聚集、扩张血管、改善微循环障碍等作用, 临床上广泛应用于心血管系统、呼吸系统以及消化系统疾病的治疗. 有研究表明[1-3], 川芎嗪可以促进大鼠离体结肠黏膜分泌阴离子, 这一过程与细胞内的前列腺素有着密切的关系. 但是长期在体应用川芎嗪对结肠黏膜阴离子分泌的影响是否与前列腺素有关并不清楚. 本实验以大鼠远端结肠黏膜为研究对象, 采用短路电流技术和前列腺素环化酶抑制剂等工具药观察了长期应用川芎嗪对结肠黏膜阴离子分泌的影响.
健康SD大鼠, ♂, 8-12 wk, 由郑州大学实验动物中心提供(许可证号SYXK豫2007-0009). 盐酸川芎嗪购自北京第四制药厂, 批号: 京卫药准字(1996)第104078号; 吲哚美辛、forskolin及配制盐溶液的试剂均购自Sigma公司.
1.2.1 分组: 实验大鼠随机分为两组: 川芎嗪组[腹腔注射川芎嗪40 mg/(kg•d)]和对照组[腹腔注射生理盐水2 mL/(kg•d)], 连续注射7 d后, 剥离结肠黏膜, 进行实验.
1.2.2 结肠黏膜的制备: 用1 000 mL/L CO2使大鼠窒息, 迅速取5-6 cm远端结肠, 沿肠系膜纵向切开, 用通有950 mL/L O2和50 mL/L CO2的Krebs-Henseleit溶液将组织的黏膜面冲洗干净, 黏膜面朝下固定在容器中, 容器底部铺有一层Sylgard 184硅胶用于固定黏膜, 容器中盛有上述通入混合气的溶液. 用顶端精细的镊子, 在解剖显微镜下, 小心将黏膜下层, 肌层和浆膜层与黏膜层钝性分离, 得到一薄层组织, 包括上皮层和一些粘连的结缔组织, 将其切成面积约0.6 cm×0.6 cm的小块.
1.2.3 Krebs-Henseleit solution(KHS)的配制: KHS配制由以下成分构成(mmoL/L): NaCl: 117, KCl: 4.7, MgCl2·6H2O: 1.2, KH2PO4: 1.2, NaHCO3: 24.8, CaCl2·2H2O: 2.56, 葡萄糖: 11.1.
1.2.4 短路电流的测定: 实验在Ussing室装置上进行, Acquire软件处理实验结果. Ussing室装置由A、B室、电极、短路电流仪(physiologic instruments, VCC MC6)、前置放大器、37 ℃温水循环系统以及供氧系统组成. 标本台有一0.45 cm2的圆形通道连接A室和B室, 将结肠黏膜固定于A室和B室之间的标本台上, 结肠黏膜的腔面膜朝向A室, 基底膜朝向B室, 从而将圆形通道完全阻断. 将电流电极和电压电极固定于标本台上进行电流和电压的记录. A室和B室中均匀缓慢地加入KHS, 每侧均为5 mL, 37 ℃温水循环系统保持A室和B室中KHS的温度, 供氧系统给KHS持续充氧. 实验结果通过前置放大器和短路电流仪被Acquire软件纪录.
统计学处理 采用SPSS软件包对实验数据进行处理, 各组数据均用mean±SD表示, 组间比较采用t检验, 检验水准α = 0.05.
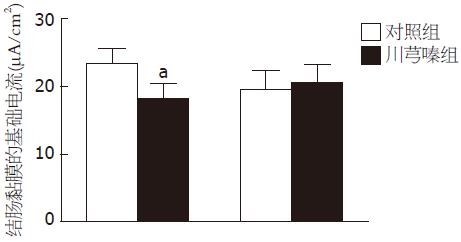
在正常KHS中, 对照组结肠黏膜的基础电流为23.4 µA/cm2±2.2 µA/cm2(n = 16), 川芎嗪组结肠黏膜的基础电流为18.1 µA/cm2±2.2 µA/cm2(n = 15), 相对于对照组减少约23%(P<0.05); 在黏膜的基底膜预先加入前列腺素环化酶抑制剂-吲哚美辛(10 µmoL/L)1 h后, 对照组结肠黏膜的基础电流为19.5 µA/cm2±2.9 µA/cm2(n = 10), 川芎嗪组结肠黏膜的基础电流为20.6 µA/cm2±2.7 µA/cm2(n = 9), 相对于对照组没有明显变化(P>0.05, 图1).
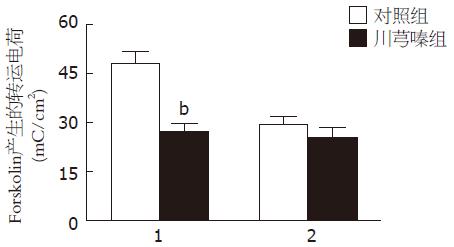
对照组和川芎嗪组结肠黏膜的基底膜分别加入腺苷酸环化酶的激动剂-forskolin(1 µmoL/L)后, 短路电流均升高, 在30 min内转运的电荷数分别增加了47.9 mC/cm2±3.6 mC/cm2(n = 10)和27.1 mC/cm2±2.6 mC/cm2(n = 9), 两者相比差异有显著性(P<0.01, 图2).
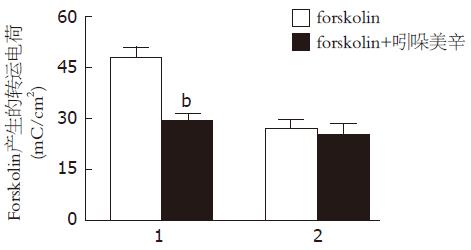
对照组结肠黏膜的基底膜预先加入吲哚美辛(10 µmoL/L)后, 再加入forskolin(1 µmoL/L), 结肠黏膜在30 min内转运的电荷数增加了29.3 mC/cm2±2.2 mC/cm2(n = 6, 图2), 相对于对照组单纯加入forskolin产生的短路电流减少大约61%(P<0.01, 图3); 在川芎嗪组结肠黏膜的基底膜预先加入吲哚美辛(10 µmoL/L)后, 再加入forskolin(1 µmoL/L), 结肠黏膜在30 min内转运的电荷数增加了25.4 mC/cm2±2.8 mC/cm2(n = 7, 图2), 相对于川芎嗪组单纯加入forskolin后产生的短路电流, 没有明显变化(P>0.05, 图3), 与对照组相比差异无显著性
(图2).
本研究中采用的短路电流技术是由丹麦科学家Ussing及Zerahn最先用于研究青蛙皮肤上皮钠离子主动吸收的过程, 他们改进了灌流装置, 灌流小室因此被命名为Ussing小室[4]. 此后短路电流技术被广泛地应用于研究不同组织中离子的跨膜上皮转运.
川芎嗪是中国传统药用草本植物川芎所含的一种生物碱, 具有多种生理功能[5], 在临床上应用于多种疾病的治疗[6]. 在先前的研究中发现, 川芎嗪可以促进离体结肠黏膜分泌阴离子[7-9], 这一过程与细胞内的前列腺素有着密切的关系. 川芎嗪可以通过结肠上皮细胞基底膜的Na+-K+-2Cl-共转运体(NKCC)促进结肠黏膜分泌Cl-和HCO3-, NKCC存在着对cAMP敏感的磷酸化位点, 细胞内cAMP的增加可以加强NKCC的活动[10-14]. 结肠黏膜本身可以合成前列腺素, 作用于结肠黏膜的腺苷酸环化酶, 引起细胞内的cAMP浓度增加, 再通过PKA刺激结肠黏膜分泌阴离子. 本实验中选用了工具药前列腺素环化酶抑制剂吲哚美辛和腺苷酸环化酶的激动剂forsklin来探讨川芎嗪促进结肠黏膜分泌阴离子的机制.
在正常情况下, 川芎嗪组的基础电流明显低于对照组, 说明川芎嗪组结肠黏膜的离子转运与对照组不同, 但是预先加入前列腺素环化酶抑制剂后, 川芎嗪组和对照组的基础电流没有明显差异, 这一结果说明川芎嗪组基础电流的偏低与细胞内的前列腺素有关. 在正常情况下, 结肠黏膜可以自发地分泌前列腺素, 然后通过升高细胞内的cAMP来促进阴离子的分泌. 预先加入前列腺素环化酶抑制剂后, 消除了结肠黏膜自发产生的前列腺素的作用, 此时结肠黏膜的阴离子分泌为单纯的自发分泌, 在这种情况下, 川芎嗪组和对照组的基础电流没有明显差异, 说明川芎嗪组基础电流偏低的原因可能是由于前列腺素的自发分泌减少, 从而造成阴离子的分泌减少所导致[15].
正常情况下, 在川芎嗪组和对照组结肠黏膜的基底膜加入forskolin后, 均引起了短路电流的升高, 但是川芎嗪组的升高幅度明显低于对照组. 但是预先加入前列腺素环化酶抑制剂后, 再加入forskolin, 川芎嗪组升高的短路电流幅度不变, 而对照组升高的短路电流幅度则降低到川芎嗪组的水平, 这一结果表明, forskolin在对照组结肠黏膜可以通过前列腺素引起阴离子的分泌加大, 而川芎嗪组则不行, 这也进一步验证了长期注射川芎嗪可以导致结肠黏膜自发分泌前列腺素的减少.
川芎嗪为治疗心脑血管疾病的常用药, 但长期临床应用后患者反映出现消化系功能的改变. 近来研究发现, 长期应用川芎嗪可以促进大鼠结肠黏膜上皮细胞分泌的阴离子增多, 主要包括Cl-和HCO3-, 其作用机制尚不清楚.
唐文富, 副教授, 四川大学华西医院中西医结合科.
本研究采用短路电流技术, 利用吲哚美辛和forsklin探讨川芎嗪对结肠黏膜阴离子分泌的影响及其机制.
本研究证实, 川芎嗪可通过抑制结肠黏膜对前列腺素的自发分泌来降低阴离子的分泌, 为长期应用川芎嗪对结肠黏膜分泌机制的研究提供理论基础.
本研究探讨了长期应用川芎嗪对大鼠结肠黏膜阴离子分泌的影响, 具有较好的学术价值, 但川芎嗪在该作用中的机制仍需进一步研究.
编辑: 李军亮 电编:吴鹏朕
| 4. | Ussing HH, Zerahn K. Active transport of sodium as the source of electric current in the short-circuited isolated frog skin. Reprinted from Acta. Physiol. Scand. 23: 110-127, 1951. J Am Soc Nephrol. 1999;10:2056-2065. [PubMed] [DOI] |
| 6. | 孟 庆年. 川芎嗪注射液加补阳还五汤治疗急性脑梗死38例. 中西医结合实用临床急救. 1999;6:12. |
| 7. | 邢 莹, 何 琼, 朱 进霞, 陈 小章. 川芎嗪在促进大鼠结肠上皮细胞Cl-和HCO3-分泌中的作用. 郑州大学学报(医学版). 2004;39:66-70. |
| 8. | Zhao WC, Duan DX, Wang ZJ, Tang N, Yan M, Zhang GH, Xing Y. The underlying cellular mechanism in the effect of tetramethylpyrazine on the anion secretion of colonic mucosa. Jpn J Physiol. 2005;55:325-329. [PubMed] [DOI] |
| 9. | Liang SD, Xu CS, Zhou T, Liu HQ, Gao Y, Li GL. Tetramethylpyrazine inhibits ATP-activated currents in rat dorsal root ganglion neurons. Brain Res. 2005;1040:92-97. [PubMed] [DOI] |
| 10. | Wertheimer EV, Salicioni AM, Liu W, Trevino CL, Chavez J, Hernández-González EO, Darszon A, Visconti PE. Chloride Is essential for capacitation and for the capacitation-associated increase in tyrosine phosphorylation. J Biol Chem. 2008;283:35539-35550. [PubMed] [DOI] |
| 11. | McDaniel N, Pace AJ, Spiegel S, Engelhardt R, Koller BH, Seidler U, Lytle C. Role of Na-K-2Cl cotransporter-1 in gastric secretion of nonacidic fluid and pepsinogen. Am J Physiol Gastrointest Liver Physiol. 2005;289:G550-G560. [PubMed] [DOI] |
| 12. | Seidler U, Bachmann O, Jacob P, Christiani S, Blumenstein I, Rossmann H. Na+/HCO3- cotransport in normal and cystic fibrosis intestine. JOP. 2001;2:247-256. [PubMed] |
| 13. | Worrell RT, Oghene J, Matthews JB. Ammonium effects on colonic Cl- secretion: anomalous mole fraction behavior. Am J. Physiol Gastrointest Liver Physiol. 2004;286:G14-G22. [PubMed] [DOI] |
| 14. | Marshall WS, Howard JA, Cozzi RR, Lynch EM. NaCl and fluid secretion by the intestine of the teleost Fundulus heteroclitus: involvement of CFTR. J Exp Biol. 2002;205:745-758. [PubMed] |
| 15. | He Q, Zhu JX, Xing Y, Tsang LL, Yang N, Rowlands DK, Chung YW, Chan HC. Tetramethylpyrazine stimulates cystic fibrosis transmembrane conductance regulator-mediated anion secretion in distal colon of rodents. World J Gastroenterol. 2005;11:4173-4179. [PubMed] |