修回日期: 2009-12-14
接受日期: 2009-12-21
在线出版日期: 2010-01-28
目的: 构建尾型同源盒基因Cdx2 RNA干扰(RNAi)慢病毒表达载体并进行鉴定.
方法: 选取Cdx2基因的19 nt特异性序列, 设计针对Cdx2的shRNA序列, 应用基因重组技术插入到pLentiLox3.7(pLL3.7)慢病毒表达载体中, Xba I和 Not I进行双酶切和DNA测序鉴定重组克隆, 重组病毒质粒及其3种辅助包装原件载体质粒通过LipofectamineTM2000共转染293T细胞, 培养48 h后, 收集细胞培养上清液, 将其浓缩后在293T细胞中测定病毒滴度.
结果: 通过对pLL-Cdx2-shRNA载体进行双酶切鉴定, 证实短发夹RNA正确插入慢病毒载体, DNA测序证实插入的序列正确, Cdx2基因RNA干扰重组慢病毒载体经293T细胞包装成功, 收集293T细胞分泌的病毒上清测定病毒的滴度为5×107 TU/mL.
结论: 成功构建人Cdx2基因RNAi慢病毒载体, 为研究Cdx2对胃癌生长的影响提供了稳定感染细胞载体.
引文著录: 钱倩, 王晓通, 谢玉波, 李雷, 肖强. Cdx2基因RNA干扰慢病毒载体的构建与鉴定. 世界华人消化杂志 2010; 18(3): 245-249
Revised: December 14, 2009
Accepted: December 21, 2009
Published online: January 28, 2010
AIM: To construct a lentiviral vector for RNA interference (RNAi) of the caudal-related homeobox 2 (Cdx2) gene.
METHODS: A pair of complementary small hairpin RNA (shRNA) oligonucleotides targeting the Cdx2 gene were designed, synthesized, annealed and inserted into linearized pLentiLox3.7 vector. The recombinant plasmid was identified by double restriction digestion with Xba I/Not I and DNA sequencing. The recombinant plasmid and a lentivirus packaging mix were co-transfected into 293T cells to obtain packaged lentivirus particles. Viral titer was then determined.
RESULTS: Double restriction digestion analysis and DNA sequencing showed that the shRNA sequence was successfully inserted into the pLentiLox3.7 vector. The recombinant lentiviral vector harboring shRNA targeting the Cdx2 gene was successfully transfected into 293T cells. The recombinant lentivirus harvested from 293T cells had a titer of 5×107 TU/mL.
CONCLUSION: A lentiviral shRNA expression vector targeting the Cdx2 gene is successfully constructed and can be used for further study of the role of the Cdx2 gene in the pathogenesis of gastric cancer.
- Citation: Qian Q, Wang XT, Xie YB, Li L, Xiao Q. Construction and identification of a lentiviral vector for RNA interference of the Cdx2 gene. Shijie Huaren Xiaohua Zazhi 2010; 18(3): 245-249
- URL: https://www.wjgnet.com/1009-3079/full/v18/i3/245.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i3.245
Cdx称为尾侧型同源基因, 其家族主要有3个不同的家族成员Cdx1、Cdx2、Cdx3. 在正常生物体中, Cdx2对消化系统尤其是结肠和小肠上皮的发育起着关键的作用. 研究发现, 正常胃黏膜中没有Cdx2表达, 而在肠化生的初始阶段Cdx2表达量异常增高; 如果继续向癌变发展, Cdx2表达消失; 在最终形成的肠型胃癌中Cdx2表达再次出现异常[1-3]. 这些研究表明, Cdx2在胃癌肠化生中具有重要地位. RNAi(RNA interference)是21-23个核苷酸的小分子干扰RNA(small interfering RNA, siRNA)诱导细胞同源基因mRNA降解、从而特异性抑制基因表达的过程. 其作为一项可以高效、特异地降解靶基因mRNA的实验技术已被广泛应用于基因功能的研究[4]. 慢病毒载体来源于人类免疫缺陷病毒Ⅰ型(human immunodeficiency virus Ⅰ, HIV-Ⅰ), 既能感染分裂活跃的细胞, 又能高效率感染分裂缓慢或分裂期的细胞. 因此, 本研究通过构建Cdx2基因的小发夹RNA(short hairpin RNA, shRNA)慢病毒载体并进行鉴定, 为研究Cdx2沉默后对肿瘤生长的影响提供稳定的感染细胞载体.
混合包装载体质粒(pGag/Pol、pRev、pVSV-G)、pLL3.7慢病毒载体、293T细胞株购于上海吉玛公司; 大肠杆菌DH-5α为本实验室保存; 限制性内切酶XbaⅠ、XhoⅠ、HpaⅠ、NotⅠ、T4 DNA连接酶、PrimeSTARTM HS DNA多聚酶均购自大连宝生物公司; 1 kb Ladder购自广州东盛生物科技有限公司; DMEM、脂质体LipofectamineTM2000、Gibco胎牛血清购自Invitrogen公司(美国); 胶回收试剂盒、质粒抽提试剂盒购自Omega Biotek Inc公司(美国).
1.2.1 载体的构建和鉴定: pLL3.7为含U6启动子的RNA干扰专用载体. 针对人类Cdx2基因mRNA序列(NCBI GenBank, 基因编号: NM_005225), 利用GenScript公司网站上提供的"siRNA Target Finder Tool"设计软件, 设计靶向Cdx2基因siRNA寡核苷酸, 序列为5'-GACAAATATCGAGTGGTGTAC-3'. 设计一对针对此寡核苷酸的shDNA互补序列, loop结构选用了TTCAAGAGA以避免形成终止信号. 正义链模板的5'端添加了T, 与BbsⅠ酶切后形成的黏端互补; 反义链模板的5'端添加了AGCT, 与XhoⅠ酶切后形成的黏端互补, 由上海吉玛公司合成, 序列为5'-TGACAAATATCGAGTGGTGTACTTCAAGAGAGTACACCACTCGATATTTGTCTTTTTTC-3'; 5'-TCGAGAAAAAAGACAAATATCGAGTGGTGTACTCTCTTGAAGTACACCACTCGATATTTGTCA-3'. 将以上两合成片段5'端磷酸化, 互补片段退火, 与经XhoⅠ、HpaⅠ双酶切的pLL3.7片段进行连接反应. 将连接质粒命名为pLL-Cdx2-shRNA, 用一步法转化大肠埃希菌DH5α, 挑选阳性克隆, 培养并制备质粒, 用XbaⅠ、NotⅠ双酶切(XhoⅠ、HpaⅠ酶切位点已不存在)鉴定. 酶切鉴定正确的克隆送上海吉玛公司测序证实.
1.2.2 RNAi慢病毒的包装: 取对数生长期细胞293T细胞, 按照每孔1.2×106个细胞接种于6孔板中, 随机分为阴性对照组(PBS组)和实验组(pLL-Cdx2-shRNA组). 转染前2 h将细胞培养基更换为无血清培养基, 待细胞70%融合时分别将0.5 μg的PBS、慢病毒表达载体pLL-Cdx2-shRNA与1.5 μg的混合包装载体质粒(pGag/Pol、pRev、pVSV-G)混匀, 于250 μL opti-MEM去血清培养液中, 用6 μL LipofectamineTM2000共转染于相应的293T细胞组中. 转染后24 h换DMEM完全培养液(含1 μmol/L丙酮酸钠, 0.1 mmol/L非必需氨基酸). 由于慢病毒载体pLL3.7自身带有绿色荧光蛋白(GFP)报告基因, 48 h后可置于荧光显微镜下观察两组细胞绿色荧光蛋白的表达情况, 确定pLL-Cdx2-shRNA慢病毒载体质粒是否已被293T细胞包装. 72 h收集上清, 3 000 r/min离心20 min, 并经0.45 μm滤膜过滤后, 将病毒上清保存于-80 ℃下备用.
1.2.3 孔稀释法测定病毒滴度: 测定前1 d, 对293T细胞进行传代, 96孔板每孔加入约1.0×104个细胞, 体积100 μL. 将病毒储存液按梯度稀释(10-1-10-3), 选取所需的细胞孔, 吸弃90 μL培养液, 然后将稀释好的病毒液各10 μL依次加到细胞孔中, 继续放入37 ℃, 50 mL/L CO2培养箱中培养. 48 h后, 每孔加入100 μL新鲜培养液. 3-4 d后观察荧光表达, 正常情况下, 荧光细胞数随稀释倍数增加而相应减少, 计数最大稀释倍数孔中的带有荧光的细胞个数, 病毒滴度(TU/mL) = (荧光细胞个数×转染时细胞数/100×每孔加入病毒稀释液体积)×1/稀释浓度.
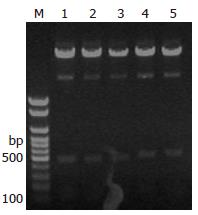
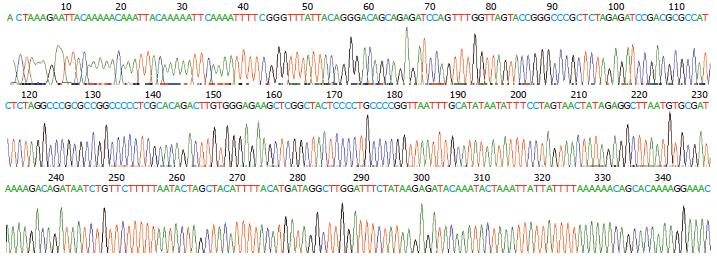
共挑取2个阳性克隆进行扩增抽提质粒, 使用限制性内切酶XbaⅠ和NotⅠ双酶切过夜, 进行电泳, 酶切结果表明质粒所在500 bp大小的均为阳性重组载体pLL-Cdx2-shRNA(图1); DNA测序结果证实Cdx2已正确插入pLL3.7, 序列与预期序列完全一致(图2).
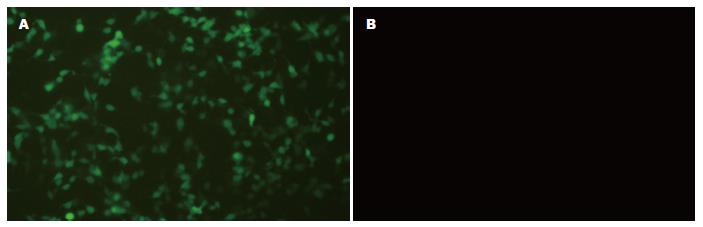
实验组293T细胞包装pLL-Cdx2-shRNA慢病毒载体质粒48 h后, 荧光显微镜下(×100)观察, 可见较多细胞发出绿色荧光, 而阴性对照组则无细胞发出绿色荧光(图3). 这说明293T细胞包装pLL-Cdx2-shRNA慢病毒质粒载体成功, 所收集的病毒颗粒为重组Cdx2基因RNAi的慢病毒颗粒.
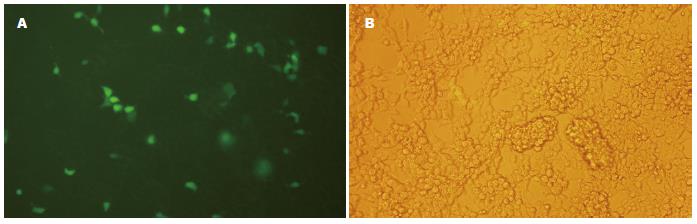
根据荧光显微镜和普通显微镜(×100)下同时观察293T细胞(图4), 在荧光显微镜下可观察到在加入10-3 μL病毒原液的孔中观察到50个带有荧光的细胞, 说明该孔中至少有50个病毒颗粒感染了细胞, 则病毒滴度 = (50×1.0×104/100×10)×1/10-3 = 5×107 TU/mL.
很多研究表明, Cdx2在肠化生以及胃癌发生发展过程中具有重要的作用[5]. 转染了Cdx2基因的胃癌组织出现了典型的凋亡形态学改变; 过表达Cdx2基因使得胃癌细胞细胞周期被阻滞在G0/G1期, 并且出现了细胞凋亡. 这些结果都显示, Cdx2基因参与了胃癌细胞的生长调控. Cdx2纯合子缺失将导致生长期小鼠死亡, 而Cdx2杂合子缺失则易导致错构瘤性息肉和管状腺癌的形成[6,7]. Boudreau等[8]的研究发现, 胃黏膜Cdx2异位表达之后发生的胃黏膜肠上皮化生可进展为胃息肉型腺癌, 并伴有p53、APC基因突变, 提示在Cdx2异位表达后合并发生其他分子事件是导致肠化生进展为胃癌的重要原因. 但是, Cdx2基因在调控细胞增生、控制细胞识别、决定细胞表型的过程中并不是唯一的控制因素, Cdx2蛋白的活性表达还需要其转录后修饰或其他转录因子之间的合作.
RNAi技术作为一项新的基因沉默技术, 具有较强的序列特异性, 由于其基因抑制效果确切, 具有级联式放大效应和高穿透性等特点, 因而在恶性肿瘤的研究中具有很好的应用前景[9]. 本实验采用基于慢病毒载体介导的shRNA生成的导入途径, shRNA由两个短反方向重复序列和1个loop环组成发夹结构, 由U6启动子控制, 随后再连上5-6个T作为RNA聚合酶Ⅲ的转录终止子[10]. shRNA作为介导子可引起特异性地降解相同序列的mRNA, 从而阻断相应基因表达的转录后基因沉默机制[11,12].
慢病毒载体是在HIV-Ⅰ病毒基础上改造成的病毒载体系统, 能高效地将目的基因(或RNAi)导入动物和人的原代细胞或细胞系. 慢病毒介导的基因表达或RNAi干扰作用持续且稳定, 目的基因可整合到宿主细胞基因组中, 随细胞基因组的分裂而分裂, 并能有效感染并整合到非分裂细胞中. 与其他病毒载体如不整合的腺病毒载体、整合率低的腺相关病毒载体、只整合分裂细胞的传统逆转录病毒载体相比, 慢病毒可将目的基因整合至靶细胞基因组长期表达, 同时扩大了载体感染细胞的范围, 适于体内基因治疗. 将其作为siRNA的携带者, 不但具备特异性地使基因表达沉默的能力, 还可以充分发挥病毒载体自身所具备的优势, 为研究基因功能提供了更强有力的工具[13-15].
在本研究中, 我们成功构建出Cdx2的RNAi慢病毒载体, 这将为今后更深入的研究Cdx2沉默后对肿瘤的生物学功能的影响打下坚实的基础, 为体内外实验研究提供可靠的技术平台.
胃癌是我国最常见的消化系肿瘤, 其年患病率和死亡率均为世界平均水平的2倍以上. 本研究中成功构建出Cdx2的RNAi慢病毒载体, 这将为今后更深入的研究Cdx2沉默后对胃癌的生物学功能的影响打下坚实的基础.
丁士刚, 主任医师, 北京大学第三医院消化科.
本研究利用细胞和现代分子生物学技术, 根据慢病毒介导的基因表达或RNAi干扰作用持续且稳定这一特点, 构建研究Cdx2的RNAi慢病毒载体, 将其作为siRNA的携带者, 不但具备特异性地使基因表达沉默的能力, 还可以充分发挥病毒载体自身所具备的优势, 为研究基因功能提供了更强有力的工具.
本研究构建的Cdx2的RNAi慢病毒载体, 可为进一步的体内体外实验研究提供可靠的技术平台, 为认识Cdx2沉默后对基因治疗胃癌提供新的依据.
慢病毒载体(LVs): 是在HIV-1病毒基础上改造而成的病毒载体系统, 他能高效将目的基因(或RNAi)导入动物和人的原代细胞或细胞系. 慢病毒载体基因组是正链RNA, 其基因组进入细胞后, 在细胞质中被其自身携带的反转录酶反转为DNA, 形成DNA整合前复合体, 进入细胞核后, DNA整合到细胞基因组中. 整合后的DNA转录mRNA, 回到细胞质中, 表达目的蛋白或产生RNAi干扰.
本文建构了Cdx2基因RNA干扰的慢病毒载体, 为后续的研究打下了一定的基础, 但理论上应进一步验证其干扰Cdx基因的表达效果.
编辑: 李军亮 电编:吴鹏朕
| 1. | Mutoh H, Sakurai S, Satoh K, Tamada K, Kita H, Osawa H, Tomiyama T, Sato Y, Yamamoto H, Isoda N. Development of gastric carcinoma from intestinal metaplasia in Cdx2-transgenic mice. Cancer Res. 2004;64:7740-7747. [PubMed] [DOI] |
| 2. | Yuasa Y. Control of gut differentiation and intestinal-type gastric carcinogenesis. Nat Rev Cancer. 2003;3:592-600. [PubMed] [DOI] |
| 4. | Arziman Z, Horn T, Boutros M. E-RNAi: a web application to design optimized RNAi constructs. Nucleic Acids Res. 2005;33:W582-W588. [PubMed] [DOI] |
| 5. | Baba Y, Nosho K, Shima K, Freed E, Irahara N, Philips J, Meyerhardt JA, Hornick JL, Shivdasani RA, Fuchs CS. Relationship of CDX2 loss with molecular features and prognosis in colorectal cancer. Clin Cancer Res. 2009;15:4665-4673. [PubMed] [DOI] |
| 7. | Liu T, Zhang X, So CK, Wang S, Wang P, Yan L, Myers R, Chen Z, Patterson AP, Yang CS. Regulation of Cdx2 expression by promoter methylation, and effects of Cdx2 transfection on morphology and gene expression of human esophageal epithelial cells. Carcinogenesis. 2007;28:488-496. [PubMed] [DOI] |
| 8. | Boudreau F, Rivard N, Gendron FP, Beaulieu JF. [CDX2: a transcription factor with multiple tasks for epithelial cells of the digestive tract]. Med Sci (Paris). 2007;23:7-8. [PubMed] |
| 9. | Pushparaj PN, Aarthi JJ, Manikandan J, Kumar SD. siRNA, miRNA, and shRNA: in vivo applications. J Dent Res. 2008;87:992-1003. [PubMed] [DOI] |
| 10. | Noguchi K, Ishitu Y, Kurosaki NM, Takaku H Expression of shRNA using intro splicing. Nucleic Acids Symposium Series. 2007;51:490-410. [PubMed] [DOI] |
| 12. | Herold MJ, van den Brandt J, Seibler J, Reichardt HM. Inducible and reversible gene silencing by stable integration of an shRNA-encoding lentivirus in transgenic rats. Proc Natl Acad Sci U S A. 2008;105:18507-18512. [PubMed] [DOI] |
| 14. | Neschadim A, McCart JA, Keating A, Medin JA. A roadmap to safe, efficient, and stable lentivirus-mediated gene therapy with hematopoietic cell transplantation. Biol Blood Marrow. Transplant. 2007;13:1407-1416. [PubMed] [DOI] |