修回日期: 2009-12-07
接受日期: 2009-12-14
在线出版日期: 2010-01-28
目的: 观察4, 5, 7-三羟基异黄酮(Genistein)对大鼠肝星状细胞(HSC)增殖及TGF-β1、MMP-2及TIMP-2基因表达的影响, 探讨其抗肝纤维化的可能机制.
方法: 将体外培养的大鼠HSC-T6分别给予不同浓度的Genistein作用24 h后, 用噻唑兰比色法(MTT)检测测定活细胞数, 采用半定量RT-PCR法检测细胞中TGF-β1、MMP-2及TIMP-2的mRNA水平.
结果: Genistein作用于大鼠HSC-T6后, 活细胞数目减少, 12.5、25及50 mg/L 3个作用浓度组与对照组的A值比较有显著性差异(0.306±0.0067, 0.256±0.0085, 0.1316±0.0049 vs 0.4468±0.0299, 均P<0.05). 不同浓度的Genistein干预HSC-T6, MMP-2 mRNA表达水平与对照组比较均明显增强(均P<0.05); TGF-β1和TIMP-2 mRNA表达水平与对照组比较均明显降低(均P<0.05).
结论: Genistein可能通过增强大鼠HSC MMP-2 mRNA的表达, 同时抑制TGF-β与TIMP-2 mRNA的表达发挥抗纤维化的作用.
引文著录: 廖明, 李彦, 舒伟. Genistein对大鼠肝星状细胞的增殖及TGF-β1、MMP-2和TIMP-2表达的影响. 世界华人消化杂志 2010; 18(3): 229-233
Revised: December 7, 2009
Accepted: December 14, 2009
Published online: January 28, 2010
AIM: To investigate the effects of genistein on cell proliferation and the expression of transforming growth factor-β1 (TGF-β1), matrix metalloproteinase-2 (MMP-2) and tissue inhibitors of metalloproteinase-2 (TIMP-2) in rat hepatic stellate cell (HSC) and explore its possible anti-fibrogenic mechanism.
METHODS: After cultured HSC-T6 cells were exposed to different concentrations of genistein for 24 h, cell proliferation was determined by methyl thiazolyl tetrazolium (MTT) assay, and the expression of TGF-β1, MMP-2 and TIMP-2 mRNAs was measured by semi-quantitative reverse transcription-polymerase chain reaction (RT-PCR).
RESULTS: Genistein at concentrations of 12.5, 25 and 50 mg/L significantly inhibited cell proliferation (0.306 ± 0.0067, 0.256 ± 0.0085, and 0.1316 ± 0.0049 vs 0.4468 ± 0.0299, respectively; all P < 0.05). Compared with untreated cells, the expression of MMP-2 mRNA was markedly upregulated (all P < 0.05), and the expression of TGF-β1 and TIMP-2 mRNAs was markedly dowregulated (all P < 0.05) in HSCs treated with different concentrations of genistein.
CONCLUSION: Genistein exerts anti-fibrogenic effects perhaps by inhibiting the expression of TGF-β1 and TIMP-2 mRNAs and increasing the expression of MMP-2 mRNA in HSCs in rats.
- Citation: Liao M, Li Y, Shu W. Effects of genistein on cell proliferation and TGF-β1, MMP-2 and TIMP-2 expression in rat hepatic stellate cells. Shijie Huaren Xiaohua Zazhi 2010; 18(3): 229-233
- URL: https://www.wjgnet.com/1009-3079/full/v18/i3/229.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i3.229
肝星状细胞(hepatic stellate cell, HSC)是肝纤维化时细胞外基质(extracellular matrix, ECM)过多产生和沉积的主要细胞来源, HSC的激活、增殖及ECM的过量沉积在肝纤维化过程中起核心作用. 转化生长因子β1(transforming growth factor β1, TGF-β1)是强有力的致纤维化的细胞因子, 在肝纤维化时表达明显增多, 促进HSC增殖活化, 合成大量ECM, 在纤维化进程中起重要作用[1]. 基质金属蛋白酶(matrix metal proteases, MMPs)及其组织抑制因子(tissue inhibitors of metal proteases, TIMPs)是肝脏内调节ECM降解与合成平衡的主要因子, 其中MMPs负责降解ECM, 而TIMPs则通过与MMPs形成1:1的复合物抑制MMPs的活化及酶解活性[2]. MMP-2是MMPs中的重要成员, 主要降解Ⅰ, Ⅳ, Ⅴ, Ⅶ, Ⅹ型胶原和弹性蛋白、纤维连接蛋白以及变性的Ⅰ型胶原等, 而其组织抑制因子-TIMP-2通过抑制MMP-2, 阻止ECM的降解, 从而形成或促进肝纤维化[3,4]. Iimuro等[5]提出, 如能增强MMPs活性和(或)抑制TIMPs活性, 有可能对肝纤维化的发生、发展进行调节, 从而减缓和阻断肝纤维化的过程. 4, 5, 7-三羟基异黄酮(Genistein)是来源于豆类植物的异黄酮类化合物, 体内、外的研究表明其对乳腺癌、前列腺癌、肝癌、胃癌和鼻咽癌等多种肿瘤细胞具有较好的抑制作用[6-12]. 另外, Genistein能抑制肝纤维化大鼠肝窦内皮细胞的增殖[13], 但其对肝星状细胞的影响尚未见有报道. 我们用Genistein的不同浓度干预体外培养的大鼠肝星状细胞系HSC-T6, 利用噻唑兰比色法(MTT)测定活细胞数, 以检测其对细胞增殖的影响; 而后采用半定量RT-PCR法检测TGF-β1、MMP-2和TIMP-2的mRNA表达水平, 探讨Genistein抗肝纤维化的作用机制.
HSC-T6, 为SV40转染SD大鼠HSC, 为永生化细胞, 表型为活化的HSC, 具纤维化特性. 细胞由广西医科大学姜海行教授馈赠. Genistein(Sigma); DMEM(Gibco); 胎牛血清(Hyclone); TRIzol(Invitrogen); 逆转录试剂盒(Fermentas); 2×PCR mix(TaKaRa). CO2培养箱(美国Thermo); 高速冷冻离心机(美国Thermo); 倒置相差显微镜(德国Zeiss); 酶标仪(美国Thermo); PCR仪(美国Bio-Rad); 核酸蛋白测定仪(日本岛津); 凝胶成像分析系统(美国Bio-Rad); 低压电泳仪(美国Bio-Rad).
1.2.1 细胞培养: 将冷冻保存于超低温冰箱中的HSC-T6复苏后接种于含100 mL/L胎牛血清的高糖DMEM培养液中, 37 ℃、50 mL/L CO2条件下培养. 当细胞呈单层致密状时, 采用2.5 g/L胰蛋白酶消化后传代. 每次试验均在呈指数生长的细胞中进行.
1.2.2 MTT法测定药物对细胞增殖的影响: 将HSC以5×107/L接种于96孔板, 培养12 h后, 换含3.125、6.25、12.5、25、50、100 mg/L Genistein的培养液, 每个浓度设5个复孔. 继续培养20 h后, 每孔加入MTT 20 µL, 继续培养4 h, 吸出全部液体, 加入100 µL DMSO, 微量振荡器上振荡5 min, 酶标仪双波长(570/630 nm)比色.
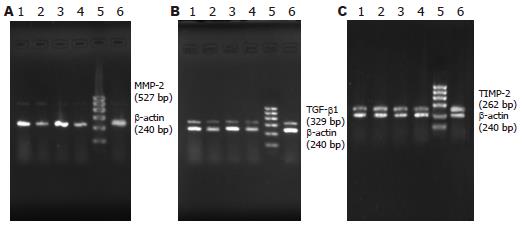
1.2.3 RT-PCR法检测TGF-β1、MMP-2及TIMP-2 mRNA的表达: 将细胞以5×107/L接种于50 mL培养瓶中, 分为空白对照组, 处理组为Genistein的6.25、12.5、25、50 mg/L组. 培养12 h后, 处理组换Genistein的培养液继续培养24 h. 采用TRIzol法抽提细胞中总RNA. 用核酸蛋白测定仪测定RNA含量及纯度, 保证A260/A280均为1.8-2.0. 取RNA 5 µg, 采用M-MuLV逆转录酶将其逆转录成cDNA. 根据NCBI的GenBank基因序列自行设计引物, 引物序列为: β-actin: FP: 5'-AACCCTAAGGCCAACCGTGAAAAG-3', RP': 5'-TCATGAGGTAGTCTGTCAGGT-3', 产物长度: 240 bp; TGF-β1: FP: 5'-ATGGTGGACCGCAACAAC-3', RP: 5'-TGAG CACTGAAGCGAAAGC-3', 产物长度: 329 bp; MMP2: FP: 5'-TGGAA GCATCAAATCGGACTG-3', RP: 5'-GCAAAGGGCAAACAAAGCA-3', 产物长度: 527 bp; TIMP-2: FP: 5'-CCAAAGCAGTGAGCGAGAA-3', RP: 5'-TCCCAGGGCACAATAAAGTC-3', 产物长度: 262 bp; PCR扩增cDNA, 条件为: 94 ℃预变性5 min, 94 ℃变性30 s, 各自退火温度(MMP-2为55 ℃; TIMP-2、TGF-β1为52 ℃)30 s, 72 ℃延伸30 s, 72 ℃延伸10 min, 总共30个循环; 所有PCR产物在20 g/L琼脂糖凝胶上电泳后, 用凝胶成像系统拍照, Quantity One软件测定灰度值, 灰度值以各产物与β-actin的积分吸光度(A)的比值表示.
统计学处理 应用SPSS13.0软件进行统计分析. 数据均以mean±SD表示, 组间比较采用t检验, P<0.05表示存在统计学意义.
分别用浓度为3.125、6.25、12.5、25、50、100 mg/L的Genistein作用于活化的大鼠HSC-T6, 应用MTT方法检测细胞增殖, 随着Genistein浓度的增加A值逐渐降低, 在100 mg/L时药物对细胞有杀伤作用. 统计学分析结果表明, 50、25及12.5 mg/L三个浓度组与对照组的A值比较(0.3060±0.0067, 0.2560±0.0085, 0.1316±0.0049 vs 0.4468±0.0299, 均P<0.05)有显著性差异, 3.125和6.25 mg/L浓度组与对照组的A值比较, 无显著性差异(0.4118±0.0155, 0.4292±0.0146 vs 0.4468±0.0299, P>0.05).
灰度分析结果表明, 与空白对照组比较, Genistein 6.25、12.5、25、50 mg/L组的MMP-2 mRNA表达明显升高, 差别有统计学意义(P<0.05), 且呈现一定的浓度依赖性; 而TGF-β1和TIMP-2 mRNA表达明显降低, 差别有统计学意义(均P<0.05), 也呈现一定的剂量依赖效应(图1, 表1).
| 分组 | TGF-β1 | MMP-2 | TIMP-2 |
| 对照组 | 0.481±0.137 | 0.017±0.065 | 1.053±0.345 |
| Genistein组(mg/L) | |||
| 6.25 | 0.371±0.054a | 0.036±0.011a | 0.813±0.014a |
| 12.5 | 0.258±0.070a | 0.060±0.083a | 0.615±0.087a |
| 25 | 0.227±0.068a | 0.101±0.087a | 0.604±0.019a |
| 50 | 0.423±0.095a | 0.088±0.031a | 0.728±0.106a |
HSC的活化被认为是肝纤维化形成的中心环节. 近来研究表明, 逆转肝纤维化关键在于减少活化的HSC数量. 活化HSC数目减少, 不仅可以使ECM分泌减少, 而且还可影响ECM的降解, 因此抑制活化的HSC成为抗肝纤维化的研究热点. HSC的数量是由HSC增殖和凋亡共同决定的, 从理论上讲, 减少活化HSC数量有这些途径: (1)抑制HSC增殖; (2)诱导HSC凋亡, 直接减少HSC数量; (3)逆转HSC的激活, 让HSC由活化型变回静止型等. 但研究表明抑制细胞增殖和诱导凋亡是减少活化型HSC数量的主要途径, 因此, 抑制HSC增殖是抗肝纤维化有效途径. Genistein是大豆异黄酮(soybean isoflavones)的成分之一, 是大豆中一类重要的非营养素成分, 近年来的研究显示其具有明显的抗肿瘤作用. 有研究表明Genistein能抑制肝纤维化大鼠肝窦内皮细胞的增殖[13], 但其对HSC的影响尚未见有报道. 我们检测了Genistein对大鼠肝纤维化细胞株HSC-T6的影响. MMT检测结果发现Genistein能抑制HSC-T6的增殖, 并且随着浓度的增加而增加, 初步证实Genistein具有抗肝纤维化作用.
目前认为ECM的过度增多和异常沉积是肝纤维化发生的主要机制[14-16]. 在正常肝脏组织中存在着ECM的合成与降解的动态平衡. 肝纤维化时纤维结缔组织的形成, 是由于各种不同致病因子导致ECM合成与降解的失衡所致. 多项研究表明, TGF-β1是强有力的致纤维化细胞因子, 在肝纤维化中表达明显增多, 可促进HSC的增殖和活化, 使ECM合成增多, 降解减少, 并存在正反馈放大效应, 促进肝纤维化的进程[17-20]. 在我们的研究当中, Genistein干预HSC-T6后, 与对照组比较, TGF-β1的mRNA表达量明显降低, 具有统计学意义, 且以25及12.5 mg/L抑制作用最明显. 我们推断Genistein可能是通过抑制TGF-β1的表达而发挥抗肝纤维化的作用.
MMPs是ECM降解的主要酶系, 而其组织抑制因子(TIMPs)通过抑制MMPs, 阻止ECM的降解, 从而形成或促进肝纤维化. MMP-2初次发现于小鼠转移性肿瘤细胞和兔骨细胞的培养过程中. 较多的研究认为MMP-2在纤维化阶段升高, 而在肝硬化和肝纤维化恢复期逐渐降低. 朱跃科等[21]研究发现, 在肝纤维化的形成过程中MMP-2的基因表达、蛋白表达及酶活性均增高. MMP-2的表达与酶活性在肝纤维化逆转过程逐渐降低, 说明MMP-2与肝纤维化的发生发展密切相关, 而TIMP-2在肝纤维化发展过程中表达增强, MMP-2/TIMP-2的比值下降. 在原代培养的HSC早期, TIMP-2不表达, HSC激活后TIMP-2表达增加. 张亚飞等[22]的研究发现通过抑制TIMP-2的表达, 可间接增强MMP-2的活性, 降低Ⅳ胶原在肝纤维化中的沉积, 减缓肝纤维化的发展. 临床研究发现, 未经干扰素治疗的慢性丙型肝炎患者血清中的TIMP-2水平在6 mo后显著升高, 而经干扰素治疗6 mo后血清中的TIMP-2水平无明显变化[23]. 而且, 在肝硬化及原发性肝癌未转移患者血清中TIMP-2的水平也明显升高[24]. 在用不同浓度的Genistein干扰HSC-T6后, 我们采用RT-PCR法检测MMP-2和TIMP-2的mRNA表达, 结果发现, 与对照相比MMP-2的表达量明显增多, 而TIMP-2表达下降. 因此我们认为Genistein可能是通过抑制调节MMP-2/TIMP-2的表达, 而发挥抗纤维化的作用.
总之, 我们在采用Genistein干预大鼠肝星状细胞系HSC-T6的研究中, 发现Genistein具有明显的抗肝纤维化作用, 这种抗肝纤维化作用可能是通过抑制活化的HSC的增殖, 降低TGF-β1和TIMP-2的表达, 上调MMP-2的表达来实现.
HSC是肝纤维化时ECM过多产生和沉积的主要细胞来源, HSC的激活、增殖及ECM的过量沉积在肝纤维化过程中起核心作用. Genistein是来源于豆类植物的异黄酮类化合物, 体内、外的研究表明其对多种肿瘤细胞具有较好的抑制作用. 本研究旨在观察Genistein对HSC增殖和肝纤维化相关基因表达的影响, 探讨其抗肝纤维化机制.
王炳元, 教授, 中国医科大学附属第一医院消化内科.
刘小菁等的体外实验表明, Genistein可以抑制肝纤维化Ⅰ级大鼠肝窦内皮细胞增殖, 促进肝窦内皮细胞细胞NO合成, 对肝纤维化的肝窦内皮细胞功能有一定调节作用.
本研究将Genistein作用于HSC, 观察其对HSC增殖的影响, 并首次以TGF-β1、MMP-2和TIMP-2为靶点探讨其抗肝纤维化的机制.
本研究证实Genistein可能通过增强大鼠HSC MMP-2 mRNA的表达, 同时抑制TGF-β与TIMP-2 mRNA的表达发挥抗纤维化的作用, 为Genistein的进一步临床应用提供理论基础.
本研究探讨了Genistein对大鼠HSC的增殖及TGF-β1、MMP-2和TIMP-2表达的影响, 有一定的创新性和实用性.
编辑: 李军亮 电编:吴鹏朕
| 1. | Gressner AM, Weiskirchen R. Modern pathogenetic concepts of liver fibrosis suggest stellate cells and TGF-beta as major players and therapeutic targets. J Cell Mol Med. 2006;10:76-99. [PubMed] [DOI] |
| 2. | Iyer S, Wei S, Brew K, Acharya KR. Crystal structure of the catalytic domain of matrix metalloproteinase-1 in complex with the inhibitory domain of tissue inhibitor of metalloproteinase-1. J Biol Chem. 2007;282:364-371. [PubMed] [DOI] |
| 3. | Greene J, Wang M, Liu YE, Raymond LA, Rosen C, Shi YE. Molecular cloning and characterization of human tissue inhibitor of metalloproteinase 4. J Biol Chem. 1996;271:30375-30380. [PubMed] [DOI] |
| 4. | Clark IM, Swingler TE, Sampieri CL, Edwards DR. The regulation of matrix metalloproteinases and their inhibitors. Int J Biochem Cell Biol. 2008;40:1362-1378. [PubMed] [DOI] |
| 5. | Iimuro Y, Brenner DA. Matrix metalloproteinase gene delivery for liver fibrosis. Pharm Res. 2008;25:249-258. [PubMed] [DOI] |
| 6. | Jones TH, Justice SK, Price A. Suppression of tyrosine kinase activity inhibits [3H]thymidine uptake in cultured human pituitary tumor cells. J Clin Endocrinol Metab. 1997;82:2143-2147. [PubMed] [DOI] |
| 7. | Elattar TM, Virji AS. The inhibitory effect of curcumin, genistein, quercetin and cisplatin on the growth of oral cancer cells in vitro. Anticancer Res. 2000;20:1733-1738. [PubMed] |
| 8. | Li Y, Ahmed F, Ali S, Philip PA, Kucuk O, Sarkar FH. Inactivation of nuclear factor kappaB by soy isoflavone genistein contributes to increased apoptosis induced by chemotherapeutic agents in human cancer cells. Cancer Res. 2005;65:6934-6942. [PubMed] [DOI] |
| 9. | Mohammad RM, Banerjee S, Li Y, Aboukameel A, Kucuk O, Sarkar FH. Cisplatin-induced antitumor activity is potentiated by the soy isoflavone genistein in BxPC-3 pancreatic tumor xenografts. Cancer. 2006;106:1260-1268. [PubMed] [DOI] |
| 12. | 阿依恒•曲库尔汗, 阿孜古丽•吐尔逊, 卢晓梅, 刘立中. Genistein对人鼻咽癌细胞系CNE抑制增殖和促进凋亡的研究. 中华耳鼻咽喉头颈外科杂志. 2007;10:783-785. |
| 13. | 刘 小菁, 黄 明慧, 成 孃, 肖 文君, 王 一平. 4, 5, 7-三羟基异黄酮对肝纤维化大鼠肝窦内皮细胞窗孔、增殖及合成一氧化氮的影响. 中华肝脏病杂志. 2002;10:200-203. |
| 14. | Giannelli G, Antonaci S. Immunological and molecular aspects of liver fibrosis in chronic hepatitis C virus infection. Histol Histopathol. 2005;20:939-944. [PubMed] |
| 15. | Friedman SL. Mechanisms of disease: Mechanisms of hepatic fibrosis and therapeutic implications. Nat Clin Pract Gastroenterol Hepatol. 2004;1:98-105. [PubMed] [DOI] |
| 16. | Tsukada S, Parsons CJ, Rippe RA. Mechanisms of liver fibrosis. Clin Chim Acta. 2006;364:33-60. [PubMed] [DOI] |
| 17. | Gressner AM, Weiskirchen R, Breitkopf K, Dooley S. Roles of TGF-beta in hepatic fibrosis. Front Biosci. 2002;7:d793-d807. [PubMed] [DOI] |
| 18. | Sanderson N, Factor V, Nagy P, Kopp J, Kondaiah P, Wakefield L, Roberts AB, Sporn MB, Thorgeirsson SS. Hepatic expression of mature transforming growth factor beta 1 in transgenic mice results in multiple tissue lesions. Proc Natl Acad Sci U S A. 1995;92:2572-2576. [PubMed] [DOI] |
| 19. | Kanzler S, Lohse AW, Keil A, Henninger J, Dienes HP, Schirmacher P, Rose-John S, zum Büschenfelde KH, Blessing M. TGF-beta1 in liver fibrosis: an inducible transgenic mouse model to study liver fibrogenesis. Am J Physiol. 1999;276:G1059-G1068. [PubMed] |
| 20. | Schnur J, Oláh J, Szepesi A, Nagy P, Thorgeirsson SS. Thioacetamide-induced hepatic fibrosis in transforming growth factor beta-1 transgenic mice. Eur J Gastroenterol Hepatol. 2004;16:127-133. [PubMed] [DOI] |
| 22. | 张 亚飞, 聂 青和, 谢 玉梅, 邵 彬, 苟 艳子, 周 永兴. 抑制金属蛋白酶组织抑制因子-2在肝组织中的表达对大鼠肝纤维化发展的影响. 中华肝脏病杂志. 2006;14:138-140. |
| 23. | Ninomiya T, Yoon S, Nagano H, Kumon Y, Seo Y, Kasuga M, Yano Y, Nakaji M, Hayashi Y. Significance of serum matrix metalloproteinases and their inhibitors on the antifibrogenetic effect of interferon-alfa in chronic hepatitis C patients. Intervirology. 2001;44:227-231. [PubMed] [DOI] |
| 24. | Giannelli G, Bergamini C, Marinosci F, Fransvea E, Quaranta M, Lupo L, Schiraldi O, Antonaci S. Clinical role of MMP-2/TIMP-2 imbalance in hepatocellular carcinoma. Int J Cancer. 2002;97:425-431. [PubMed] [DOI] |