修回日期: 2010-08-10
接受日期: 2010-08-17
在线出版日期: 2010-10-18
目的: 探讨小鼠骨髓间充质干细胞(mesenchymal stem cells, MSCs)移植于小肠放射性损伤的小鼠体内后的定植情况.
方法: 体外培养扩增♂昆明小鼠MSCs, 然后采用性别交叉移植的方法, 即移植组: 经尾静脉注射雄性小鼠MSCs进入小肠放射性损伤的雌性小鼠体内; 对照组: 注射等量无菌生理盐水. 分别于第1、2、4周通过原位杂交检测Y染色体观察MSCs的定植情况.
结果: 移植组小鼠于移植后第1周即可检出Y染色体阳性荧光细胞的存在, 呈零星散在分布, 且多位于隐窝周围的黏膜下层, 阳性率为19.48%±5.01%; 第2周荧光细胞明显增多, 阳性率为30.86%±12.14%, 差异显著(P<0.05); 第4周阳性率为35.92%±11.98%, 差异不显著(P>0.05).
结论: MSCs移植于小肠放射性损伤的小鼠体内后可以在小肠定植, 且主要定植于黏膜下层.
引文著录: 吴巍芸, 陈其奎. 溃骨髓间充质干细胞在小肠黏膜损伤小鼠体内的定植. 世界华人消化杂志 2010; 18(29): 3129-3133
Revised: August 10, 2010
Accepted: August 17, 2010
Published online: October 18, 2010
AIM: To investigate the engraftment of murine bone marrow mesenchymal stem cells (MSCs) in the irradiated intestine of mice to provide some clues about the mechanism of intestine epithelium healing and lay an experimental foundation for treatment of intestine diseases by intravenous transplantation of MSCs.
METHODS: MSCs from male mice were isolated, expanded, identified, suspended in sterile normal saline (1 × 106 cells/mL), and slowly infused into irradiated female mice via the tail vein. Meanwhile, a group of irradiated female mice receiving an equal volume of sterile normal saline were used as controls. For tracing male MSC residence in the intestine after intravenous transplantation, in situ hybridization (ISH) was used to detect the Sry gene on the Y chromosome.
RESULTS: In the transplantation group, ISH analysis revealed the presence of male donor MSCs in the submucosa of the intestine of female mice, but not in the mucosal epithelium. At week 1 after cell transplantation, Sry-positive cells were scattered around the crypt, with a percentage of 19.48% ± 5.01%. At week 2, this percentage rose to 30.86% ± 12.14%, significantly higher than that at week 1 (P < 0.05). However, there was no significant difference in the percentage of Sry-positive cells between at week 2 and week 4 (week 4: 35.95% ± 11.98%, P > 0.05). In the control group, no Sry-positive cells were found.
CONCLUSION: After MSCs were transplanted into mice, they were attracted to and retained in the irradiated intestine and colonized in the intestinal submucosa.
- Citation: Wu WY, Chen QK. Mesenchymal stem cells engraftment in the injured intestine of mice. Shijie Huaren Xiaohua Zazhi 2010; 18(29): 3129-3133
- URL: https://www.wjgnet.com/1009-3079/full/v18/i29/3129.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i29.3129
小肠是人体重要的消化吸收器官, 各种疾病可致小肠组织结构损伤并使功能严重障碍, 但小肠黏膜损伤修复的机制未明, 故目前在治疗上未能取得满意的效果. 新近的研究发现, 小肠黏膜损伤后, 除了小肠本身具有强大的自我更新及损伤修复能力外, 一些肠外来源的细胞如骨髓的细胞等也参与了其中的调节. 国外一些研究报道, 将骨髓细胞移植入器官损伤的动物体内, 可见损伤的器官内有外源的细胞定植, 参与损伤的修复. Komori等[1]在实验性炎症性肠病的大肠黏膜损伤部位见到外源的骨髓细胞定植. 但骨髓里具体主要是哪种细胞定植及定植的部位目前尚不清楚[2]. 本实验把小鼠骨髓间充质干细胞(mesenchymal stem cells, MSCs)经过体外扩增后移植入小肠放射性损伤小鼠体内, 探讨MSCs在小肠的定植情况, 为MSCs移植治疗小肠损伤提供实验基础.
DMEM/F12基础培养基(Gibco, USA), 胎牛血清(Hyclone, USA), 胰酶(Gibco, USA), 流式单抗小鼠Anti-CD29-FITC, 小鼠Anti-CD44-FITC, 小鼠Anti-CD34-FITC(Biolegend, USA), 小鼠抗小鼠α平滑肌肌动蛋白(α smooth muscle actin, α-SMA)单克隆抗体、小鼠抗小鼠结蛋白(desmin)单克隆抗体及其免疫组织化学试剂盒(武汉博士德生物公司), 大鼠抗小鼠波形蛋白(vimentin)(Chemicon, USA)单克隆抗体, 小鼠Sry原位杂交染色试剂盒(天津灏洋生物有限公司). 实验动物: 昆明小鼠, ♂, 3-4 wk龄, SPF级, 体质量17 g左右, 作为供体培养扩增MSCs. 昆明小鼠, ♀, 6 wk龄, SPF级, 体质量27 g左右, 作为受体动物. 均购自广东省医学实验动物中心.
1.2.1 小鼠MSCs的体外分离培养和鉴定[3]: 取3-4 wk龄♂昆明小鼠, 冲出股骨及胫骨骨髓腔内细胞, 反复吹打形成单细胞悬液, 离心收集细胞后, 再用含100 mL/L胎牛血清的完全培养基重新悬浮细胞, 将其接种25 cm2的培养瓶中, 37 ℃, 50 mL/L CO2细胞培养箱培养. 3 d后首次更换培养液, 弃去未贴壁细胞, 随后每3 d换液1次, 至原代(P0)长至约90%融合时, 胰酶常温消化, 轻轻吹打使细胞脱落, 消化不下来的贴壁牢固的细胞弃去. 离心后弃上清, 完全培养基重悬细胞, 1:2传代, 37 ℃, 50 mL/L CO2细胞培养箱继续培养, 此为P1代. 再传代则为P2代, 如此类推. 应用荧光标记的抗CD29、CD44、CD34抗体, 流式细胞仪进行检测鉴定. 选取生长良好的第5代至第8代的细胞进行移植.
1.2.2 小鼠小肠放射性损伤的制作: 6 wk龄♀昆明小鼠用1%戊巴比妥钠(40 mg/kg体质量)腹腔注射麻醉后, 固定, 用6 Mev电子线进行一次性腹部照射, 剂量率为300 mV/min, 总放射剂量18 Gy, 放射源至动物表皮距离为1 m. 照射部位为剑突下0.2 cm至髂棘上缘之间, 深度1 cm, 身体其余部位用5 cm厚的铅块屏蔽.
1.2.3 小鼠MSCs的性别交叉移植及取材: 移植组: 取第5代至第8代生长旺盛的♂小鼠MSCs, 调整细胞密度为1×106个/mL, 经尾静脉缓慢注射0.6 mL的细胞悬液, 推注顺利、无外渗者为移植成功. 对照组: 注射无细胞的等量无菌生理盐水. 细胞移植后的第1、2、4周分别处死10只移植组小鼠及10只对照组小鼠, 每只小鼠各取2段小肠, 分别是空肠(Treiz韧带下端10 cm)和回肠(回盲部上端10 cm), 40 g/L多聚甲醛固定, 石蜡包埋、切片, 用于下一步检测.
1.2.4 移植细胞的定位和分化鉴定: 本实验通过Y染色体荧光原位杂交检测Y染色体上的♂决定基因Sry以鉴定外源MSCs的定位. 切片的组织置打孔液中, 室温放置10 min, 给细胞打孔以改变组织细胞的通透性使探针快速顺利的穿透细胞膜. 90 ℃硫氰酸钠溶液孵育10 min后立刻投入冰水混合物中5 min. 滴加复合消化工作液, 覆盖组织表面, 37 ℃ 15 min. 甘氨酸溶液终止消化. 40 g/L多聚甲醛固定10 min, 梯度乙醇脱水, 空气干燥, 预杂交工作液覆盖组织37 ℃湿盒孵育1 h, 之后滴加含有Y染色体探针(FAM标记)的杂交工作液覆盖组织37 ℃湿盒避光孵育过夜. 探针的浓度为6 mg/L. 孵育后50%甲酰胺、2×SSC、 0.2×SSC、0.1 mol TBS洗涤. 荧光显微镜下以490 nm激发光观察. 并以荧光染料Hoechst33342复染细胞核, 在330 nm紫外激发光下观察, 以计算背景细胞数.
统计学处理 在Nikon荧光显微镜观察组织切片并照相记录, 每张切片随机选取5个视野, 统计阳性细胞占间质细胞的百分率, 以mean±SD表示, 采用SPSS13.0统计软件进行统计分析, 计量资料正态分布者组间比较用方差分析与t检验, 非正态分布者用秩和检验, P<0.05认为差异有统计学意义.
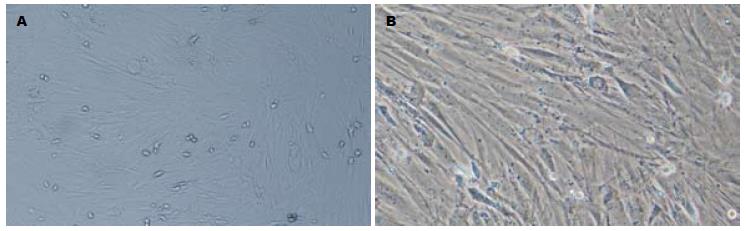
接种后24 h, 有少量细胞贴壁, 3 d后首次换液, 大部分悬浮的血细胞被清除, 余下的贴壁细胞形态不一, 呈现多角形、梭形、纺锤形等, 经3次换液后悬浮细胞基本清除, 第7天贴壁细胞增多, 第10天逐步形成细胞克隆. 16-18 d后细胞融合成单层, 达80%-90%, 排列有方向性. 传代后的细胞较原代贴壁、生长快速, 24 h后大部分细胞贴壁, 9 d即铺满瓶底. 随代数增加, 细胞形态趋向均一, 呈梭形为主, 细胞克隆漩涡状, 细胞逐渐得到纯化(图1). 流式细胞仪检测结果显示细胞均一性好, CD29、CD44及CD34的阳性率分别为99.30%, 92.84%和11.86%.
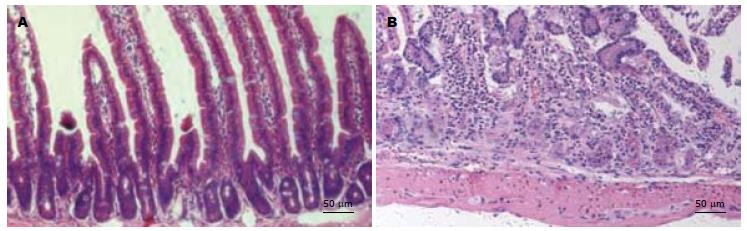
腹部放射后第1周, 肉眼可见部分肠段水肿、充血, 镜下见肠黏膜充血, 水肿, 可见局部糜烂、坏死, 绒毛排列不整齐或破坏, 黏膜下层及固有层炎症细胞浸润. 第4周绒毛再生, 黏膜修复(图2).
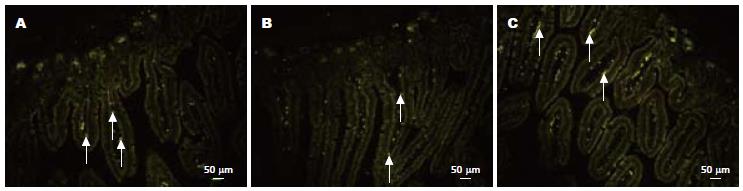
本实验发现移植组移植的MSCs特异地定位于小肠间质, 在上皮中未见外源细胞的存在. 移植组小鼠于移植后第1周在小肠即可检出Y染色体阳性细胞的存在, 零星散在分布, 且多位于隐窝周围的黏膜下层, 阳性率为19.48%±5.01%; 第2周荧光细胞阳性率为30.86%±12.14%, 较第1周明显增多, 差异有统计学意义(P<0.05), 并在绒毛周围间质也出现; 第4周阳性率为35.95%±11.98%, 较第2周有增多, 但差异无统计学意义(P>0.05, 图3).
MSCs能在体外分离和扩增, 还易于外源基因的转入和表达, 在人类医学上被认为是一种理想的治疗性细胞和基因治疗中的靶细胞[4]. MSCs具有2个重要的特性, 即长期的自我更新和多系分化潜能, 近年来发现MSCs还能向神经元[5]、心肌细胞[6]、肝、小肠和肾上皮细胞分化[7]; 同时, 多项研究发现在人体和动物模型上MSCs能逃避同种异体的免疫排斥. 主要是通过3个机制: (1)MSCs本身是低免疫原性的, 不表达MHC-Ⅱ和辅助刺激因子; (2)MSCs通过调节树突状细胞间接抑制T淋巴细胞的应答或直接阻断NK细胞和CD4+及CD8+的T淋巴细胞的功能; (3)MSCs通过产生前列腺素和白介素10还有分泌吲哚胺2, 3-双加氧酶破坏局部的色氨酸, 从而形成一个免疫抑制的微环境. 实际应用上又无伦理学问题, 故使其成为一些疾病的细胞治疗及基因治疗的理想的种子细胞[8].
骨髓中MSCs含量很低, 一般为0.001%-0.01%, 一次穿刺骨髓所获得的MSCs细胞数往往不能满足实际工作的需要. 必须通过体外分离培养、扩增、纯化, 以产生足够数量的细胞供使用. 本实验采取全骨髓培养法, 根据MSCs贴壁生长的特性和通过多次换液分离去除悬浮生长的血细胞; 由于MSCs易于消化, 在消化传代时, 将容易消化下来的细胞继续接种培养, 而将难以消化的杂细胞弃去, 可逐渐得到形态均一细胞.
目前国内外未见制作小肠黏膜损伤的成熟方法的报道, 小肠处于消化系的中段, 而且迂回曲折, 无论采用经胃插管或灌肠的方法都较难达到目的. 临床上接受盆腔或腹腔放疗的患者不少, 急性或慢性放射性肠炎发生率较高. 故本实验采用了腹部放射. 对于放射的剂量各家报道不一, 且多为全身照射, 少有局部放射. 我们经过预实验摸索, 发现18 Gy的剂量即可引起小肠黏膜损伤, 但尚未见损伤致死[9,10]. Chapel等[11]分别采用2种放射损伤: 全身照射及单纯全腹部照射的非肥胖糖尿病/联合免疫缺陷(non-obese diabetic/sever combined immunodeficiency, NOD/SCID)的小鼠, 把人MSCs移植入照射后的NOD/SCID小鼠体内, 发现在腹部照射的小鼠的肾、胃、肝、脾、小肠人MSCs的定植数较全身照射的小鼠显著增多. François等[12]也发现放射损伤明显促进MSCs在受损的部位定植. 放射性损伤后组织充血水肿, 释放出多种炎症因子, 吸引MSCs的聚集、定位及分化. Brittan等[2]在实验中发现在结肠炎时, 骨髓细胞能分化成肠道的多种细胞, 在组织再生和血管形成中有重要作用. 有研究发现, 放射性损伤后的小鼠给予MSCs移植至受损小肠壁, 观察发现移植组比非移植组体质量增加, 生存率增高, 溃疡的范围减小[13].
小肠隐窝处存在着小肠上皮干细胞, 他可以分化为吸收细胞、杯状细胞、肠内分泌细胞、潘氏细胞等小肠上皮细胞, 在上皮细胞正常的衰老死亡和病理损伤后, 干细胞增殖、分化, 在上皮修复过程中发挥主导作用[14]. 而小肠上皮干细胞的增殖、分化行为受细胞基因及干细胞所处的微环境双重因素影响, 生长因子、细胞因子和细胞基质分子形成的微环境提供了干细胞增殖与分化的必要的物质基础. 黏膜下层为小肠上皮提供支持网络, 调节上皮细胞的功能. 这层结构包含多种类型的细胞, 如纤维母细胞、纤维细胞、血管内皮细胞和平滑肌细胞等. 本实验先制作小肠放射损伤模型, 可见放射损伤后的小肠组织充血、水肿, 偶见局部糜烂、坏死, 绒毛排列不整齐或破坏, 黏膜下层及固有层见大量炎症细胞浸润. 然后用性别交叉移植的方法设计, 以Y染色体的存在作为标识, 观察移植的MSCs在受体小肠的定植. 本实验发现移植的MSCs只定位于小肠黏膜下, 在上皮未见外源细胞的存在. 实验中细胞移植后第1周已能在小肠黏膜下层定位, 第2、4周明显增多. 因此我们从形态学观察及标记物的检测结果分析推测外源的MSCs能在受损的小肠定位, 参与损伤的小肠上皮细胞周围微环境的重建, 促进黏膜的修复. 与国外研究的结果相近, 但MSCs只定位于小肠黏膜下. MSCs的分化机制和诱导条件目前尚未阐明. Sémont等[15]发现把人MSCs移植入有放射性肠道损伤的小鼠体内, 加快小肠结构和功能的恢复, 主要机制是增加内源性的增殖过程进而减少凋亡. 多数观点认为其与MSCs所处的微环境密切相关. 在损伤条件下, 可能是微环境中所含的各种因子促成了MSCs向该环境所需要的细胞或组织分化. 促使MSCs定植在小肠可能与损伤的小肠上皮分泌的一些细胞因子和炎症趋化因子的作用有关[2].
本文研究结果表明MSCs移植于小肠放射性损伤的小鼠体内后可以在小肠定位, 支持损伤小肠黏膜的修复, 可能是小肠间质的再生途径之一, 有很好的研究前景.
小肠是人体重要的消化吸收器官, 各种疾病可致小肠组织结构损伤并导致严重的功能障碍, 但小肠黏膜损伤修复的机制未明, 故目前在治疗上未能取得满意的效果.
郁卫东, 副研究员, 北京大学人民医院临床分子生物学研究所/中心实验室
Komori等在实验性炎症性肠病的大肠黏膜损伤部位见到外源的骨髓细胞定植.
本文研究结果表明, MSCs移植于小肠放射性损伤的小鼠体内后可以在小肠定位, 支持损伤小肠黏膜的修复, 可能是小肠间质的再生途径之一.
本文创新性一般, 但可读性较好, 具有一定的临床参考价值.
编辑: 曹丽鸥 电编:何基才
| 1. | Komori M, Tsuji S, Tsujii M, Murata H, Iijima H, Yasumaru M, Nishida T, Irie T, Kawano S, Hori M. Involvement of bone marrow-derived cells in healing of experimental colitis in rats. Wound Repair Regen. 2005;13:109-118. [PubMed] [DOI] |
| 2. | Brittan M, Chance V, Elia G, Poulsom R, Alison MR, MacDonald TT, Wright NA. A regenerative role for bone marrow following experimental colitis: contribution to neovasculogenesis and myofibroblasts. Gastroenterology. 2005;128:1984-1995. [PubMed] [DOI] |
| 4. | Jiang Y, Jahagirdar BN, Reinhardt RL, Schwartz RE, Keene CD, Ortiz-Gonzalez XR, Reyes M, Lenvik T, Lund T, Blackstad M. Pluripotency of mesenchymal stem cells derived from adult marrow. Nature. 2002;418:41-49. [PubMed] [DOI] |
| 5. | Sugaya K. Potential use of stem cells in neuroreplacement therapies for neurodegenerative diseases. Int Rev Cytol. 2003;228:1-30. [PubMed] [DOI] |
| 6. | McKaig BC, McWilliams D, Watson SA, Mahida YR. Expression and regulation of tissue inhibitor of metalloproteinase-1 and matrix metalloproteinases by intestinal myofibroblasts in inflammatory bowel disease. Am J Pathol. 2003;162:1355-1360. [PubMed] |
| 7. | Chapel A, Bertho JM, Bensidhoum M, Fouillard L, Young RG, Frick J, Demarquay C, Cuvelier F, Mathieu E, Trompier F. Mesenchymal stem cells home to injured tissues when co-infused with hematopoietic cells to treat a radiation-induced multi-organ failure syndrome. J Gene Med. 2003;5:1028-1038. [PubMed] [DOI] |
| 8. | Ryan JM, Barry FP, Murphy JM, Mahon BP. Mesenchymal stem cells avoid allogeneic rejection. J Inflamm (Lond). 2005;2:8. [PubMed] [DOI] |
| 9. | Zhang B, Su YP, Ai GP, Liu XH, Wang FC, Cheng TM. Differentially expressed proteins of gamma-ray irradiated mouse intestinal epithelial cells by two-dimensional elec trophoresis and MALDI-TOF mass spectrometry. World J Gastroenterol. 2003;9:2726-2731. [PubMed] |
| 10. | Murmu N, Jung J, Mukhopadhyay D, Houchen CW, Riehl TE, Stenson WF, Morrison AR, Arumugam T, Dieckgraefe BK, Anant S. Dynamic antagonism between RNA-binding protein CUGBP2 and cyclooxygenase-2-mediated prostaglandin E2 in radiation damage. Proc Natl Acad Sci U S A. 2004;101:13873-13878. [PubMed] [DOI] |
| 11. | Chapel A, Semont1 A, Francois S, Mouiseddine M, Thierry D. Human Mesenchymal Stem Cells (MSC) Home at Injured Sites after Local Irradiation and Contribute To Reduce Radiation-Induced Intestinal Lesion. Blood (ASH Annual Meeting Abstracts). 2005;106:Abstract 1691. |
| 12. | François S, Bensidhoum M, Mouiseddine M, Mazurier C, Allenet B, Semont A, Frick J, Saché A, Bouchet S, Thierry D. Local irradiation not only induces homing of human mesenchymal stem cells at exposed sites but promotes their widespread engraftment to multiple organs: a study of their quantitative distribution after irradiation damage. Stem Cells. 2006;24:1020-1029. [PubMed] [DOI] |
| 13. | Kudo K, Liu Y, Takahashi K, Tarusawa K, Osanai M, Hu DL, Kashiwakura I, Kijima H, Nakane A. Transplantation of mesenchymal stem cells to prevent radiation-induced intestinal injury in mice. J Radiat Res (Tokyo). 2010;51:73-79. [PubMed] [DOI] |
| 15. | Sémont A, Mouiseddine M, François A, Demarquay C, Mathieu N, Chapel A, Saché A, Thierry D, Laloi P, Gourmelon P. Mesenchymal stem cells improve small intestinal integrity through regulation of endogenous epithelial cell homeostasis. Cell Death Differ. 2010;17:952-961. [PubMed] [DOI] |