修回日期: 2010-09-08
接受日期: 2010-09-12
在线出版日期: 2010-09-28
目的: 探讨多普勒彩超在评估生长抑素对肝切除术后门静脉血流动力学影响中的价值.
方法: 将32只健康家兔随机分为: A组: 正常对照组; B组: 生理盐水治疗组和C组: 生长抑素治疗组. A组为假手术组; B组和C组均施行50%肝切除术, 并于术中及术后早期分别滴注生理盐水和生长抑素. 定期用多普勒彩超检测动物模型门静脉血流方向、血管内径、截面积、平均血流速率及血流量, 并进行组间比较.
结果: 术中及术后早期检测A、B、C 3组动物门静脉血管内径和截面积无明显差异(P>0.05), 但C组门静脉平均血流速率及血流量显著低于A组和B组(P<0.05).
结论: 肝部分切除术后, 早期应用生长抑素可降低门静脉平均血流速率及血流量, 这可能是生长抑素降低门静脉压力的主要原因; 应用多普勒彩超评估生长抑素对肝切除术后门静脉血流动力学的影响具有重要意义.
引文著录: 叶华, 何波, 王捷. 多普勒彩超评估生长抑素对肝切除术后门静脉血流动力学的影响. 世界华人消化杂志 2010; 18(27): 2901-2904
Revised: September 8, 2010
Accepted: September 12, 2010
Published online: September 28, 2010
AIM: To investigate the value of color Doppler ultrasound in evaluating the effects of somatostatin on portal hemodynamics in rabbits after hepatectomy.
METHODS: Thirty-two rabbits were randomly divided into three groups: control group (n = 6), normal saline group (n = 13), somatostatin group (n = 13). The normal saline group and somatostatin group underwent 50% hepatectomy, while the control group underwent a sham operation. Color Doppler ultrasound was then used to measure and compare various portal vein hemodynamic parameters, including flow direction, diameter, hemokinetic velocity, average flow rate, and blood flow volume, among each group.
RESULTS: There were no significant differences in portal diameter and hemokinetic velocity among all the three groups before and after the surgery (all P > 0.05). However, the average flow rate and blood flow volume were significant lower in the somatostatin group than in the control group and normal saline group (all P < 0.05).
CONCLUSION: Application of somatostatin early after hepatectomy may reduce the flow rate and blood flow volume in the portal vein, which may be the cause that somatostatin reduces elevated portal pressure. Color Doppler ultrasound is effective in evaluating the effects of somatostatin on portal hemodynamics in rabbits after hepatectomy.
- Citation: Ye H, He B, Wang J. Evaluation of the effects of somatostatin on portal hemodynamics in rabbits after hepatectomy by color Doppler ultrasound. Shijie Huaren Xiaohua Zazhi 2010; 18(27): 2901-2904
- URL: https://www.wjgnet.com/1009-3079/full/v18/i27/2901.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i27.2901
研究表明, 肝切除术后出血、胆瘘、难治性腹水、肝功能不全等并发症的发生与门静脉压力升高的幅度呈正相关. 尽管已明确生长抑素(somatostatin, SS)及其类似物可以降低肝切除术后门静脉压力升高的幅度, 但是其血液动力学机制仍未完全揭示[1-3], 这在一定程度上限制了SS在临床治疗中的优化用药. 针对上述问题, 本研究采用多普勒彩超评估了SS对兔肝脏大部分切除术后血流动力学的影响, 这为进一步探讨肝切除术后早期应用SS降低门静脉压力的具体机制奠定了实验基础.
健康家兔32只, 由中山大学医学院实验动物中心提供, 雌雄不拘, 兔龄在10 mo左右, 体质量2.4-3.0 kg, 在无特殊病原菌条件下(specific pathogen free, SPF)分笼饲养; SS类似物思他宁由瑞士雪兰诺公司提供, 每支3 000 µg; 外科手术器械包括: 手术刀、眼科剪、缝针、缝线、眼科尖镊等, 无菌平皿, 取样器, 1 mL、5 mL注射器等; 多普勒彩色超声(型号Esaote Technos Dll6).
1.2.1 分组及处理: 32只健康家兔随机分为3组. A组: 假手术对照组6只, 氯胺酮肌肉注射麻醉, 消毒后上腹肋缘下切口开腹, 然后关腹, 不行任何手术, 作为假手术对照组; B组: 生理盐水治疗组13只, 按照A组方法常规麻醉开腹后, 建立50%肝切除术动物模型. 从阻断肝十二指肠韧带肝缺血开始, 至切肝后2 h内, 经耳缘静脉持续滴入生理盐水100 mL(50 mL/h); C组: SS治疗组13只, 采用与B组相同的方法建立50%肝切除术动物模型. 从阻断肝十二指肠韧带肝缺血开始, 至切肝后2 h内, 经耳缘静脉持续滴入生理盐水100 mL+思他宁(滴速50 mL/h, 思他宁剂量为84 µg/kg).
1.2.2 指标检测: B组、C组剖腹后建立肝切除术动物模型, 采用多普勒彩超分别测量阻断肝门前、切肝后0.5、1、2 h的门静脉平均血流速率、血管内径、截面积、门静脉血流量和血流方向. 同时, 于对应的时间点采用多普勒彩超测量A组实验动物的门静脉平均血流速率、血管内径、截面积、门静脉血流量和血流方向.
统计学处理 所有实验数据以mean±SD表示, 不同组间实验数据差异比较采用t检验和重复测量方差分析, 统计软件采用SPSS 11.0 for Windows, P<0.05表示差异有显著性意义.
A、B、C 3组动物肝切除术前及术后0.5、1、2 h均通过多普勒彩超检测观察到向肝血流, 未见离肝血流.
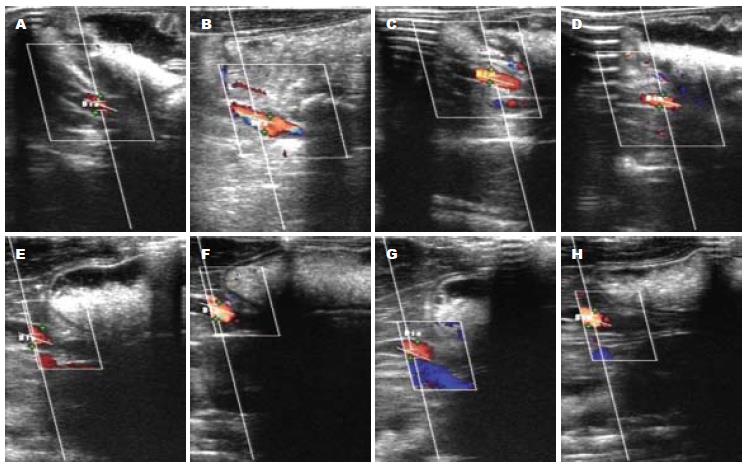
各组术后0.5、1、2 h的门静脉血管内径数值与术前比较的差值见表1, 经重复测量方差分析, A组与B组之间, A组与C组之间, B组与C组之间, 均无显著性差异(P = 0.170, 0.686, 0.219). 各组术后0.5、1、2 h的门静脉截面积数值与术前比较的差值见表2, 经重复测量方差分析, A组与B组之间, A组与C组之间, B组与C组之间, 均无显著性差异(P = 0.247, 0.824, 0.087). 各组术后0.5、1、2 h的门静脉平均血流速率数值与术前比较的差值见表3, A组与B组之间(P = 0.895), A组与C组之间(P<0.001), B组与C组之间(P<0.001)的差异, 显示使用SS后门静脉平均血流速率明显降低. 各组术后0.5、1、2 h的门静脉血流量数值与术前比较的差值见表4, A组与B组之间(P = 0.933), A组与C组之间(P = 0.106), B组与C组之间(P = 0.035)的差异, 表明SS治疗组较生理盐水治疗组其门静脉血流量明显降低(图1).
| 分组 | n | 术后0.5 h | 术后1 h | 术后2 h |
| A组 | 6 | -0.900±1.594 | 0.100±0.415 | 0.067±0.476 |
| B组 | 13 | 0.623±0.803 | 0.369±1.259 | 0.139±1.161 |
| C组 | 13 | 0.077±0.894 | 0.069±0.988 | -0.339±0.737 |
| 分组 | n | 术后0.5 h | 术后1 h | 术后2 h |
| A组 | 6 | 0.170±1.626 | 0.449±1.841 | 0.653±1.577 |
| B组 | 13 | 2.953±4.995 | 2.946±6.006 | 1.424±4.395 |
| C组 | 13 | 0.781±2.573 | 0.520±2.739 | -1.183±1.069 |
| 分组 | n | 术后0.5 h | 术后1 h | 术后2 h |
| A组 | 6 | -0.013±0.025 | -0.015±0.031 | -0.000±0.020 |
| B组 | 13 | -0.003±0.026 | -0.014±0.030 | -0.006±0.031 |
| C组 | 13 | -0.090±0.037 | -0.112±0.032 | -0.112±0.047 |
| 分组 | n | 术后0.5 h | 术后1 h | 术后2 h |
| A组 | 6 | -4.823±2.363 | -4.833±3.764 | -5.167±1.941 |
| B组 | 13 | -4.000±22.931 | -7.769±30.362 | -13.308±29.293 |
| C组 | 13 | -18.692±29.310 | -33.308±54.879 | -47.385±26.544 |
原发性肝细胞癌(hepatocellular carcinoma, HCC)是我国常见的消化系恶性肿瘤之一, 以手术为主的综合治疗目前被公认为是治疗HCC的最佳策略. 在采用外科手术治疗HCC的过程中, 肝切除术后并发症的防治, 一直是一个重点和难点问题. 研究表明, 肝切除术后出血、胆瘘、难治性腹水、肝功能不全等并发症的发生与门静脉压力升高的幅度呈正相关. 文献报道及我们前期实验研究表明[4-8], 应用SS及其类似物可以降低肝切除术后门静脉压力升高的幅度, 有助于出血、胆瘘、难治性腹水、肝功能不全等并发症的防治. 但是, SS及其类似物降低肝切除术后门静脉压力的血流动力学机制仍未完全阐明[9-12], SS的临床应用并非建立在血流动力学研究基础之上, 绝大部分用药是基于经验的总结, 这在一定程度上限制了SS在临床治疗中更充分的发挥治疗作用. 因此, 血流动力学机制的明确, 将有助于指导SS在临床治疗中的优化用药, 具有重要意义.
多年临床实际应用表明, 多普勒彩超为定量化评价肝脏血流变化提供了无创简便的方法, 能够获取门静脉血流动力学变化参数, 在评价门静脉血流动力学变化情况、估计病情及预后等方面有重要价值[13-15]. 在本研究中, 我们采用多普勒彩超检测了兔肝切除术前后门静脉直径、血管截面积、平均血流速率、血流量和血流方向变化以及SS对其的影响. 研究结果显示, SS治疗组和生理盐水治疗组的门静脉血流方向均为向肝性血流, 未见离肝血流. 使用SS后门静脉直径、血管截面积, 与生理盐水治疗组相比差异无显著意义, 即SS不能够直接收缩门静脉. 而门静脉平均血流速率、血流量锐减, 与生理盐水治疗组相比差异有显著意义. 由此, 我们推断SS降低门静脉压力的作用可能是通过降低门静脉血流速率, 从而使门静脉血流量减少, 最终使得门静脉压力降低.
本研究结果显示: 肝部分切除术后, 早期应用SS可降低门静脉平均血流速率及血流量, 这可能是SS降低门静脉压力的主要原因; 应用多普勒彩超评估SS对肝切除术后门静脉血流动力学的影响具有重要意义. 这为进一步探讨肝切除术后早期应用SS降低门静脉压力的具体机制奠定了实验基础. 但是, 由于肝切除前后机体病理生理和血流动力学的变化是一个极为复杂的过程, 本项目仅在动物实验方面进行了初步探讨, SS对肝切除术后全肝血流动力学的影响及其具体作用机制还有待进一步深入、全面地研究.
肝切除术后出血、胆瘘、难治性腹水、肝功能不全等并发症的发生与门静脉压力升高的幅度呈正相关. 尽管已明确生长抑素(SS)及其类似物可以降低肝切除术后门静脉压力升高的幅度, 但是其血液动力学机制仍未完全揭示, 这在一定程度上限制了SS在临床治疗中的优化用药.
李涛, 副主任医师, 北京大学人民医院肝胆外科
尽管生长抑素降低门静脉压力的作用已得到广泛认可, 然而其是否通过影响机体的血液动力学来发挥作用, 尚需进一步临床和实验研究证实.
本研究在前期证明肝切除术后早期应用生长抑素可以降低门静脉压力升高幅度的基础上, 进一步探讨了多普勒彩超在评估生长抑素对肝切除术后门静脉血流动力学影响中的价值.
多普勒彩超为定量化评价肝脏血流变化提供了无创简便的方法, 能够获取门静脉血流动力学变化参数, 在评价门静脉血流动力学情变化况、估计病情及预后等方面有重要价值.
本研究设计合理, 创新性较好, 具有一定的科学价值.
编辑: 曹丽鸥 电编:何基才
| 4. | Vanheule E, Geerts AM, Reynaert H, Van Vlierberghe H, Geerts A, De Vos M, Colle I. Influence of somatostatin and octreotide on liver microcirculation in an experimental mouse model of cirrhosis studied by intravital fluorescence microscopy. Liver Int. 2008;28:107-116. [PubMed] [DOI] |
| 5. | Xu H, Shi BM, Lu XF, Liang F, Jin X, Wu TH, Xu J. Vascular endothelial growth factor attenuates hepatic sinusoidal capillarization in thioacetamide-induced cirrhotic rats. World J Gastroenterol. 2008;14:2349-2357. [PubMed] [DOI] |
| 6. | Laviña B, Gracia-Sancho J, Rodríguez-Vilarrupla A, Chu Y, Heistad DD, Bosch J, García-Pagán JC. Superoxide dismutase gene transfer reduces portal pressure in CCl4 cirrhotic rats with portal hypertension. Gut. 2009;58:118-125. [PubMed] |
| 7. | Deli A, Kreidl E, Santifaller S, Trotter B, Seir K, Berger W, Schulte-Hermann R, Rodgarkia-Dara C, Grusch M. Activins and activin antagonists in hepatocellular carcinoma. World J Gastroenterol. 2008;14:1699-1709. [PubMed] [DOI] |
| 9. | Vorobioff JD, Ferretti SE, Zangroniz P, Gamen M, Picabea E, Bessone FO, Reggiardo V, Diez AR, Tanno M, Cuesta C. Octreotide enhances portal pressure reduction induced by propranolol in cirrhosis: a randomized, controlled trial. Am J Gastroenterol. 2007;102:2206-2213. [PubMed] [DOI] |
| 10. | Trebicka J, Hennenberg M, Laleman W, Shelest N, Biecker E, Schepke M, Nevens F, Sauerbruch T, Heller J. Atorvastatin lowers portal pressure in cirrhotic rats by inhibition of RhoA/Rho-kinase and activation of endothelial nitric oxide synthase. Hepatology. 2007;46:242-253. [PubMed] [DOI] |
| 11. | Trebicka J, Leifeld L, Hennenberg M, Biecker E, Eckhardt A, Fischer N, Pröbsting AS, Clemens C, Lammert F, Sauerbruch T. Hemodynamic effects of urotensin II and its specific receptor antagonist palosuran in cirrhotic rats. Hepatology. 2008;47:1264-1276. [PubMed] [DOI] |
| 12. | Yang YP, Ma XM, Wang CP, Han J, Lu YY, Xiang Y, Su SH, Feng YY. Effect of increased hepatic platelet activating factor and its receptor portal hypertension in CCl4-induced liver cirrhosis. World J Gastroenterol. 2006;12:709-715. [PubMed] |
| 13. | Patella S, Phillips DJ, Tchongue J, de Kretser DM, Sievert W. Follistatin attenuates early liver fibrosis: effects on hepatic stellate cell activation and hepatocyte apoptosis. Am J Physiol Gastrointest Liver Physiol. 2006;290:G137-G144. [PubMed] [DOI] |
| 14. | Jung Y, Oh SH, Zheng D, Shupe TD, Witek RP, Petersen BE. A potential role of somatostatin and its receptor SSTR4 in the migration of hepatic oval cells. Lab Invest. 2006;86:477-489. [PubMed] [DOI] |
| 15. | Song SH, Leng XS, Li T, Qin ZZ, Peng JR, Zhao L, Wei YH, Yu X. Expression of subtypes of somatostatin receptors in hepatic stellate cells. World J Gastroenterol. 2004;10:1663-1665. [PubMed] |