修回日期: 2010-08-04
接受日期: 2010-08-17
在线出版日期: 2010-09-28
目的: 探讨β-catenin、Wnt1、Smad4、Hoxa9、Bmi-1基因与食管鳞癌(esophageal squamous cell carcinoma, ESCC)预后及临床病理的关系.
方法: 从南京医科大学附属第一医院2002-07/2003-12 106例ESCC石蜡标本中随机选取70例. 运用免疫组织化学及实时定量PCR检测70例ESCC患者肿瘤切除石蜡标本中待测基因的mRNA及蛋白表达水平, 统计学分析其与ESCC预后及临床病理的关系.
结果: ESCC中的β-catenin、Wnt1、Smad4、Hoxa9、Bmi-1 mRNA表达水平明显高于癌旁组织(0.0821±0.0416 vs 0.0185±0.0201, P = 0.0000; 1.9934±1.9888 vs 0.8863±0.6658, P = 0.0184; 0.0298±0.0215 vs 0.0189±0.0187, P = 0.0017; 2.098±0.091 vs 1.016±0.078, P = 0.0000; 2.181±2.158 vs 0.931±0.894, P = 0.0152). ESCC中的β-catenin、Wnt1、Smad4、Hoxa9、Bmi-1的蛋白水平明显高于癌旁组织(0.2835±0.0844 vs 0.2352±0.0670, P = 0.0003; 0.3830±0.0947 vs 0.2721±0.1474, P = 0.0000; 0.2637±0.0348 vs 0.2042±0.0180, P = 0.0000; 0.2058±0.0316 vs 0.1218±0.0518, P = 0.0000; 0.2736±0.0834 vs 0.2251±0.0571, P = 0.0001). 除Smad4外, 待测基因mRNA及蛋白质表达水平均与病理分期和淋巴结转移相关(均P<0.05), 高表达者预后较差(均P<0.05), 但Hoxa9蛋白质表达水平与预后无关(P>0.05). Smad4 mRNA表达水平与病理分期和淋巴结转移相关(均P<0.05), mRNA低水平表达者预后欠佳(均P<0.05); 蛋白质表达水平与病理分期有关(P<0.05), 但与淋巴结转移无关(P>0.05), 与患者预后无关(P>0.05). Logistic多因素分析显示预后有关的因素有β-catenin、Wnt1、Bmi-1表达阳性或Wnt1及β-catenin二者表达阳性者或Wnt1、β-catenin、Bmi-1三者表达阳性者(χ2 = 17.65, P = 0.0072).
结论: Wnt1/β-catenin、Bmi-1高表达者预后不佳, 表达水平与ESCC临床病理分期、淋巴结转移呈逆相关; Smad4、Hoxa9 mRNA表达水平虽与ESCC预后及临床病理分期、淋巴结转移相关, 但可能不是独立的预后因素.
引文著录: 吕进, 曹秀峰, 纪律, 朱斌, 陶磊, 王冬冬. β-catenin、Wnt1、Smad4、Hoxa9、Bmi-1与食管鳞癌预后的关系. 世界华人消化杂志 2010; 18(27): 2874-2883
Revised: August 4, 2010
Accepted: August 17, 2010
Published online: September 28, 2010
AIM: To investigate the association of β-catenin, Wnt1, Smad4, Hoxa9 and Bmi-1 expression with the prognosis and clinicopathologic characteristics of patients with esophageal squamous cell carcinoma (ESCC).
METHODS: Seventy paraffin-embedded ESCC specimens collected at Nanjing First Hospital from July 2002 to December 2003 were studied. The mRNA and protein expression of β-catenin, Wnt1, Smad4, Hoxa9 and Bmi-1 in these specimens was detected by real-time quantitative RT-PCR and immunohistochemistry. The correlation between the expression of these markers with the prognosis and clinicopathologic characteristics of ESCC patients was then analyzed.
RESULTS: The mRNA expression levels of β-catenin, Wnt1, Smad4, Hoxa9 and Bmi-1 in ESCC were significantly higher than those in tumor-adjacent non-cancerous tissue (0.0821 ± 0.0416 vs 0.0185 ± 0.0201, P = 0.0000; 1.9934 ± 1.9888 vs 0.8863 ± 0.665, P = 0.0184; 0.0298 ± 0.0215 vs 0.0189 ± 0.0187, P = 0.0017; 2.098 ± 0.091 vs 1.016 ± 0.078, P = 0.0000; 2.181 ± 2.158 vs 0.931 ± 0.894, P = 0.0152). The protein expression levels of β-catenin, Wnt1, Smad4, Hoxa9 and Bmi-1 in ESCC were also significantly higher than those in tumor-adjacent non-cancerous tissue (0.2835 ± 0.0844 vs 0.2352 ± 0.0670, P = 0.0003; 0.3830 ± 0.0947 vs 0.2721 ± 0.1474, P = 0.0000; 0.2637 ± 0.0348 vs 0.2042 ± 0.0180, P = 0.0000; 0.2058 ± 0.0316 vs 0.1218 ± 0.0518, P = 0.0000; 0.2736 ± 0.0834 vs 0.2251 ± 0.0571, P = 0.0001). Except for Smad4, the mRNA and protein levels of all the other markers were closely associated with pathological stage and lymph node metastasis in ESCC patients (all P < 0.05). The protein level of Hoxa9 was not associated with the prognosis of ESCC (P > 0.05). The hypo-expression of Smad4 mRNA was closely associated with advanced pathological stage, lymph node metastasis and prognosis in patients with ESCC (all P < 0.05). The Smad4 protein expression level was associated with pathological stage (P < 0.05), but not with prognosis and lymph node metastasis (P > 0.05). Multivariate logistic regression analysis showed that the prognostic factors for ESCC patients included positive protein expression of β-catenin, Wnt1 or Bmi-1 (χ2 = 17.65, P = 0.0072).
CONCLUSION: The prognosis of ESCC patients with Wnt1/β-catenin and Bmi-1 overexpression is relatively poor. The levels of Wnt1/β-catenin and Bmi-1 are conversely correlated with advanced pathological stage and lymph node metastasis in ESCC. Although the mRNA expression levels of Smad4 and Hoxa9 are also associated with prognosis, pathological stage and lymph node metastasis in ESCC patients, they might not be independent prognostic factors for ESCC.
- Citation: Lv J, Cao XF, Ji L, Zhu B, Tao L, Wang DD. Relationship of β-catenin, Wnt1, Smad4, Hoxa9 and Bmi-1 expression with the prognosis of esophageal squamous cell carcinoma. Shijie Huaren Xiaohua Zazhi 2010; 18(27): 2874-2883
- URL: https://www.wjgnet.com/1009-3079/full/v18/i27/2874.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i27.2874
食管鳞癌(esophageal squamous cell carcinoma, ESCC)是世界上常见的恶性肿瘤之一, 居癌性死因第7位, 具有一定的地域相关性[1]. 在食管癌的临床诊治过程中, 经典的TNM病理分期系统起着重要作用, 但由于肿瘤异质性和个体的不同在临床应用中并不能完全准确反映患者病情的进展程度. 寻找新的肿瘤标志物和判断预后的分子指标, 作为TNM病理分期系统的有益补充, 对指导个体治疗和评价预后将很有帮助. 目前除了环境因素的影响, 有关ESCC的分子生物学研究已受到世界广泛关注, 但仍有众多分子机制作用很不明朗.
前期研究我们通过人癌通路发现者基因芯片和肿瘤信号转导基因芯片筛选出ESCC和正常食管黏膜组织中差异表达增高2倍以上的基因β-catenin、Wnt1、Smad4、Hoxa9及Bmi-1[2]. 在此基础上, 本研究通过实时定量PCR(Real-time PCR, RT-PCR)和免疫组织化学进一步探讨ESCC组织中这些基因的mRNA、蛋白质表达水平及其与临床病理、预后之间的关系, 判断这些基因在ESCC诊治方面应用的前景.
从南京医科大学附属第一医院2002-07/2003-12 106例ESCC石蜡标本中随机选取70例用于免疫组织化学及RT-PCR检测(包括肿瘤组织和癌旁组织标本), 患者的一般资料见表1. 患者术前均通过食管内镜活检确诊, 未经其他术前治疗. 所有患者均给予根治性手术. 术后标本根据2002年美国癌症分期联合委员会(American Joint Committee on Cancer Staging, AJCC)制定的肿瘤大小, 淋巴结及其转移率的病理级别(pathological grade of tumor size and lymph node and metastasis, PTNM)分期标准进行分期[3]. 术后患者通过电话或门诊获得随访. 70例患者随访时间为术后至2009-10-31, 中位生存期为42.0(8-84) mo, 4例失访(5.7%).
| 一般特性 | 患者资料 |
| 年龄(中位年龄, 岁) | 38-82(60) |
| 性别n(%) | |
| 男 | 51(72.9) |
| 女 | 19(27.1) |
| 肿瘤分段n(%) | |
| 颈段 | 3(4.3) |
| 上胸段 | 13(18.6) |
| 中胸段 | 39(55.7) |
| 下胸段 | 15(21.4) |
| 肿瘤长度(中位数, mm) | 10-90(44) |
| AJCC分期n(%) | |
| Ⅰ-Ⅱ期 | 56(80.0) |
| Ⅲ-Ⅳ期 | 14(20.0) |
| 淋巴结转移n(%) | |
| 无淋巴结转移 | 25(35.7) |
| 有淋巴结转移 | 45(64.3) |
| 细胞分化n(%) | |
| 高分化 | 12(17.2) |
| 中分化 | 43(61.4) |
| 低分化 | 15(21.4) |
1.2.1 RT-PCR: 从70例ESCC石蜡切片中提取总RNA, 纯化, 合成cDNA, 设计待测基因双向引物(表2). 标记后进行RT-PCR反应. 待测基因mRNA模板拷贝数以β-actin为内参得出校正后的mRNA表达的相对值[4].
| 基因 | 双向引物序列 | 退火温度(℃) | 产物长度(bp) |
| β-actin | F 5'CCTGTACGCCAACACAGTGC3' | ||
| R 5'ATACTCCTGCTTGCTGATCC3' | 60 | 211 | |
| Wnt1 | F 5'CAGAGCCACGAGTTTGGATGTT3' | ||
| R 5'GATTGGGTTGGGTTGGAGGT3' | 60 | 92 | |
| β-catenin | F 5'AAAATGGCAGTGCGTTTAG3' | ||
| R 5'TTTGAAGGCAGTCTGTCGTA3' | 60 | 100 | |
| Bmi-1 | F 5'GTATTCCCTCCACCTCTTCTTG3' | ||
| R 5'TGCTGATGACCCATTTACTGAT3' | 60 | 176 | |
| Smad4 | F 5'ATGGATACGTGGACCCTTCT3' | ||
| R 5'CTCAATGGCTTCTGTCCTGT3' | 60 | 80 | |
| Hoxa9 | F 5'CTCTAAACCTCAGGCCACATC3' | ||
| R 5'CAATACCTCCTCCATCAAAGC3' | 60 | 85 |
1.2.2 免疫组织化学SABC法: 制成4 μm厚的石蜡切片. 一抗+生物素标记二抗+滴加试剂SABC(链霉卵白素+辣根酶标记生物素)+辣根酶底物显色. 脱水、透明、封固. 每张切片吸光度的平均值记为蛋白质表达水平.
统计学处理 应用stata10.0软件. 临床参数之间的比较采用t检验、方差分析、卡方检验和Fisher's确切概率法. Kaplan-Meier和Log-rank分析生存率. 双侧P<0.05有显著统计学意义.
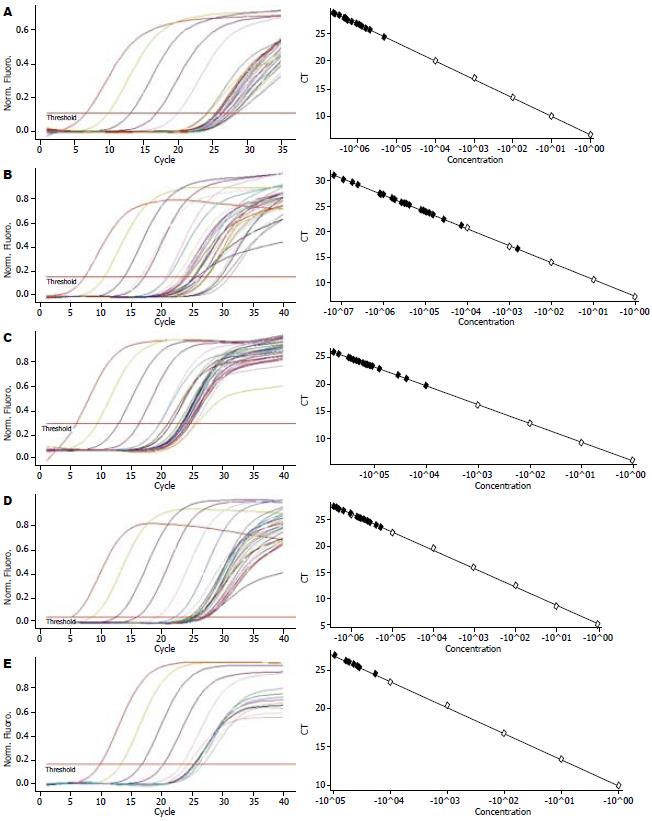
2.1.1 RT-PCR检测结果: Wnt1、β-catenin、Bmi-1、Smad4及Hoxa9 RT-PCR的扩增曲线及标准曲线见图1.
2.1.2 食管癌相关基因与ESCC临床资料及病理分期之间的关系: ESCC组织中β-catenin、Wnt1、Smad4、Bmi-1及Hoxa9的mRNA表达水平明显高于癌旁非癌组织. mRNA表达水平均与性别、年龄无关(P>0.05), 但均与淋巴结转移、病理分期密切相关(P<0.05, 表3).
| 临床病理因素 | Wnt1 | β-catenin | Bmi-1 | Smad4 | Hoxa9 |
| 组织分类 | 0.0184 | 0.0000 | 0.0152 | 0.0017 | 0.0000 |
| 癌组织 | 1.9934±1.9888 | 0.0821±0.0416 | 2.1810±2.1580 | 0.0298±0.0215 | 2.0980±0.0910 |
| 癌旁组织 | 0.8863±0.6658 | 0.0185±0.0201 | 0.9310±0.8940 | 0.0189±0.0187 | 1.0160±0.0780 |
| 病理分期 | <0.0001 | 0.0186 | 0.0001 | 0.0003 | 0.0000 |
| Ⅰ-Ⅱ期 | 0.2685±0.0984 | 0.0268±0.0416 | 1.5900±0.7350 | 0.0235±0.0052 | 2.0650±0.0584 |
| Ⅲ-Ⅳ期 | 0.6870±0.3530 | 0.0658±0.0894 | 3.8270±2.6730 | 0.0173±0.0062 | 2.8490±1.0090 |
| 淋巴结转移 | <0.0001 | 0.0048 | 0.0003 | 0.0000 | 0.0093 |
| + | 0.7125±0.3659 | 0.0721±0.0569 | 3.5800±2.4870 | 0.0166±0.0057 | 2.6860±0.9484 |
| - | 0.2511±0.0928 | 0.0232±0.0829 | 1.7030±0.7580 | 0.0239±0.0053 | 2.1230±0.6040 |
| 分化程度 | 0.1361 | 0.1423 | 0.0000 | 0.0000 | 0.1299 |
| 低分化 | 1.3995±1.2760 | 0.0959±0.0261 | 3.5800±2.4870 | 0.0274±0.0124 | 2.4047±0.0611 |
| 中分化 | 1.1735±1.0862 | 0.0753±0.0826 | 1.8580±0.9790 | 0.0179±0.0109 | 2.3067±0.0809 |
| 高分化 | 0.5909±0.5665 | 0.0911±0.0566 | 0.8810±0.4180 | 0.0154±0.0101 | 2.2491±0.0924 |
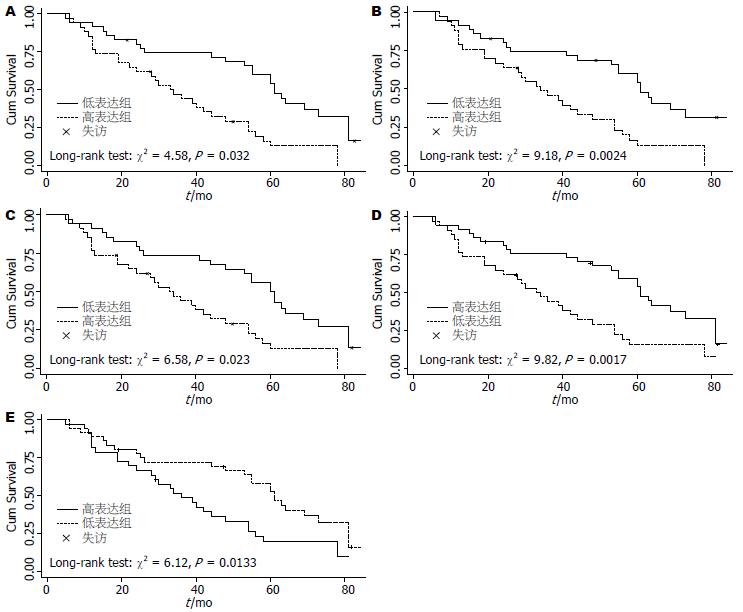
2.1.3 食管癌相关基因mRNA的表达水平与ESCC患者预后的关系: β-catenin、Wnt1、Smad4、Hoxa9及Bmi-1 mRNA的中位表达水平分别为: 0.0385、0.166、0.0118、1.3、0.5935. 以其为参考值, 高于参考值的为高表达组, 反之为低表达组. β-catenin、Wnt1、Bmi-1及Hoxa9 mRNA高表达者预后较差, Smad4 mRNA低表达者预后较差(图2).
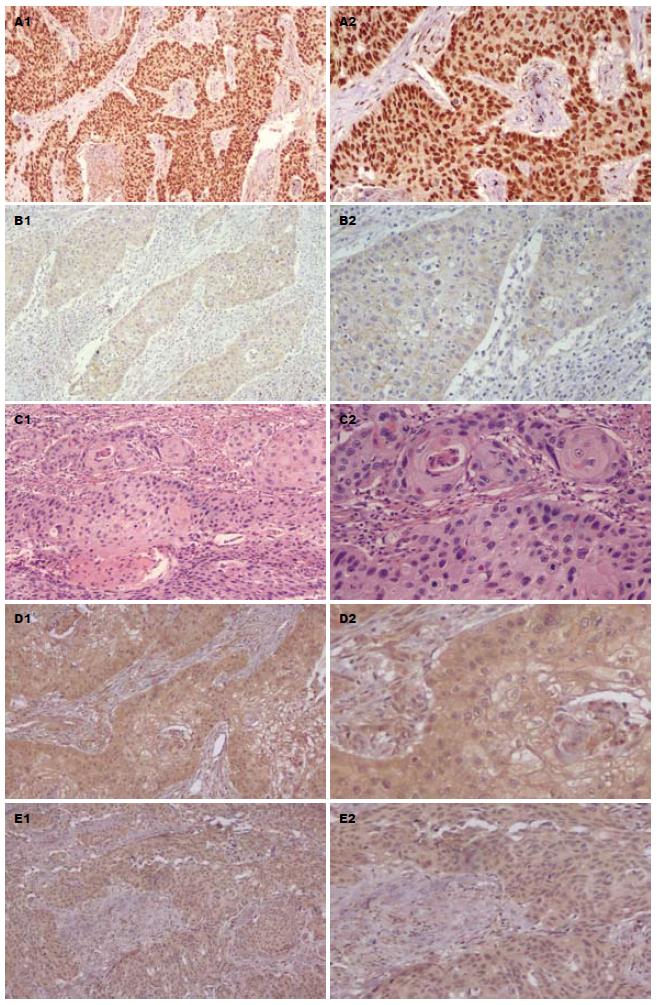
2.2.1 食管癌相关基因与临床资料及病理分期之间的关系: ESCC组织中β-catenin、Wnt1、Smad4、Hoxa9及Bmi-1的蛋白表达水平较癌旁非癌组织明显高表达(图3). 蛋白表达水平均与性别、年龄无关(P>0.05), 但均和病理分期密切相关(P<0.05). 除Smad4蛋白表达水平与淋巴结转移无关外(P>0.05), 其余均与淋巴结转移相关(P<0.05, 表4).
| 临床病理因素 | Wnt1 | β-catenin | Bmi-1 | Smad4 | Hoxa9 |
| 组织分类 | 0.0000 | 0.0003 | 0.0001 | 0.0000 | 0.0000 |
| 癌组织 | 0.3830±0.0947 | 0.2835±0.0844 | 0.2736±0.0834 | 0.2637±0.0348 | 0.2058±0.0316 |
| 癌旁组织 | 0.2721±0.1474 | 0.2352±0.0670 | 0.2251±0.0571 | 0.2042±0.0180 | 0.1218±0.0518 |
| 病理分期 | 0.0144 | 0.0147 | 0.0208 | 0.0006 | 0.0349 |
| Ⅰ-Ⅱ期 | 0.3221±0.1021 | 0.2380±0.0642 | 0.2371±0.0531 | 0.2756±0.0528 | 0.1756±0.0457 |
| Ⅲ-Ⅳ期 | 0.3933±0.0548 | 0.2899±0.0881 | 0.2788±0.0791 | 0.2238±0.0149 | 0.2026±0.0194 |
| 淋巴结转移 | 0.0047 | 0.0189 | 0.0023 | 0.1799 | 0.0001 |
| + | 0.3891±0.1024 | 0.2739±0.0619 | 0.2993±0.0724 | 0.2598±0.0384 | 0.1948±0.0285 |
| - | 0.3170±0.0920 | 0.2298±0.0910 | 0.2389±0.0834 | 0.2739±0.0472 | 0.1593±0.0427 |
| 分化程度 | 0.5070 | 0.9070 | 0.9160 | 0.9340 | 0.9670 |
| 低分化 | 0.3817±0.0831 | 0.2908±0.0933 | 0.2817±0.0917 | 0.2623±0.0406 | 0.1701±0.0316 |
| 中分化 | 0.3796±0.1029 | 0.2785±0.0826 | 0.2674±0.0715 | 0.2532±0.0312 | 0.1732±0.0132 |
| 高分化 | 0.3967±0.0827 | 0.2920±0.0873 | 0.2819±0.0762 | 0.2605±0.0301 | 0.1825±0.0321 |
2.2.2 食管癌相关基因的蛋白表达水平与ESCC患者预后的关系: β-catenin、Wnt1、Smad4、Hoxa9及Bmi-1蛋白的中位表达水平分别为: 0.2491、0.3784、0.2293、0.1734、0.2382, 以其为参考, 将患者分为高表达组和低表达组. β-catenin、Wnt1及Bmi-1高表达组预后较差, Smad4、Hoxa9分析无统计学意义(P>0.05, 表5).
| 5年生存率(中位生存时间) %(mo) | χ2值 | P值 | ||
| 高表达组 | 低表达组 | |||
| β-catenin | 25.3(23.0) | 35.6(30.0) | 3.1085 | 0.0446 |
| Wnt1 | 24.5(22.5) | 42.1(33.5) | 3.8068 | 0.0352 |
| Smad4 | 32.3(26.5) | 38.9(31.0) | 2.1085 | 0.0646 |
| Hoxa9 | 32.3(26.0) | 37.4(29.0) | 1.8123 | 0.0859 |
| Bmi-1 | 26.8(25.5) | 45.7(36.0) | 4.0974 | 0.0318 |
2.2.3 食管癌相关基因蛋白表达联合检测结果及与预后之间的关系: 以癌组织中目标蛋白染色强于或等同于非癌组织染色为阳性, 以癌组织中目标蛋白染色弱于非癌组织或无染色为阴性. 对70例ESCC患者β-catenin、Wnt1、Smad4、Hoxa9及Bmi-1蛋白表达与预后之间的关系通过Logistic回归分析进行多因素分析, 得出与预后有关的因素有β-catenin、Wnt1、Bmi-1、Wnt1及β-catenin二者表达阳性或Wnt1、β-catenin及Bmi-1三者表达阳性(总χ2 = 17.65, P = 0.0072, 表6).
| 变量 | 比数比值 | 标准误差 | Z统计量 | P值 | 95%CI |
| β-catenin | 0.0345371 | 0.0322135 | -2.12 | 0.002 | 0.0092133-0.1440125 |
| Wnt-1 | 0.0462245 | 0.0401351 | -3.01 | 0.001 | 0.0045402-0.2501234 |
| Bmi-1 | 0.0516528 | 0.0512158 | -2.81 | 0.001 | 0.0060348-0.3604512 |
| Wnt1+β-catenin | 0.0456564 | 0.0432686 | -3.26 | 0.001 | 0.0071255-0.2925401 |
| Wnt1+β-catenin+Bmi-1 | 0.0871797 | 0.0645319 | -3.30 | 0.001 | 0.00204334-0.3719543 |
根据作用机制和发挥功能的不同, Wnt信号通路分为典型和非典型两种通路, 均由细胞外的Wnt捆绑于卷曲的跨膜受体来激活[5]. 典型Wnt通路中, Wnt捆绑于跨膜受体(frizzled, FZD)和低浓度脂蛋白受体相关蛋白(low-density lipoprotein receptor-related protein, LRP)家族, 从而抑制β-catenin降解复合体[6], β-catenin在细胞质中蓄积并进入细胞核内, 捆绑于T淋巴细胞因子/淋巴增强因子(T-cell factor, TCF/lymphoid enhancer factor, LEF)家族激活Wnt的靶基因, 导致细胞程序和转化的改变而调节细胞增殖和凋亡[7-9]; 而非典型Wnt信号通路则有许多不同的下游效应器, 由FZD家族的受体和复合受体所介导, 从而控制细胞的运动和组织的极性[10]. 有研究证实, Wnt/β-catenin将为肿瘤的分子靶向治疗提供新的手段[11,12]. 已有研究显示在富含Wnt1分子的条件培养基中生长的ESCC细胞, 胞质中β-catenin蓄积, 进而激活TCF依赖的转录[13]. 因此, 探究Wnt1/β-catenin在ESCC中发挥怎样的作用就显得非常重要. 而Bmi-1作为维持复合体(polycomb repressive complex 1, PRC1)的组成之一, 抑制INK4A/ARF抑癌基因簇编码的p16INK4a和p19ARF抑癌蛋白, 进而抑制体内两条主要的细胞周期调控通路-pRb信号通路和P53信号通路, 发挥原癌基因作用[14], 且与Wnt/β-catenin信号通路的众多靶基因存在交集, 通过抑制细胞衰老和凋亡, 维持肿瘤干细胞活性等在肿瘤的发生及发展中发挥着重要作用. 但Bmi-1在ESCC发病过程中的作用有待证实.
本研究发现在ESCC组织中β-catenin mRNA异常表达明显, 表达水平与ESCC患者淋巴结转移和病理分期有关, 其中β-catenin高表达者预后较差, 病理分期Ⅲ-Ⅳ期患者β-catenin的表达水平明显高于Ⅰ-Ⅱ期患者, 与前期研究结果一致[4]. 为进一步验证β-catenin与ESCC临床病理及预后的关系, 继以免疫组织化学的方法在蛋白质水平上对其进行分析. 结果显示ESCC中的β-catenin蛋白表达水平较癌旁非癌组织明显增高(P<0.05), 且与病理分期、淋巴结转移相关, 表达水平影响患者5年生存率(P<0.05). 纵观文献, β-catenin在食管癌中的异常表达率与预后及临床病理指标之间的关系报道不一. Nakanishi等[15]报道β-catenin在食管癌细胞膜表达减弱为73%, β-catenin的表达与病理分化程度呈正相关, 但无预后价值. Krishnadath等[16]报道食管癌中β-catenin的减弱表达率为72%, β-catenin的异常表达与病理分化程度、较短生存期有关(P<0.01), 他们认为β-catenin减弱表达与不良预后有关. 而Osterheld等[17]报道食管癌的β-catenin异常表达率为61%, β-catenin异常表达与病理分化、淋巴结转移无关, β-catenin异常表达与较好预后相关. 以上研究样本量较小且主要是利用免疫组织化学的方法来测定食管癌标本中的β-catenin蛋白表达的含量, 未检测食管标本β-catenin基因变化的水平. 本研究通过RT-PCR及免疫组织化学技术观察β-catenin转录水平和蛋白质水平在ESCC组织中的变化, 二者是一致的, 且在与患者临床病理分期及预后的相关性上保持一致.
结果同时还显示了Wnt1在转录水平和蛋白质水平上的表达及其对临床病理和预后影响上的一致性. Wnt1在ESCC中较癌旁组织中显著高表达(P<0.05), 结合β-catenin在ESCC中转录后水平和蛋白质水平的高表达, 提示在ESCC中Wnt1诱导β-catenin/TCF转录, 这与文献报道一致[13]. 结果显示Wnt1 mRNA水平及蛋白水平均与病理分期、淋巴结转移密切相关(均P<0.05), 在进展期和有淋巴结转移的样本中, 都显示出高表达, 这在很大程度上说明Wnt1在ESCC的进展期而不是起始阶段发挥作用, 同时发现他与肿瘤细胞的分化程度没有关系(P>0.05). 由此, Wnt1/β-catenin在ESCC的发展过程中发挥重要作用, 并有可能成为食管鳞癌判断疾病分期和预后的重要分子标志物.
本研究证实一系列细胞分化调控信号传导通路相关基因如Wnt1、β-catenin、Bmi-1在ESCC组织较相应癌旁组织明显高表达, 这和Bmi-1的原癌基因角色是一致的, 表明Bmi-1过表达导致信号传导通路异常而引起细胞分化调控障碍可能与ESCC的发生、发展有关. 同时发现, Bmi-1 mRNA表达水平与性别、年龄无关, 但与淋巴结转移、细胞分化、病理分期密切相关(P<0.05). 这些证据提示Bmi-1在ESCC的中晚期发生浸润转移过程中可能起重要作用. 淋巴结转移和临床分期均与食管癌的诊治和预后关系密切, 临床分期高和/或出现淋巴结转移的患者多数预后不良, 这在本实验中得到证实, Bmi-1 mRNA高表达组预后差(P<0.05). 这些证据说明Bmi-1有可能作为预测食管癌患者的转移和预后的分子标志物. 而且在其蛋白表达水平上, Bmi-1对患者病理分期、淋巴结转移及预后的影响也显示了与其转录水平一致.
Smad4最初作为肿瘤抑癌基因被发现, 又称DPC4(deleted in pancreatic cancer 4)位于染色体18q21.1[18,19], 是调节转录和TGF-β抗增殖应答的重要分子, TGF-β介导的生长抑制功能可被显性失活的Smad4全部抑制. 近年来证实Smad4表达水平与一些恶性肿瘤发生、发展、生物学行为及其预后有密切关系, 阳性与阴性表达者比较, Smad4阳性表达者肿瘤多分化好、生长速度慢, 侵袭和转移能力弱[20]. 我们通过RT-PCR分析发现, Smad4 mRNA表达的下降与ESCC的发生、发展及生物学行为有关, 低表达者预后欠佳. 随着病理分期的进展, Smad4的表达逐渐减少, 在Ⅲ-Ⅳ期肿瘤中Smad4 mRNA表达水平低于Ⅰ-Ⅱ期肿瘤, 且有显著性差异, 提示Smad4在ESCC中表达的减少, 影响了TGF-β信号从细胞膜向细胞核的传导, 使其对ESCC细胞的抑制作用减弱, 促进了肿瘤的发生发展. 另外, Smad4 mRNA表达的减少和细胞分化程度有一定相关性, Smad4在细胞分化好的ESCC组织比分化较差的ESCC组织中表达水平高. 从另外的角度证实了在食管癌的发生发展过程中, Smad4扮演的是一个抑癌基因的角色. 但有趣的是, 免疫组织化学结果并未显示出与其mRNA表达的完全一致性, 这与以往研究结果是一致的[21], 其蛋白表达水平除了与病理分期有关外, 与其他并未显示相关性, 且与预后的关系未显示出统计学意义. 考虑其原因除可能是样本偏倚外, 也提示Smad4不是独立的预后因素, 在蛋白质水平上可能有其他基因的异常表达参与了ESCC的进展或由于某种尚未明了的机制导致了Smad4的翻译阶段或其蛋白的不稳定性, 这种机制是否是因TGF-β信号传导复合体某种成分的降解或Smad4或其家族的突变所致, 值得进一步研究.
Hoxa9是同源盒基因家族中的一员. 同源盒基因在生物的发育过程中发挥着重要的作用, 近年来, 不断有研究发现同源盒基因在恶性肿瘤, 特别是血液系统恶性疾病发病过程中起重要作用, 实体肿瘤中的异常表达也有相继报道, 研究发现在肺癌和恶性黑色素瘤中, 同源盒基因的表达水平与是否转移有相关性[22-30]. 本研究发现Hoxa9 mRNA表达水平与ESCC淋巴结转移、病理分期密切相关(P<0.05), 且高表达者预后差. 与Smad4一样, 免疫组织化学结果并未显示一致性, 考虑除样本偏倚外, Hoxa9在ESCC的发生发展过程中并不是一个独立的预后因素, 其同源盒基因家族众多成员均有可能影响Hoxa9或产生交互作用, 其中机制需要进一步研究.
研究结果同时显示Wnt1/β-catenin、Bmi-1三者或二者蛋白表达阳性者预后相对不佳. 虽只是一个定性观察, 但还是从侧面支持了在影响ESCC预后因素中Wnt1/β-catenin、Bmi-1这三者的重要性, 并且Logistic回归分析结果也显示了Wnt1/β-catenin二者表达阳性者或Wnt1/β-catenin、Bmi-1三者表达阳性者ESCC预后的风险显著升高. 由于Bmi-1与Wnt/β-catenin信号通路的众多靶基因存在交集, 这或许可以解释Wnt1/β-catenin、Bmi-1三者或二者蛋白表达阳性者ESCC预后的风险显著升高的原因.
总之, 本实验研究结果表明Wnt1/β-catenin、Bmi-1 mRNA表达水平与蛋白表达水平是一致的, 高表达者ESCC患者预后不佳, 表达水平与ESCC临床病理分期、淋巴结转移呈逆相关; Smad4、Hoxa9 mRNA表达水平与蛋白表达水平并未显示一致性, Smad4、Hoxa9 mRNA表达水平虽与ESCC预后及临床病理分期、淋巴结转移相关, 但可能不是独立的预后因素, 有必要通过大宗实验、更完善的随访方式和更先进的实验技术进一步验证.
在食管癌的临床诊治过程中, 经典的TNM病理分期系统起着重要作用, 但由于肿瘤异质性和个体的不同, 在临床应用中并不能完全准确反映患者病情的进展程度. 寻找新的肿瘤标志物和判断预后的分子指标, 作为TNM病理分期系统的有益补充, 对指导个体治疗和评价预后将很有帮助.
张军, 教授, 西安交通大学医学院第二附属医院消化内科
目前除了环境因素的影响, 有关ESCC的分子生物学研究已受到世界广泛的关注, 但仍有众多分子机制作用很不明朗.
Osterheld等报道食管癌的β-catenin异常表达率为61%, β-catenin异常表达与病理分化、淋巴结转移无关, β-catenin异常表达与较好预后相关.
通过人癌通路发现者基因芯片和肿瘤信号转导基因芯片筛选出ESCC和正常食管黏膜组织中差异表达增高2倍以上的基因β-catenin、Wnt1、Smad4、Hoxa9及Bmi-1, 继之探讨他们在转录水平及蛋白水平上与ESCC的关系. 与既往研究相比, 更具连续性、系统性、完整性, 且有长期随访资料.
本研究通过实时定量PCR和免疫组织化学探讨ESCC组织中和正常食管黏膜组织中差异表达增高2倍以上的基因β-catenin、Wnt1、Smad4、Hoxa9及Bmi-1的mRNA及蛋白质表达水平及其与临床病理、预后之间的关系, 判断这些基因在ESCC诊治方面的应用前景.
文章及研究完成过程中, 作者的确做了大量工作, 有一定的参考价值, 但研究内容重要性及新颖性一般.
编辑: 李军亮 电编:何基才
| 1. | Fisichella PM, Patti MG. Esophageal Cancer. eMedicine: Oncology, 2008-08-26; cited 2010-09-28. Available from: http://emedicine.medscape.com/article/277930-overview. |
| 2. | 纪 律. 食管癌基因谱与临床病理及预后的相关性. 南京: 南京医科大学 2007; 1-84. |
| 3. | Greene FL, American Joint Committee on Cancer, American Cancer Society. AJCC cancer staging manual. New York: Springer 2002; 91-98. [DOI] |
| 4. | Ji L, Cao XF, Wang HM, Li YS, Zhu B, Xiao J, Wang D. Expression level of beta-catenin is associated with prognosis of esophageal carcinoma. World J Gastroenterol. 2007;13:2622-2625. [PubMed] |
| 5. | James RG, Conrad WH, Moon RT. Beta-catenin-independent Wnt pathways: signals, core proteins, and effectors. Methods Mol Biol. 2008;468:131-144. [PubMed] [DOI] |
| 6. | Corrigan PM, Dobbin E, Freeburn RW, Wheadon H. Patterns of Wnt/Fzd/LRP gene expression during embryonic hematopoiesis. Stem Cells Dev. 2009;18:759-772. [PubMed] [DOI] |
| 7. | Barker N, Clevers H. Mining the Wnt pathway for cancer therapeutics. Nat Rev Drug Discov. 2006;5:997-1014. [PubMed] [DOI] |
| 8. | Dihlmann S, von Knebel Doeberitz M. Wnt/beta-catenin-pathway as a molecular target for future anti-cancer therapeutics. Int J Cancer. 2005;113:515-524. [PubMed] [DOI] |
| 9. | Huang M, Wang Y, Sun D, Zhu H, Yin Y, Zhang W, Yang S, Quan L, Bai J, Wang S. Identification of genes regulated by Wnt/beta-catenin pathway and involved in apoptosis via microarray analysis. BMC Cancer. 2006;6:221. [PubMed] [DOI] |
| 10. | Katoh M, Katoh M. WNT signaling pathway and stem cell signaling network. Clin Cancer Res. 2007;13:4042-4045. [PubMed] [DOI] |
| 11. | Paul S, Dey A. Wnt signaling and cancer development: therapeutic implication. Neoplasma. 2008;55:165-176. [PubMed] |
| 12. | Herbst A, Kolligs FT. Wnt signaling as a therapeutic target for cancer. Methods Mol Biol. 2007;361:63-91. [PubMed] |
| 13. | Mizushima T, Nakagawa H, Kamberov YG, Wilder EL, Klein PS, Rustgi AK. Wnt-1 but not epidermal growth factor induces beta-catenin/T-cell factor-dependent transcription in esophageal cancer cells. Cancer Res. 2002;62:277-282. [PubMed] |
| 14. | Jacobs JJ, Kieboom K, Marino S, DePinho RA, van Lohuizen M. The oncogene and Polycomb-group gene bmi-1 regulates cell proliferation and senescence through the ink4a locus. Nature. 1999;397:164-168. [PubMed] [DOI] |
| 15. | Nakanishi Y, Ochiai A, Akimoto S, Kato H, Watanabe H, Tachimori Y, Yamamoto S, Hirohashi S. Expression of E-cadherin, alpha-catenin, beta-catenin and plakoglobin in esophageal carcinomas and its prognostic significance: immunohistochemical analysis of 96 lesions. Oncology. 1997;54:158-165. [PubMed] [DOI] |
| 16. | Krishnadath KK, Tilanus HW, van Blankenstein M, Hop WC, Kremers ED, Dinjens WN, Bosman FT. Reduced expression of the cadherin-catenin complex in oesophageal adenocarcinoma correlates with poor prognosis. J Pathol. 1997;182:331-338. [PubMed] [DOI] |
| 17. | Osterheld MC, Bian YS, Bosman FT, Benhattar J, Fontolliet C. Beta-catenin expression and its association with prognostic factors in adenocarcinoma developed in Barrett esophagus. Am J Clin Pathol. 2002;117:451-456. [PubMed] [DOI] |
| 18. | Yanagisawa J, Yanagi Y, Masuhiro Y, Suzawa M, Watanabe M, Kashiwagi K, Toriyabe T, Kawabata M, Miyazono K, Kato S. Convergence of transforming growth factor-beta and vitamin D signaling pathways on SMAD transcriptional coactivators. Science. 1999;283:1317-1321. [PubMed] [DOI] |
| 19. | Hahn SA, Schutte M, Hoque AT, Moskaluk CA, da Costa LT, Rozenblum E, Weinstein CL, Fischer A, Yeo CJ, Hruban RH. DPC4, a candidate tumor suppressor gene at human chromosome 18q21.1. Science. 1996;271:350-353. [PubMed] [DOI] |
| 20. | Kim JY, Park DY, Kim GH, Choi KU, Lee CH, Huh GY, Sol MY, Song GA, Jeon TY, Kim DH. Smad4 expression in gastric adenoma and adenocarcinoma: frequent loss of expression in diffuse type of gastric adenocarcinoma. Histol Histopathol. 2005;20:543-549. [PubMed] |
| 21. | Fukuchi M, Masuda N, Miyazaki T, Nakajima M, Osawa H, Kato H, Kuwano H. Decreased Smad4 expression in the transforming growth factor-beta signaling pathway during progression of esophageal squamous cell carcinoma. Cancer. 2002;95:737-743. [PubMed] [DOI] |
| 22. | Cillo C, Barba P, Freschi G, Bucciarelli G, Magli MC, Boncinelli E. HOX gene expression in normal and neoplastic human kidney. Int J Cancer. 1992;51:892-897. [PubMed] [DOI] |
| 23. | De Vita G, Barba P, Odartchenko N, Givel JC, Freschi G, Bucciarelli G, Magli MC, Boncinelli E, Cillo C. Expression of homeobox-containing genes in primary and metastatic colorectal cancer. Eur J Cancer. 1993;29A:887-893. [PubMed] [DOI] |
| 24. | Cantile M, Cindolo L, Napodano G, Altieri V, Cillo C. Hyperexpression of locus C genes in the HOX network is strongly associated in vivo with human bladder transitional cell carcinomas. Oncogene. 2003;22:6462-6468. [PubMed] [DOI] |
| 25. | Waltregny D, Alami Y, Clausse N, de Leval J, Castronovo V. Overexpression of the homeobox gene HOXC8 in human prostate cancer correlates with loss of tumor differentiation. Prostate. 2002;50:162-169. [PubMed] [DOI] |
| 26. | Hamada Ji, Omatsu T, Okada F, Furuuchi K, Okubo Y, Takahashi Y, Tada M, Miyazaki YJ, Taniguchi Y, Shirato H, Miyasaka K, Moriuchi T. Overexpression of homeobox gene HOXD3 induces coordinate expression of metastasis-related genes in human lung cancer cells. Int J Cancer. 2001;93:516-525. [PubMed] [DOI] |
| 27. | Maeda K, Hamada J, Takahashi Y, Tada M, Yamamoto Y, Sugihara T, Moriuchi T. Altered expressions of HOX genes in human cutaneous malignant melanoma. Int J Cancer. 2005;114:436-441. [PubMed] [DOI] |
| 28. | Takahashi O, Hamada J, Abe M, Hata S, Asano T, Takahashi Y, Tada M, Miyamoto M, Kondo S, Moriuchi T. Dysregulated expression of HOX and ParaHOX genes in human esophageal squamous cell carcinoma. Oncol Rep. 2007;17:753-760. [PubMed] |
| 29. | Kok CH, Brown AL, Ekert PG, D'Andrea RJ. Gene expression analysis reveals HOX gene upregulation in trisomy 8 AML. Leukemia. 2010;24:1239-1243. [PubMed] [DOI] |
| 30. | Avraham A, Sandbank J, Yarom N, Shalom A, Karni T, Pappo I, Sella A, Fich A, Walfisch S, Gheber L. A similar cell-specific pattern of HOXA methylation in normal and in cancer tissues. Epigenetics. 2010;5:41-46. [PubMed] [DOI] |