修回日期: 2010-08-05
接受日期: 2010-08-10
在线出版日期: 2010-09-18
目的: 探讨低氧状态下上皮间质转化对SMMC- 7721中边缘群细胞的影响.
方法: 低氧培养SMMC-7721细胞, 动态观察细胞形态学变化, Western blot和免疫荧光检测上皮-间质转化(epithelial mesenchymal transition, EMT)相关指标钙粘连蛋白(E-cadherin)的表达, 通过流式细胞仪分析诱导前后边缘群(side population, SP)细胞含量的变化.
结果: 低氧诱导72 h后SMMC-7721细胞逐渐由原来的多角形变成类似于成纤维样的长梭形, 排列松散, E-cadherin的表达下调, 其相对定量值与正常培养相比, 差异具有显著意义(0.41±0.23 vs 2.03±0.43, P<0.01), SP细胞含量也明显降低(4.3% vs 0.0%, P<0.01).
结论: 低氧能够诱导肿瘤细胞SMMC-7721发生EMT, 同时SP细胞的含量下降. EMT可能抑制了肿瘤干细胞的增殖, 促进肿瘤细胞向侵袭和转移的方向发展.
引文著录: 王波, 夏羽佳, 晏维, 夏丽敏, 田德安. 肝癌细胞系SMMC-7721中边缘群细胞在低氧诱导的上皮间质转化调控下的表达. 世界华人消化杂志 2010; 18(26): 2750-2755
Revised: August 5, 2010
Accepted: August 10, 2010
Published online: September 18, 2010
AIM: To evaluate the influence of hypoxia-induced epithelial-mesenchymal transition (EMT) on side population cells in hepatocellular carcinoma cell line SMMC-7721.
METHODS: After SMMC-7721 cells were cultured under hypoxic conditions for 72 h, cell morphological changes were observed, E-cadherin expression was detected by Western blot and immunofluorescence, and the percentage of side population cells was analyzed by flow cytometry.
RESULTS: SMMC-7721 cells changed from a polygonal shape to a fibro-like fusiform shape after exposure to hypoxia for 72 h. Compared with control SMMC-7721 cells, E-cadherin expression was significantly down-regulated (0.41 ± 0.23 vs 2.03 ± 0.43, P < 0.01), and the percentage of SP cells were significantly reduced (4.3% vs 0.0%, P < 0.01) in SMMC-7721 cells cultured under hypoxic conditions for 72 h.
CONCLUSION: Hypoxia can activate EMT and reduce the percentage of side population cells in hepatocellular carcinoma SMMC-7721 cells, suggesting that EMT might promote the invasion and metastasis of hepatocellular carcinoma cells by suppressing the proliferation of cancer stem cells.
- Citation: Wang B, Xia YJ, Yan W, Xia LM, Tian DA. Influence of hypoxia-induced epithelial-mesenchymal transition on side population cells in hepatocellular carcinoma cell line SMMC-7721. Shijie Huaren Xiaohua Zazhi 2010; 18(26): 2750-2755
- URL: https://www.wjgnet.com/1009-3079/full/v18/i26/2750.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i26.2750
缺氧是实体瘤微环境的基本特征之一, 多数体积>1 mm3的实体瘤均含有相当数量的缺氧肿瘤细胞. 研究发现, 恶性肿瘤细胞在缺氧环境下会产生一系列生物学行为变化, 包括增殖、侵袭转移、对放疗和化疗的效果不佳等. 其分子机制一直是肿瘤学研究的热点之一[1].
上皮-间质转化(epithelial mesenchymal transition, EMT)最早被发育生物学家用来描述胚胎发育过程中某些特定部位的上皮细胞所发生的形态学改变, 发生EMT的上皮细胞在经历了短暂的结构改变后, 细胞的迁徙和运动能力增强. 目前认为EMT是一种重要的肿瘤侵袭和转移机制. 我们既往的研究发现转化生长因子β1(transforming growth factor-β1, TGF-β1)能够促使肝癌细胞SMMC-7721发生EMT. 缺氧对此细胞系是否也具备同样的诱导功能, 目前国内外报道较少.
新的肿瘤干细胞学说认为, 肿瘤组织中并非所有的肿瘤细胞都具有恶性特征, 只有肿瘤干细胞具有自我更新和分化潜能, 成为肿瘤增殖生长、转移和复发的根源[2-4]. 边缘群(side population, SP)细胞就代表的是这样一族肿瘤干细胞, 这些细胞对化疗药物有内在的高抵抗性, 即使大部分肿瘤细胞被常规化疗杀死, 只要残存SP细胞, 都可能引起肿瘤复发和转移[5].
原发性肝癌是我国最常见的消化系恶性肿瘤之一, 临床上病情常迅速进展, 预后极差. 因此针对肝癌的侵袭转移一直是该领域的研究热点. 本文试图探讨低氧是否诱导SMMC-7721发生EMT, 以及对SP细胞的影响, 以期为今后进一步研究肝癌复发转移提供新的理论依据.
人肝癌细胞系SMMC-7721由华中科技大学附属同济医院肝病研究所保存. DMEM培养基购自Gibco公司; 胎牛血清购自Clark公司; Hoechst 33342、碘化丙啶(propidium iodide, PI)和维拉帕米均购自Sigma公司; 人TGF-β购自英国Protech公司; 钙粘连蛋白(E-cadherin)兔抗人多克隆抗体购自Santa Cruz公司. FACS Aria流式细胞仪及其分析软件为美国BD公司产品.
1.2.1 常规细胞培养: SMMC-7721细胞用含青链霉素及100 mL/L胎牛血清的DMEM培养液在37 ℃、50 mL/L CO2饱和湿度条件下培养, 0.25%胰蛋白酶液消化传代, 取对数生长期细胞用于实验.
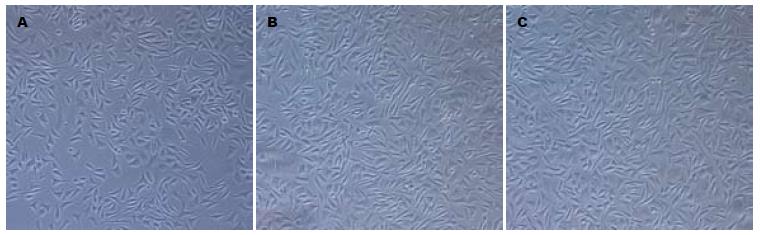
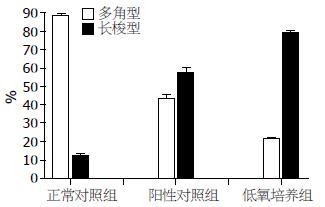
1.2.2 低氧细胞培养: SMMC-7721细胞设实验组和对照组. 实验组置低氧培养箱中培养, 其培养条件为10 mL/L O2, 50 mL/L CO2, 940 mL/L N2, 37 ℃. 对照组细胞培养方法同常规细胞培养, 以加入TGF-β1培养细胞为阳性对照, 培养72 h后, Olympus倒置显微镜观察细胞形态, 高倍镜下随机计数5个视野中多角形和长梭形细胞的数量, 计算其百分比.
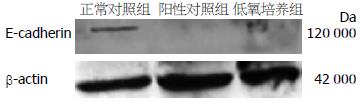
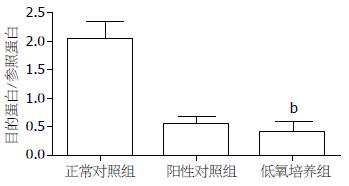
1.2.3 Western blot检测E-cadherin蛋白的表达: RIPA裂解液提取总蛋白, Bradford法检测其浓度. 取50 μg总蛋白进行电泳. 10% SDS-PAGE电泳完毕后将凝胶中的蛋白转移至硝酸纤维素膜上, 5%的封闭液封闭2 h, 加入一抗(兔抗人多克隆抗体, 1:100), 4 ℃过夜; 洗膜, 再加入二抗(羊抗兔IgG-HRP, 1:10 000)孵育1 h, 洗膜后进行ECL显色. 利用相关图像分析软件扫描分析条带的灰度值. 目的蛋白表达的相对强度 = 目的条带的灰度值/β-actin条带的灰度值.
1.2.4 免疫荧光法检测细胞E-cadherin蛋白的表达: 待上述各组SMMC-7721细胞在盖玻片上生长融合到90%-95%时, 取出以40 g/L的甲醛室温固定30 min; 0.2% Triton X-100透化5 min; 5%的封闭液室温封闭30 min; 加入一抗4 ℃过夜后, 加入二抗避光孵育30 min, 激光共聚焦显微镜观察蛋白定位表达情况.
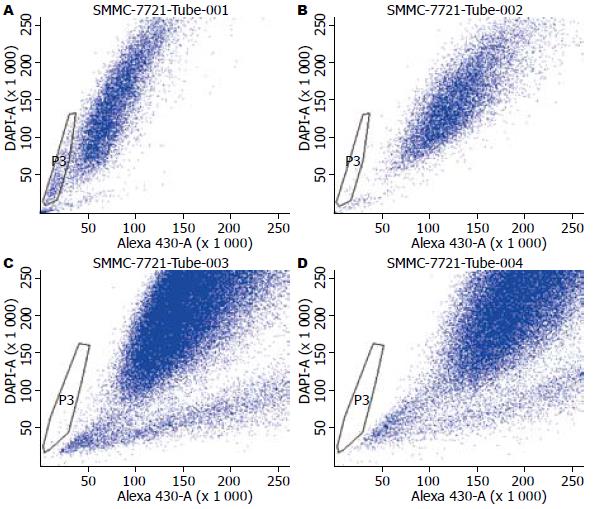
1.2.5 SP细胞分析: 调整细胞密度为1×106/mL, 加入Hoechst 33342至终浓度为10 m/L. 37 ℃恒温避光水浴90 min, 每15 min摇匀1次. 最后500 g于4 ℃离心5 min弃上清, 以4 ℃预冷的汉克平衡盐溶液重悬细胞. 在反应体系中加入PI使其终浓度为0.5 mg/L时上流式细胞仪检测. 仪器参数如下, 355 UV激发光源, 610 nm双色短通反射滤镜, 450 nm和675 nm边缘长通滤片分别散射蓝光和红光部分. 测量前向散射和侧向散射二维参数图, 检测细胞均一性, 将低蓝光低红光且维拉帕米组缺失区域设定为SP细胞的门(gate), 分析SMMC-7721细胞发生EMT时SP细胞的含量变化.
统计学处理 应用SPSS11.0软件进行统计分析, 实验数据以mean±SD表示, 各组间比较均采用t检验, P<0.05差异有统计学意义.
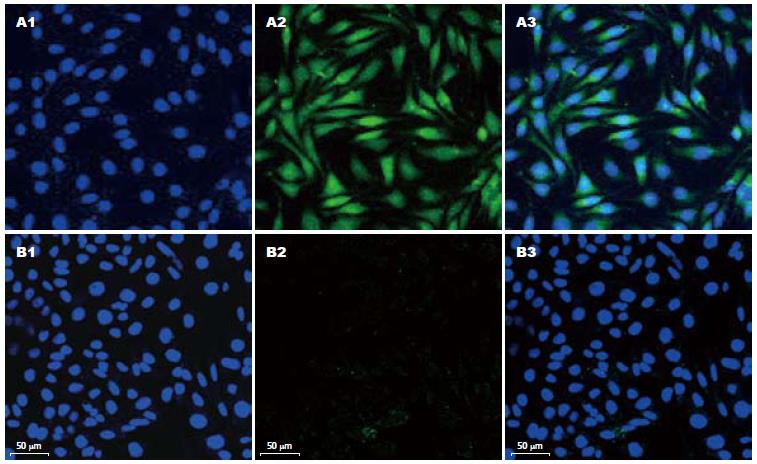
正常情况下, SMMC-7721细胞生长迅速, 保持为上皮样多角形态且体积较小. 以加入TGF-β1所培养的细胞形态为阳性对照, 我们观察到在低氧条件下细胞逐渐由原来的多角形变成类似于成纤维样的长梭形, 排列松散, 提示细胞间黏附减弱(图1, 2).
低氧培养后, Western blot显示E-cadherin的表达明显下降, 正常对照组相对灰度比值为2.03±0.43, 阳性对照组为0.55±0.17, 低氧培养组为0.41±0.23, 其与正常对照组相比差异显著(P<0.01, 图3, 4). 免疫荧光显示对照组细胞膜E-cadherin强表达呈耀眼的绿色荧光, 低氧培养后表达明显减弱(图5).
SMMC-7721经Hoechst 33342及PI双标记后经流式细胞仪分析, SP细胞位于左下角两种荧光均阴性或很弱的区域, 正常对照组SP细胞含量为4.3%, 经低氧培养后, SP细胞含量明显下降至0.0%(图6).
生长迅速的实体肿瘤组织内常存在缺氧微环境. 肿瘤缺氧往往由多种因素所致. 由于肿瘤细胞的指数性增殖与肿瘤血供密切相关, 如果没有血管的形成, 肿瘤细胞的生长将受限; 而组织中氧的有效弥散距离仅为1-2 mm, 因此当肿瘤生长到一定阶段, 氧的需求超过血液供给, 或肿瘤内未成熟血管因间质压力而塌陷时, 局部微环境就处于缺氧状态. 同时, 肿瘤局部淋巴循环不足导致的组织间压力增高, 以及新生血管不成熟导致的血流短路, 将使缺氧更加严重[6]. 研究发现, 缺氧是肿瘤发生恶性转化甚至转移的启动因子, 也是实体瘤对放化疗耐受性增加的原因之一[7,8].
EMT是指上皮细胞在特定的生理和病理情况下向间质细胞转化的现象. 正常上皮细胞富于细胞间黏附从而形成稳定的细胞间接触. EMT时上皮组织基本结构消失, 失去细胞极性和紧密连接, 细胞内骨架成分重排并获得移行能力等间质细胞的特性. EMT与胚胎发育过程和特定类型的伤口愈合中细胞及组织的重塑有关[9]. 肝癌组织的中央细胞往往是上皮表型, 当经历EMT后肿瘤细胞摆脱细胞之间的连接, 从而获得突破基底膜、侵袭周围组织的能力[10,11]. E-cadherin是上皮组织中的一种依赖Ca2+的细胞间跨膜粘连糖蛋白分子, 主要参与细胞间的连接. E-cadherin同时也是EMT的关键分子标志之一[12]. 本研究结果显示, 低氧培养后SMMC-7721细胞的形态发生改变. 免疫印迹提示其蛋白表达明显下调, 免疫荧光提示定位于胞浆的表达阳性细胞明显减少. 这些都说明低氧能够诱导肿瘤细胞发生EMT, 从而在肝癌转移过程中起到重要的作用.
1996年, Goodell等采用流式细胞术研究造血干细胞在体内的增殖情况时发现有一小群细胞呈彗星状分布在细胞主群的一侧, 他们将这群细胞称为SP细胞[13]. SP细胞特异性的将荧光染料Hoechst 33342排出到胞外, 从而具有Hoechst 33342拒染或淡染性, 这是流式细胞仪进行检测分选的基本原理[14]. 最初的研究表明: 来源于骨髓的SP细胞具有很强的造血干细胞活性, 能重建致死放射量照射小鼠的髓系和淋巴系血细胞; 随后人们相继在多种正常组织(骨髓、骨骼肌、肺、肝、心脏、睾丸、肾、皮肤、脑和乳腺等)、肿瘤组织和细胞系中分离出功能类似的SP细胞[15-17]. 由于SP细胞符合肿瘤干细胞学说的特点, 因此他被视为肿瘤干细胞的标志, 随即成为新的研究热点[18].
既然肿瘤干细胞和缺氧都与肿瘤的发生及转移有关, 那么两者之间的关系如何呢? 研究发现, 缺氧可以通过诱导基因组不稳定、抑制细胞凋亡来促进肿瘤干细胞的发生[19], 异常的低氧状态可能导致干细胞失去正常调控而发生恶性转化[20]; 肿瘤干细胞自我更新的信号传导通路如Notch、Wnt、c-Myc等多是缺氧诱导因子在转录水平上的调节靶点; 缺氧通过EMT及其他因素可能促进了肿瘤干细胞的转移[21]. 上述现象表明, 缺氧和肿瘤干细胞的关系复杂, 缺氧对于肿瘤干细胞的调控机制仍有待进一步阐明.
对于肝癌细胞来说, 缺氧和干细胞关系又如何呢? 既往我们已经成功地建立了肝癌细胞中SP细胞分离纯化体系. 现我们选择SP细胞为代表, 以低氧诱导肝癌细胞发生EMT为切入点, 对两者的关系进行研究. 本研究进一步发现, 低氧诱导SMMC-7721细胞发生EMT后, SP细胞比例从未诱导前的4.3%降低到诱导后的0.0%. 分析其可能的机制, 我们推测低氧状态下EMT状态的诱导和维持在一定程度上抑制了肿瘤干细胞的增殖, 促进了肿瘤细胞向侵袭和转移方向发展.
总之, 本研究初步探讨了缺氧时肝癌细胞EMT和SP细胞之间的关系, 为将来研究肿瘤干细胞在肝癌发生中的作用和调控机制, 乃至成为新的治疗靶点提供了理论依据.
肿瘤干细胞学说认为, 肿瘤细胞在成瘤性方面具有不均一性, 只有极少数肿瘤干细胞具有自我更新和分化的潜能, 这是肿瘤增殖、抗药和复发的根源. 肿瘤干细胞的比例与肿瘤的恶性程度成正相关. 上皮间质转化是具有极性的上皮细胞转换成为具有移行功能的间质细胞并获得侵袭和迁移能力的过程. 发生间质转化的上皮细胞与肿瘤的侵袭转移密切相关.
姚鹏, 副教授, 中国人民解放军北京军区总医院全军肝病中心; 王钦红, 副教授, 美国杜克大学医学院肿瘤生物系
肿瘤干细胞学说和细胞上皮间质转化学说是肿瘤学领域新近研究的重点和热点. SP细胞具有肿瘤干细胞的基本特征, 被视为一种肿瘤干细胞筛选和分离纯化的标志. 缺氧是诱发细胞发生上皮间质转化的机制之一. 肿瘤细胞在失控的增殖状态下往往具有缺氧的特征性微环境. 深入探讨缺氧状态下SP细胞的调控机制将成为此领域研究的重点.
1996年, Goodell等采用流式细胞术研究造血干细胞在体内的增殖情况时发现有一小群细胞呈彗星状分布在细胞主群的一侧, 他们将这群细胞称为SP细胞.
本研究采用缺氧培养诱导肝癌细胞系发生上皮间质转化, 在此基础上初步探讨缺氧对SP细胞含量的影响及其机制, 旨在为将来在组织水平研究肝癌转移、抗药及复发机制提供理论基础. 此研究思路和技术路线国内外报道不多.
已有研究报道缺氧在肝癌的侵袭转移中起着重要的作用. 深入研究缺氧对肝癌细胞系中SP细胞的调控机制, 将有助于从不同的侧面了解肿瘤干细胞在肝癌发生发展中的作用, 从而为后续治疗提供理论基础.
本文选题新颖, 结果可信, 具有较强的实用临床意义.
编辑: 李军亮 电编:何基才
| 1. | Rademakers SE, Span PN, Kaanders JH, Sweep FC, van der Kogel AJ, Bussink J. Molecular aspects of tumour hypoxia. Mol Oncol. 2008;2:41-53. [PubMed] [DOI] |
| 2. | Mueller MT, Hermann PC, Heeschen C. Cancer stem cells as new therapeutic target to prevent tumour progression and metastasis. Front Biosci (Elite Ed). 2010;2:602-613. [PubMed] |
| 3. | Sottoriva A, Verhoeff JJ, Borovski T, McWeeney SK, Naumov L, Medema JP, Sloot PM, Vermeulen L. Cancer stem cell tumor model reveals invasive morphology and increased phenotypical heterogeneity. Cancer Res. 2010;70:46-56. [PubMed] [DOI] |
| 4. | Frank NY, Schatton T, Frank MH. The therapeutic promise of the cancer stem cell concept. J Clin Invest. 2010;120:41-50. [PubMed] [DOI] |
| 5. | Wu C, Wei Q, Utomo V, Nadesan P, Whetstone H, Kandel R, Wunder JS, Alman BA. Side population cells isolated from mesenchymal neoplasms have tumor initiating potential. Cancer Res. 2007;67:8216-8222. [PubMed] [DOI] |
| 6. | Ruan K, Song G, Ouyang G. Role of hypoxia in the hallmarks of human cancer. J Cell Biochem. 2009;107:1053-1062. [PubMed] [DOI] |
| 7. | DeClerck K, Elble RC. The role of hypoxia and acidosis in promoting metastasis and resistance to chemotherapy. Front Biosci. 2010;15:213-225. [PubMed] [DOI] |
| 8. | Rapisarda A, Melillo G. Role of the hypoxic tumor microenvironment in the resistance to anti-angiogenic therapies. Drug Resist Updat. 2009;12:74-80. [PubMed] [DOI] |
| 9. | Klymkowsky MW, Savagner P. Epithelial-mesenchymal transition: a cancer researcher's conceptual friend and foe. Am J Pathol. 2009;174:1588-1593. [PubMed] [DOI] |
| 10. | Yilmaz M, Christofori G. EMT, the cytoskeleton, and cancer cell invasion. Cancer Metastasis Rev. 2009;28:15-33. [PubMed] [DOI] |
| 11. | Iwatsuki M, Mimori K, Yokobori T, Ishi H, Beppu T, Nakamori S, Baba H, Mori M. Epithelial-mesenchymal transition in cancer development and its clinical significance. Cancer Sci. 2010;101:293-299. [PubMed] [DOI] |
| 12. | Gavert N, Ben-Ze'ev A. Epithelial-mesenchymal transition and the invasive potential of tumors. Trends Mol Med. 2008;14:199-209. [PubMed] [DOI] |
| 13. | Chan RK, Garfein E, Gigante PR, Liu P, Agha RA, Mulligan R, Orgill DP. Side population hematopoietic stem cells promote wound healing in diabetic mice. Plast Reconstr Surg. 2007;120:407-411; discussion 412-413. [PubMed] [DOI] |
| 14. | Wang J, Guo LP, Chen LZ, Zeng YX, Lu SH. Identification of cancer stem cell-like side population cells in human nasopharyngeal carcinoma cell line. Cancer Res. 2007;67:3716-3724. [PubMed] [DOI] |
| 15. | Kayo H, Yamazaki H, Nishida H, Dang NH, Morimoto C. Stem cell properties and the side population cells as a target for interferon-alpha in adult T-cell leukemia/lymphoma. Biochem Biophys Res Commun. 2007;364:808-814. [PubMed] [DOI] |
| 16. | Komuro H, Saihara R, Shinya M, Takita J, Kaneko S, Kaneko M, Hayashi Y. Identification of side population cells (stem-like cell population) in pediatric solid tumor cell lines. J Pediatr Surg. 2007;42:2040-2045. [PubMed] [DOI] |
| 17. | Wu C, Alman BA. Side population cells in human cancers. Cancer Lett. 2008;268:1-9. [PubMed] [DOI] |
| 18. | Milas L, Hittelman WN. Cancer stem cells and tumor response to therapy: current problems and future prospects. Semin Radiat Oncol. 2009;19:96-105. [PubMed] [DOI] |
| 19. | Chan N, Koch CJ, Bristow RG. Tumor hypoxia as a modifier of DNA strand break and cross-link repair. Curr Mol Med. 2009;9:401-410. [PubMed] [DOI] |
| 20. | Kim Y, Lin Q, Glazer PM, Yun Z. Hypoxic tumor microenvironment and cancer cell differentiation. Curr Mol Med. 2009;9:425-434. [PubMed] [DOI] |
| 21. | Heddleston JM, Li Z, Lathia JD, Bao S, Hjelmeland AB, Rich JN. Hypoxia inducible factors in cancer stem cells. Br J Cancer. 2010;102:789-795. [PubMed] [DOI] |