修回日期: 2010-07-12
接受日期: 2010-07-21
在线出版日期: 2010-09-08
目的: 研究Spondin2的表达调控及其所涉及的信号通路.
方法: 用含3%葡聚糖硫酸钠饮用水连续喂养C57BL/6小鼠6 d, 诱导急性结肠炎, 然后将小鼠处死, 取其结肠组织提取RNA分析. 通过定量RT-PCR分析Spondin2 mRNA和核因子-kB p65的表达. 应用不同细胞因子和Toll样受体(toll-like receptors, TLRs)配体分别刺激细胞, RT-PCR分析Spondin2 mRNA的表达.
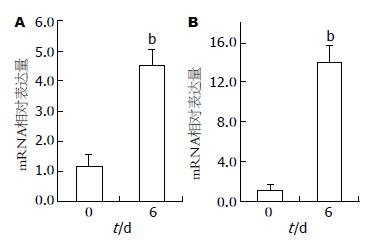
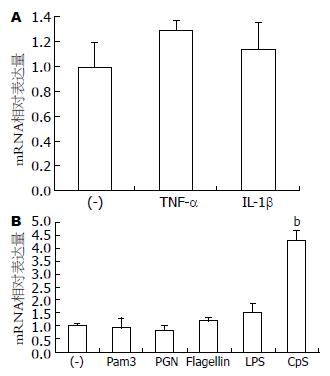
结果: 与对照组比较, 在葡聚糖硫酸钠诱导小鼠结肠炎模型上, Spondin2的mRNA表达上调4.5±0.5倍. TLR-9配体, CpG-ODN刺激野生型RAW264.7细胞后, Spondin2表达上调4.3±0.4倍.
结论: 在结肠炎发生过程中Spondin2的mRNA表达上调, 并可能通过了TLR-9介导的信号通路.
引文著录: 黄庆文, 王琳, 周静平, 廉亚美. Spondin2在结肠炎发生过程中的表达. 世界华人消化杂志 2010; 18(25): 2690-2693
Revised: July 12, 2010
Accepted: July 21, 2010
Published online: September 8, 2010
AIM: To investigate the regulation of Spondin 2 expression during colitis and to analyze potential signaling pathways involved.
METHODS: C57BL/6 mice were treated with 3% dextran sulfate sodium for 6 d to induce acute colitis. The colon tissue specimens were then harvested for RNA isolation. The mRNA expression of Spondin 2 and nuclear factor-kB p65 was analyzed by quantitative RT-PCR. After RAW 264.7, CMT93 and HEK293 cells were stimulated with different cytokines and Toll-like receptor ligands, the mRNA expression of Spondin 2 was analyzed.
RESULTS: The mRNA expression of Spondin 2 was up-regulated by 4.5 ± 0.5 folds in the colon of mice with acute colitis compared with control mice. CpG oligodeoxynucleotide (CpG ODN), a Toll-like receptor 9 (TLR-9) ligand, induced a 4.3 ± 0.4-fold up-regulation of Spondin2 expression in RAW 264.7 cells.
CONCLUSION: Spondin 2 expression is up-regulated during colitis perhaps in a TLR-9-dependent manner.
- Citation: Huang QW, Wang L, Zhou JP, Lian YM. Spondin 2 expression is up-regulated during colitis. Shijie Huaren Xiaohua Zazhi 2010; 18(25): 2690-2693
- URL: https://www.wjgnet.com/1009-3079/full/v18/i25/2690.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i25.2690
Spondin2是分泌性细胞外基质蛋白Mindin-F-spondin家族中的一员[1]. Spondin2最初在斑马鱼中发现, 并且主要积聚在基底层. 后来, 研究者相继克隆出鼠源[2]和人源[3]的Spondin2基因. 小鼠Spondin2 cDNA编码区包含一个330个氨基酸的开放阅读框架, 其相对分子质量为36 000 Da. Spondin2 mRNA在脾脏及淋巴结中丰富表达. 为了研究Spondin2在免疫系统中的作用, Spondin2基因缺陷型小鼠模型已被构建[2]. Spondin2基因缺陷型小鼠能抵抗脂多糖引起的感染性休克, 并且清除细菌感染的能力受损. 巨噬细胞以及肥大细胞表现出对广谱细菌刺激缺陷的反应. Spondin2也通过巨噬细胞吞噬细菌的功能发挥其作用[2]. 流感病毒感染后, Spondin2基因缺陷型小鼠对流感病毒的清除能力受损, 而Spondin2缺陷巨噬细胞的激活则减弱[3]. 因此, 作为模式识别分子, Spondin2在细菌、病毒及病原体感染时, 启动先天性免疫反应起着重要的作用[3,4]. Spondin2能与中性粒细胞中的黏附素相互作用. 在机体受到感染时, Spondin2缺陷型小鼠募集中性粒细胞及巨噬细胞使其向病灶移动的能力严重受损[5]. Spondin2与黏附分子的相互作用也在树突状细胞启动T细胞的过程中发挥着关键作用. Spondin2基因缺陷型小鼠中由于T淋巴细胞聚集能力下降, 其树突状细胞活化CD4+ T细胞的能力受损. 此外, 树突状细胞内Rho鸟苷三磷酸酶Rac1和Rac2的表达水平也发生下调[6]. Spondin2通过黏附素α4β1和α5β1信号通路调节树突状细胞中Rac1和Rac2的表达[7]. 尽管已有多项研究表明Spondin2在先天性和获得性免疫中有着重要作用, 但其调节机制及其激活的信号通路尚未明确. 研究表明, 先天性免疫系统通过模式识别受体(pattern-recognition receptors, PRRs)特异性识别病原相关分子模式(pathogen-associated molecular patterns, PAMPs)[8-10]. 许多细胞表面PRRs, 如Toll样受体(toll-like receptors, TLRs), 在先天性免疫识别中发挥着重要作用. 近十年已发现许多微生物成分均可被TLR所识别[11-15]. 我们的实验数据表明, 在葡聚糖硫酸钠诱导的急性肠炎中Spondin2 mRNA表达水平上调. 此外, 体外共刺激细胞实验结果提示Spondin2可能通过Toll样受体9(toll-like receptor 9, TLR-9)介导的方式而表达上调.
C57BL/6小鼠购自中国上海动物实验中心. 所有涉及小鼠的实验操作均经厦门大学动物研究委员会批准并严格按照厦门大学动物研究委员会指南喂养和使用实验动物(国家卫生出版社, 编号: 86-23, 1985年修订).
1.2.1 诱导急性结肠炎模型: 小鼠饲养在特定的无特异病原体的动物房内, 选取8-12 wk小鼠用3%葡聚糖硫酸钠(MP Biomedicals, Irvine, CA)连续诱导6 d, 然后, 选取距小鼠肛门0.5 cm结肠组织, 进行实验分析. 取一块结肠组织, 提取RNA. 所用实验至少重复3遍.
1.2.2 细胞培养和刺激: RAW 264.7(购自Sigma-Aldrich), CMT93和HEK293细胞(均购于ATCC, USA)培养在含100 mL/L FBS和0.5%青霉素、G/链霉素DMEM培养液中, 置于50 mL/L CO2, 37 ℃温箱内孵育. 将约1×105 RAW 264.7细胞用12孔板培养, 然后, 用10 μg/L鼠重组TNF-α和IL-1β(均购于R&D系统), 0.05 mg/L TLR配体Pam3-CSK4, 5 mg/L肽聚糖(PGN), 0.1 mg/L脂多糖, 0.5 mg/L鞭毛蛋白(S. typhimurium)以及5 mg/L CpG-ODN 1585(配体均购于Invivogen)分别刺激细胞8 h, 然后收集细胞进行RNA抽提.
1.2.3 定量RT-PCR: 用TRIzol reagent (InvitroGen)抽提来获取小鼠结肠组织或用不同细胞因子和TLR配体刺激RAW 264.7细胞RNA. cDNA模板用iScriptTM cDNA synthesis kit合成, 定量PCR则用iQTM SYBR Green PCR Supermix (both from Bio-Rad)合成. 用Bio-Rad iQ5对定量RT-PCR分析, 并且在基因水平, 样本均经GAPDH来标准量化. 2-ΔC(t)方法对基因表达相对均值以及他们表达之间差异进行分析[16]. 接下来寡核苷酸作为Spondin2的引物: 上游引物, 5'-CAATGGGCTGAGGGACTTTG和下游引物, 5'-TCTCTCCTGCAGCTTCGATCTC; 核因子-κB p65上游引物, 5'-AGGCTTCTGGGCCTTATGTG和下游引物, 5'-TGCTTCTCTCGCCAGGAATAC; GAPDH上游引物, 5'-TGGCAAAGTG GAGATTGTTGCC和下游引物, 5'-AAGATGGTGATGGGCTTCCCG.
统计学处理 各项数据以mean±SD来表示, 组间差异用t检验来分析, P<0.05有统计学意义.
用葡聚糖硫酸钠处理后的小鼠结肠炎模型组核因子-κB p65 mRNA表达水平约是对照组的14±1.7倍(图1). 然后应用相同的cDNA样本分析Spondin2的表达. 结果显示, 结肠炎小鼠Spondin2 mRNA表达上调至基线水平的4.5±0.5倍.
应用不同细胞因子以及TLR配体对小鼠髓系单核巨噬细胞系RAW 264.7细胞进行刺激, 结果细胞因子TNF-α和 IL-1β, TLR-2, -6, -5配体Pam3-CSK4, PGN以及鞭毛蛋白均不能诱导Spondin2基因表达的上调; 已知TLR-9配体CpG-ODN能诱导Spondin2 mRNA表达上调4.3±0.4倍(图2).
免疫系统有许多感受器来检测和报告微生物的侵袭. 大多数感受器与免疫细胞相关联, 但是细胞外基质在检测和报告微生物的侵袭方面好像也起着重要作用[1]. 研究者发现Spondin2基因缺陷型小鼠的许多免疫系统反应有着严重的缺陷. 基因缺陷型细胞表现出对病原相关分子模式: 脂磷壁酸, 肽聚糖, 酵母聚糖, 甘露聚糖以及CpG DNA[5]低反应性. 其他研究结果提示Spondin F区介导黏附素的结合, 通过基因诱变识别结合位点. 体内Spondin2-黏附素相互作用在炎症细胞聚集中起着重要作用[10].
这些研究表明Spondin2在先天性免疫和继发性免疫中起着重要作用, 然而Spondin2是如何调节免疫系统的依然不清晰. 同时, 其他细胞因子, 树突状细胞-T细胞相互作用需要进一步研究以及不同器官特异感染模型需要建立. 我们的实验数据表明: 在由葡聚糖硫酸钠诱导急性肠炎, Spondin2 mRNA表达是上调的, 以此认为Spondin2在黏膜免疫中有着不可替代的作用.
在Spondin2基因缺陷细胞激活已知由脂多糖介导的信号通路, 细胞大多不受其影响. 这一结果提示: Spondin2可能结合不同的受体以及激活其他的TLRs或不同的信号转导通路. 但是, 在基因缺陷型巨噬细胞由PAMPs诱导的TNF和 IL-6是下降的提示Spondin2诱导的信号通路与已明确的TLRs信号传导通路同样重要[5,8]. 然而, 由Spondin2介导TLRs微生物成分识别的具体机制仍然不清晰. 我们实验结果提示Spondin2可能通过TLR-9介导的信号通路而表达上调.
虽然, Spondin2与几种细菌和黏附素结合, 但是Spondin2的功能是否通过一些模式识别受体或其他新的受体而发挥其作用, 这些问题需要我们进一步阐明. 我们的实验结果强调了TLR-9介导的信号通路的重要性, 这为明确Spondin2蛋白更加精确的功能以及其介导的信号通路提供了进一步线索.
Spondin2是分泌性细胞外基质蛋白Mindin-F-spondin家族中的一员. Spondin2 mRNA在脾脏及淋巴结中丰富表达. Spondin2在细菌、病毒及病原体感染时, 启动先天性免疫反应起着重要的作用. 尽管已有多项研究表明Spondin2在先天性和获得性免疫中有着重要作用, 但其调节机制及其激活的信号通路尚未明确.
高泽立, 主任医师, 上海交通大学医学院附属第九人民医院周浦分院消化科
研究表明Spondin2在先天性免疫和继发性免疫中起着重要作用, 然而Spondin2是如何调节免疫系统的依然不清晰; 虽然, Spondin2与几种细菌和黏附素结合, 但是Spondin2的功能是否通过一些模式识别受体或其他新的受体而发挥其功能, 这些问题需要进一步阐明.
为了研究Spondin2在免疫系统中的作用, Spondin2基因缺陷型小鼠模型已被构建. Spondin2基因缺陷型小鼠能抵抗脂多糖引起的感染性休克, 并且清除细菌感染的能力受损. 巨噬细胞以及肥大细胞也表现出对广谱细菌刺激缺陷的反应.
本实验结果证实了Spondin2在黏膜免疫中有着不可替代的作用, 并强调了TLR-9介导的信号通路的重要性, 这为明确Spondin2蛋白更加精确的功能以及其介导的信号通路提供了进一步线索.
本文选题紧扣当前肠道多发病研究, 密切联系临床, 选题合理, 实验设计严谨, 方法得当, 统计学应用合理, 参考文献较新, 值得临床医生阅读.
编辑: 曹丽鸥 电编:何基才
| 1. | Patti JM, Allen BL, McGavin MJ, Höök M. MSCRAMM-mediated adherence of microorganisms to host tissues. Annu Rev Microbiol. 1994;48:585-617. [PubMed] [DOI] |
| 2. | He YW, Li H, Zhang J, Hsu CL, Lin E, Zhang N, Guo J, Forbush KA, Bevan MJ. The extracellular matrix protein mindin is a pattern-recognition molecule for microbial pathogens. Nat Immunol. 2004;5:88-97. [PubMed] [DOI] |
| 3. | Jia W, Li H, He YW. Pattern recognition molecule mindin promotes intranasal clearance of influenza viruses. J Immunol. 2008;180:6255-6261. [PubMed] |
| 4. | McDonald C, Nuñez G. Mindin the fort. Nat Immunol. 2004;5:16-18. [PubMed] [DOI] |
| 5. | Jia W, Li H, He YW. The extracellular matrix protein mindin serves as an integrin ligand and is critical for inflammatory cell recruitment. Blood. 2005;106:3854-3859. [PubMed] [DOI] |
| 6. | Benvenuti F, Hugues S, Walmsley M, Ruf S, Fetler L, Popoff M, Tybulewicz VL, Amigorena S. Requirement of Rac1 and Rac2 expression by mature dendritic cells for T cell priming. Science. 2004;305:1150-1153. [PubMed] [DOI] |
| 7. | Li H, Oliver T, Jia W, He YW. Efficient dendritic cell priming of T lymphocytes depends on the extracellular matrix protein mindin. EMBO J. 2006;25:4097-4107. [PubMed] [DOI] |
| 8. | Janeway CA Jr, Medzhitov R. Innate immune recognition. Annu Rev Immunol. 2002;20:197-216. [PubMed] [DOI] |
| 9. | Hoffmann JA, Kafatos FC, Janeway CA, Ezekowitz RA. Phylogenetic perspectives in innate immunity. Science. 1999;284:1313-1318. [PubMed] [DOI] |
| 10. | Bollrath J, Phesse TJ, von Burstin VA, Putoczki T, Bennecke M, Bateman T, Nebelsiek T, Lundgren-May T, Canli O, Schwitalla S. gp130-mediated Stat3 activation in enterocytes regulates cell survival and cell-cycle progression during colitis-associated tumorigenesis. Cancer Cell. 2009;15:91-102. [PubMed] [DOI] |
| 11. | Takeuchi O, Hoshino K, Kawai T, Sanjo H, Takada H, Ogawa T, Takeda K, Akira S. Differential roles of TLR2 and TLR4 in recognition of gram-negative and gram-positive bacterial cell wall components. Immunity. 1999;11:443-451. [PubMed] [DOI] |
| 12. | Hoshino K, Takeuchi O, Kawai T, Sanjo H, Ogawa T, Takeda Y, Takeda K, Akira S. Cutting edge: Toll-like receptor 4 (TLR4)-deficient mice are hyporesponsive to lipopolysaccharide: evidence for TLR4 as the Lps gene product. J Immunol. 1999;162:3749-3752. [PubMed] |
| 13. | Takeuchi O, Kawai T, Sanjo H, Copeland NG, Gilbert DJ, Jenkins NA, Takeda K, Akira S. TLR6: A novel member of an expanding toll-like receptor family. Gene. 1999;231:59-65. [PubMed] |
| 14. | Hemmi H, Takeuchi O, Kawai T, Kaisho T, Sato S, Sanjo H, Matsumoto M, Hoshino K, Wagner H, Takeda K. A Toll-like receptor recognizes bacterial DNA. Nature. 2000;408:740-745. [PubMed] [DOI] |
| 15. | Tai LH, Goulet ML, Belanger S, Toyama-Sorimachi N, Fodil-Cornu N, Vidal SM, Troke AD, McVicar DW, Makrigiannis AP. Positive regulation of plasmacytoid dendritic cell function via Ly49Q recognition of class I MHC. J Exp Med. 2008;205:3187-3199. [PubMed] [DOI] |
| 16. | Guleng B, Tateishi K, Ohta M, Kanai F, Jazag A, Ijichi H, Tanaka Y, Washida M, Morikane K, Fukushima Y. Blockade of the stromal cell-derived factor-1/CXCR4 axis attenuates in vivo tumor growth by inhibiting angiogenesis in a vascular endothelial growth factor-independent manner. Cancer Res. 2005;65:5864-5871. [PubMed] [DOI] |