修回日期: 2010-07-05
接受日期: 2010-07-12
在线出版日期: 2010-08-28
目的: 探讨应激下胃肠肽-八肽胆囊收缩素(CCK-8S)、生长抑素(SS)的变化, 以及二者在应激所致胆汁反流中的相互作用和相关机制.
方法: (1)放射免疫方法检测血浆CCK-8S和SS水平, 并与正常对照组进行比较; (2)多导生理记录仪记录胃窦离体肌条在不同条件下的收缩活动; (3)免疫印迹法和免疫沉淀法检测胃窦平滑肌细胞(SMC)三型1, 4, 5-三磷酸肌醇受体(InsP3R3)磷酸化水平; (4)Fura-3/AM标记胃窦SMC, 观察硫化CCK-8S和SS对胞内钙离子浓度([Ca2+]i)的影响; (5)全细胞膜片钳检测胃窦SMC的L-型电压门控钙通道电流(ICa-L)的变化情况.
结果: (1)应激各时段血浆CCK-8S浓度和胃内胆汁反流水平明显增强(均P<0.01), 以应激结束后1-2 h最为显著, 而血浆SS浓度则呈下降趋势(均P<0.05); (2)CCK-8S作用下胃窦和幽门纵行及环形肌条收缩幅值、频率改变明显(均P<0.01), SS作用相反且能阻断CCK的增强效应; (3)CCK-8S显著增强胃窦平滑肌细胞[Ca2+]i荧光强度和ICa-L(均P<0.01), SS作用相反且能阻断CCK的增强效应; (4)SS作用下CCK-8S上调的InsP3R3磷酸化水平可被显著增强.
结论: 应激下胆汁反流及其介导的损伤效应与CCK和SS变化介导的胃动力紊乱密切相关. CCK-8S通过增强胞内钙释放和促进外钙内流增强胃窦收缩, 该效应可被SS所阻断, 二者在应激所致的胃动力紊乱中起到重要作用.
引文著录: 司新敏, 黄磊, 施瑞华, 罗和生. 生长抑素对应激下胆囊收缩素介导的胆汁反流的抑制作用. 世界华人消化杂志 2010; 18(24): 2521-2527
Revised: July 5, 2010
Accepted: July 12, 2010
Published online: August 28, 2010
AIM: To investigate the ionic and molecular mechanisms underlying the effects of changes in plasma cholecystokinin octapeptide (CCK-8S) and somatostatin (SS) on stress-induced bile regurgitation in rats.
METHODS: The changes in plasma CCK-8S, SS and intragastric bile concentration under stressful condition were measured by radioimmunoassay (RIA). The contractile response of gastric antral smooth strips isolated from healthy adult rats was recorded by poly physiography. The regulatory effect of protein kinase C (PKC) on the phosphorylation of type 3 inositol 1, 4, 5-triphosphate receptor (InsP3R3) in gastric smooth muscle cells (SMC) was determined by immunoprecipitation. The changes in intracellular calcium fluorescence intensity (FI) of SMC (presented as [Ca2+]i) were analyzed by laser scanning confocal microscopy. L-type voltage-dependent calcium currents (ICa-L) of SMC were recorded by the patch-clamp technique.
RESULTS: Both plasma CCK-8S level and gastric bile concentration significantly increased during the stress period and reached the peak at 2 h after stress, while reverse effect was observed in plasma SS level. Respective addition of CCK-8S and SS caused a rapid, sustained, concentration-dependent increase and decrease in muscle contraction of gastric antral strips, and CCK-8S-induced increase in the contractile response could be significantly blocked by administration of nifedipine or SS. Similar results were obtained for the changes in FI and ICa-L of SMC. Pretreatment with SS significantly increased CCK-8S-promoted phosphorylation of InsP3R3 in SMC.
CONCLUSION: Gastric mucosal damage induced by bile regurgitation under stressful condition is closely associated with gastric antral dysmotility evoked by the changes in CCK-8S and SS. CCK-8S-enhanced gastric antral contraction depends on the release of intracellular calcium stores and the influx of extracellular calcium via L-type voltage-dependent calcium channels, and can be blocked with SS, suggesting that both CCK-8S and SS play important roles in the regulation of gastric motility.
- Citation: Si XM, Huang L, Shi RH, Luo HS. Inhibitory effects of somatostatin on cholecystokinin octapeptide-mediated bile regurgitation under stress: ionic and molecular mechanisms. Shijie Huaren Xiaohua Zazhi 2010; 18(24): 2521-2527
- URL: https://www.wjgnet.com/1009-3079/full/v18/i24/2521.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i24.2521
应激性溃疡(stress ulcer, SU)是临床危重疾病的常见而严重的并发症, 具有较高的发病率和死亡率, 防治效果不佳且发病机制尚未完全清楚[1]. 近来研究认为, 各种应激可引起体内多种脑-肠肽含量及其功能的变化, 经中枢和局部神经系统影响胃肠道的功能状态[2]. 目前胃酸过多, 黏膜缺血, 黏膜屏障功能破坏被认为是SU产生的重要因素, 而对于胆汁反流在SU形成中的作用及其与相关脑-肠肽间的作用报道甚少. 胆囊收缩素(cholecystokinin, CCK)和生长抑素(somatostatin, SS)是两种广泛分布于胃肠道及中枢神经系统中, 具有神经递质和胃肠激素双重作用的脑肠肽, 他通过与其自身受体相结合, 刺激内外分泌、胃肠运动等起着重要的调节作用[3,4]. 本研究利用浸冷水束缚法建立大鼠SU模型, 检测应激大鼠血浆中胆囊收缩素八肽(cholecystokinin octapeptide, CCK-8S)和SS变化, 探讨二者的变化与应激时胆汁反流的可能联系, 以及二者之间的相互作用和具体的分子生物学机制, 从而为临床防治和治疗SU探索新的方法.
健康成年清洁级SD大鼠40只, 体质量250-300 g, 雌雄不拘, 随机分为: (1)正常对照组10只, 不做任何处理; (2)应激组30只, 分别于应激过程中2 h, 应激结束后0、1、2、4和6 h进行观察. 应激组大鼠禁食不禁水24 h后, 固定四肢于鼠板上, 浸于5 ℃±0.5 ℃水槽中, 水面浸至剑突水平, 持续4 h以制成SU模型[5]. 对照组不作任何处理. 心脏采血放射免疫法检测大鼠血浆中CCK-8S和SS水平, 抽胃液放射免疫法检测胃液胆汁酸浓度.
1.2.1 离体肌条和单个平滑肌细胞制备: 健康成年清洁级SD大鼠, 体质量250-300 g, 猛击大鼠头部致昏, 断颈放血, 迅速取胃, 沿胃大弯剪开并在Krebs液中漂洗干净后去除胃窦部黏膜. 沿肌纤维方向分别切取宽3 mm, 长8 mm的胃窦和幽门纵行及环形肌条. 制备单个平滑肌细胞(smooth muscle cell, SMC)时, 将肌条剪成2 mm×4 mm小块置于消化酶中, 36.0 ℃-36.5 ℃下轻微振荡孵育25-30 min, 无钙PSS缓冲液洗5次, 广口火抛光的吸管吹打组织块, 产生细胞悬液. 所有肌条和细胞备用时均保存于2 ℃-8 ℃的KBS液中.
1.2.2 离体肌条实验: 肌条放置于垂直灌流槽, 一端固定在铂丝钩上, 另一端与张力换能器相连, 测量肌肉收缩力量. 台氏液(3 mL/min)持续灌流肌条, 37 ℃±0.5 ℃下持续充以O2(950 mL/L)和CO2(50 mL/L)的混合气体. 将肌条处于自然长度(不过度牵拉或松弛), 孵育60 min, 当稳定的自发性收缩出现后通过八导生理记录仪记录给药前后肌条收缩活动幅值和频率的变化.
1.2.3 免疫沉淀, 凝胶电泳和免疫印迹: 取1 mL经过处理的SMC悬液加入500 mL裂解液, 冰上放置40 min后, 4 ℃下12 000 r/min离心5 min, 取上清测定蛋白总量. 加入特异性的1, 4, 5-三磷酸肌醇受体(inositol 1, 4, 5- triphosphate receptor, InsP3R)单抗(1:100)4 ℃下孵育2 h后, 再加入protein A beads, 4 ℃轻微摇动1 h, 4 ℃下2 000 r/min离心1 min弃上清. 对照组样本不加抗体进行相同处理. 缓冲液洗涤沉淀5次后加入上样缓冲液, 100 ℃变性5 min. 上清经12% SDS-PAGE分离后转移到预先用phospho-(Ser/Thr)substrate抗体(1:1 000)孵育过的硝酸纤维素膜上, 以特异性检测包含在PKC酶解底物序列中的磷酸化的Ser/Thr残基. 免疫沉淀经12% SDS-PAGE分离后, 电转移至硝酸纤维素膜, 与InsP3R3单抗(1:1 000)4 ℃下孵育过夜, 检测InsP3R3总量. 显色后置于X光胶片上曝光后显影.
1.2.4 Fura-3/AM负载细胞: 细胞悬液中加入Fura-3/AM(终浓度为10 mmol/L), 37 ℃温育30 min后PSS液洗2次, 调细胞悬液为5×109/L. 激发光波长为334 nm及380 nm, 发射光波长为540 nm, 采样间隙为3 ms, 记录SMC在给药前后的荧光强度变化.
1.2.5 细胞膜片钳实验: 选取边缘齐整、横纹清晰的SMC于室温(23 ℃-25 ℃)下进行实验. 取SMC悬液1 mL加入细胞池中并平放于倒置显微镜上, 贴壁5 min后台氏液灌流(1 mL/min). 拉制电极使其阻抗为3-4 MW, 进行高阻封接后负压穿孔形成全细胞模式. 细胞膜片钳实验分两组进行, 一组为对照组, 用PSS灌流; 另一组为实验组, 将药物加入PSS灌流. 全细胞模式下采用EPC-10-HEAKA膜片钳放大器记录L-型电压门控钙通道电流(L-type voltage-dependent calcium currents, ICa-L). 运行pCLAMP软件用于收集资料, 并用Clampfit8.0程序分析数据.
统计学处理 采用配对t检验, 实验结果以mean±SD表示, n表示细胞或肌条例数. 肌条实验结果进行归一化处理, 即除以对照组中最大值所得的相对值, 然后用mean±SE表示. 膜片钳实验采用膜片钳数据软件Clampfit8.0和统计软件SPSS13.0进行配对t检验, 并在GraphPad Instate 3.0制图. 所有统计结果P<0.05均认为有统计学意义.
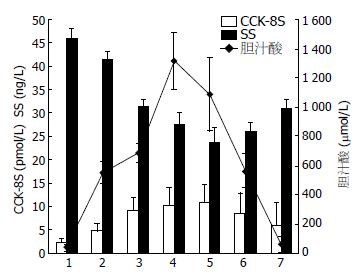
应激后各时段组血浆CCK-8S和胃液胆汁酸浓度较对照组显著升高(均P<0.05或0.01), 二者在应激结束后1-2 h均到达最高峰, 然后逐渐下降, 但在应激结束后6 h仍高于正常对照(P<0.05); SS应激后显著下降, 在应激结束后2 h达到最小值, 之后开始上升但仍低于正常对照(均P<0.05或0.01, 表1, 图1).
| 分组 | CCK-8S(pmol/L) | SS(ng/L) | 胆汁酸(µmol/L) |
| 正常对照组 | 2.23±0.88 | 45.83±2.11 | 37.93±23.76 |
| 应激过程中2 h | 4.91±1.44 | 41.59±1.58a | 552.28±75.69a |
| 应激结束后0 h | 9.05±2.93b | 31.29 ±1.53a | 690. 70±64.69b |
| 应激结束后1 h | 10.05±3.89b | 27.52 ±2.53b | 1 316.00±197.36d |
| 应激结束后2 h | 10.80±3.82b | 23.06±3.11b | 1 087.30±252.75d |
| 应激结束后4 h | 8.61±4.17b | 26.20±1.82a | 563.22±117.97b |
| 应激结束后6 h | 5.87±4.95a | 31.87±1.97a | 62.68±55.13a |
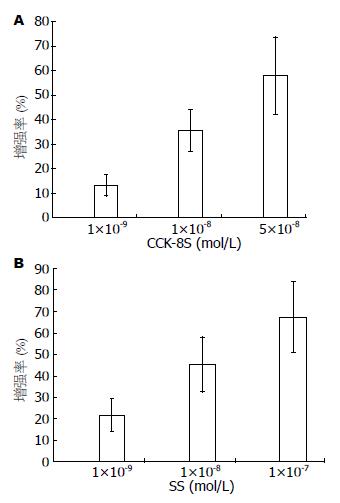
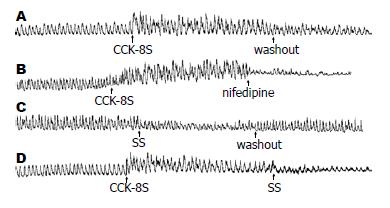
分别给予不同浓度CCK-8S(1×10-9, 1×10-8, 5×10-8 mol/L)和SS(1×10-9, 1×10-8, 1×10-7 mol/L)可呈浓度依赖性增强和抑制胃窦肌条的收缩效应(P<0.05, 图2). 分别给予L-型钙通道阻滞剂nifedipine(1×10-5 mol/L)和SS(1×10-7 mol/L), 可降低CCK-8S(5×10-8 mol/L)作用下胃窦环行和纵行肌条的振幅和收缩频率(图3).
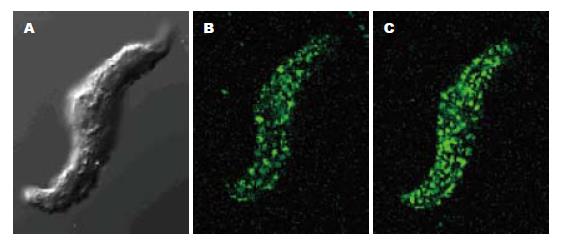
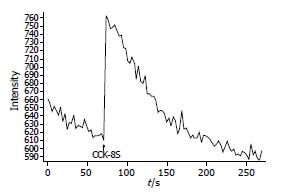
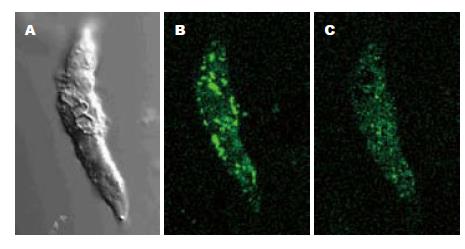
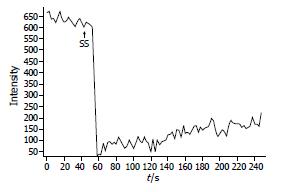
大鼠胃窦平滑肌细胞[Ca2+]i荧光基础值为651.3±107.4(n = 20). 给予CCK-8S(5×10-8 mol/L)后, [Ca2+]i荧光显著增强(651.3±107.4 vs 764.5±85.7, 图4, 5); 给予SS (1×10-7 mol/L)后, [Ca2+]i荧光显著减弱(651.3±107.4 vs 514.5±54.9, P<0.05, 图6, 7).
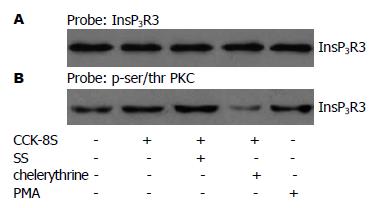
样本预先给予和不给予PKC特异性抑制剂切勒斯埃(chelerythrine, 5×10-8 mmol/L)后分别加入CCK-8S(5×10-8 mmol/L); PKC激动剂豆蔻酰佛波醇乙酯(phorbol-12-myristate-13-acetate, PMA, 10-5 mmol/L)处理的样本作为阳性对照. 所有样本均反应5 min. CCK-8S作用的样本中, InsP3R3的磷酸化水平高于正常对照组(图8), SS(1×10-7 mmol/L)显著增强CCK-8S介导的InsP3R3磷酸化, 而chelerythrine抑制PKC活性可阻断CCK-8S增强InsP3R3磷酸化的效应. 在PKC阳性对照组中, 给予PMA可介导InsP3R3磷酸化的发生.
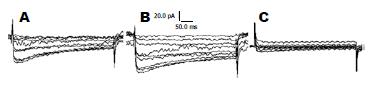
采用电压阶跃刺激模式记录时钳制电压为-40 mV, 以10 mV的阶跃从-40 mV开始去极化至40 mV, 维持400 ms, 刺激时隔10 ms. 内向电流峰值在刺激后5-13 ms时出现, I-V曲线中10 mV时ICa-L最大, 硝苯吡啶(nifedipine, 1×10-5 mol/L)可抑制电压为10 mV的ICa-L约80%(n = 3), 证明该电流是ICa-L. 与正常对照相比, CCK-8S(5×10-8 mol/L)作用下SMC的ICa-L明显增强(-56.42 pA±6.57 pA vs -88.54 pA±5.71 pA, n = 10, P<0.01), 可被nifedipine(1×10-5 mol/L)显著抑制(图9). SS(1×10-7 mol/L)可显著抑制ICa-L(抑制率为87.51%±10.64%, n = 10, 图10). 此外, SS(1×10-7 mol/L)可阻断CCK-8S(5×10-8 mol/L)介导作用下SMC的ICa-L的增强效应(图11).
胃肠道的各种功能由神经系统和各种胃肠肽类激素调节, 其中CCK和SS是众多胃肠肽中重要的两种[6,7]. CCK-8S和SS在应激时胆汁反流中的作用不容忽视. 一方面CCK结合相关CCK受体周期性松弛Oddi括约肌、促进胆囊收缩和胆汁分泌; 另一方面具有相反生理作用的SS不仅可抑制CCK的分泌还可平行拮抗CCK的作用, 直接抑制Oddi括约肌收缩而减少胆酸依赖性胆汁分泌的减少, 对胆囊也可产生完全和持久的抑制作用[8]. 在本研究中, 我们拟在前期研究基础上, 探讨应激所致CCK和SS变化在大鼠胃窦动力紊乱时胆汁反流的作用和相关机制.
胆汁酸对胃黏膜上皮细胞有时间及浓度依赖性细胞毒性作用. 反流频率越高, 持续时间越长, 反流量越大, 引起的胃黏膜损伤越重[9]. 结果显示, 应激开始后大鼠血浆CCK-8S和胃液胆汁酸浓度即明显增强, 二者在应激结束后1-2 h均达最大值, 随后开始下降但仍高于正常对照. 这与应激中胆汁反流造成的胃黏膜损伤的严重程度一致. 与CCK-8S和胆汁酸相反, 应激开始后血浆SS开始下降, 且在CCK-8S和胆汁酸水平达峰值时SS水平降至最低, 后缓慢上升. 由此可见, 应激过程中CCK分泌增加和SS分泌减少与应激中胆汁反流严重程度密切相关.
胃肠道协调运动反映在3个方面: 胃窦-幽门、胃窦-十二指肠、胃-胆囊-Oddi氏括约肌间, 应激下胆汁反流的发生是这3种协调运动紊乱的结果[10]. 本研究结果显示CCK-8S可呈浓度依赖性的增强大鼠胃窦平滑肌肌条收缩, 而SS作用相反, CCK-8S的增强作用可被SS所抑制. 众所周知胞内钙浓度([Ca2+]i)升高是调节多种细胞生理过程的重要因素. 胞内钙库释放和/或外钙通过胞膜进入胞内是导致[Ca2+]i升高的基础[11]. 为进一步探明SS对CCK-8S增强胃窦肌条收缩抑制作用的机制, 我们检测二者对大鼠胃窦SMC[Ca2+]i的影响. 结果显示, CCK-8S可显著增强[Ca2+]i水平而SS作用相反, 显著降低[Ca2+]i. 胃窦-十二指肠压力梯度改变也将进一步增强应激时胆汁反流入胃. 应激时胃-十二指肠的协调运动被打破, 十二指肠逆蠕动显著增强, 胃窦-十二指肠间正常的压力梯度随之发生变化[12]. Castedal等[13]近来证实十二指肠胃反流的发生与十二指肠逆蠕动的增强密切相关. 应激时可导致十二指肠运动紊乱逆蠕动显著增强, 此时胃窦环形平滑肌在频率不变的情况下收缩振幅被显著增强(在前期实验中已经得到证实)[14], CCK升高和SS降低从而增强胃窦平滑肌收缩, 导致引起的十二指肠-胃窦压力梯度增加, 在胃窦幽门平滑肌舒张间期大量的胆汁更易反流入胃.
细胞质中钙离子浓度是胃肠平滑肌活动的决定性因素, 而InsP3R是动员胞内钙库的重要因素[14]. 研究显示CCK可介导胞内三磷酸肌醇(InsP3)与内质网上InsP3R结合, 刺激胞内钙释放引起[Ca2+]i升高引发细胞收缩、神经传递等生理性反应. PKC通过磷酸化InsP3R中不同位点上的丝/苏氨酸, 磷酸化后的InsP3R显著降低了对InsP3的敏感性, 从而抑制InsP3敏感的内质网钙库钙释放, 他是调节胞内钙信号的一种重要的丝氨酸-苏氨酸激酶[15,16]. 在本实验中, 免疫沉淀结果显示分别给予PKC激动剂PMA和CCK-8S, CCK的增强作用可被PKC抑制剂chelerythrine所抑制. 此外, 给予SS则可显著增强CCK-8S介导的胃窦SMC InsP3R磷酸化, 提示一方面PKC参与CCK介导的胃窦SMC InsP3R磷酸化调节, 另一方面SS通过增强CCK介导的InsP3R磷酸化, 抑制胞内钙释放. 由于在本实验中, 应激过程中SS水平显著下降, 故SS对CCK介导的InsP3R磷酸化抑制效应降低, 促进了CCK介导的胞内钙释放, 从而加重应激过程中胃窦动力紊乱的发生. 此外, 我们在记录胃窦SMC ICa-L时发现, SS对CCK介导的ICa-L增强效应具有明显的抑制作用. 然而在应激状态下, SS水平的显著下降削弱了对CCK的抑制效应, 促进了细胞外钙离子通过L-型钙通道进入胞内, 加重胞内钙离子紊乱导致胃窦动力紊乱的发生.
总之, 通过本实验我们得出; (1)应激状态下胆汁反流的确存在且在SU发生中起到重要作用; (2)应激所致体内CCK和SS变化在胃动力紊乱中起到重要作用, 并促进胆汁反流的发生; (3)SS可通过影响CCK-8S介导的SMC胞内钙升高, 加重应激下胃动力紊乱.
近来研究认为, 各种应激可引起体内多种脑-肠肽含量及其功能的变化, 经中枢和局部神经系统影响胃肠道的功能状态. 目前胃酸过多, 黏膜缺血, 黏膜屏障功能破坏被认为是应激性溃疡(SU)产生的重要因素, 而对于胆汁反流在SU形成中的作用及其与相关脑-肠肽间的作用报道甚少.
周南进, 研究员, 江西省医学科学研究所
应激性溃疡(SU)是临床危重疾病的常见而严重的并发症, 具有较高的发病率和死亡率, 防治效果不佳且发病机制尚未完全清楚.
Castedal等近来证实十二指肠胃反流的发生与十二指肠逆蠕动的增强密切相关.
本研究利用浸冷水束缚法建立大鼠SU模型, 检测应激大鼠血浆中胆囊收缩素八肽(CCK-8S)和SS变化, 探讨二者的变化与应激时胆汁反流的可能联系, 以及二者之间的相互作用和具体的分子生物学机制.
应激所致体内CCK和SS变化在胃动力紊乱中起到重要作用, 并促进胆汁反流的发生; SS可通过影响CCK-8S介导的SMC胞内钙升高, 加重应激下胃动力紊乱.
本文设计合理, 数据可靠, 对预防应激所致的胃动力紊乱有一定借鉴价值.
编辑: 李军亮 电编:何基才
| 1. | Spirt MJ. Stress-related mucosal disease: risk factors and prophylactic therapy. Clin Ther. 2004;26:197-213. [PubMed] [DOI] |
| 2. | 李 勋, 余 安国, 邓 镇平, 刘 有生, 李 永炬, 杨 承华, 林 景泰, 胡 以则. 大鼠应激性溃疡发病机理及防治研究. 中国普外 基础与临床杂志. 2000;7:138-140. |
| 3. | 邹 百仓, 魏 睦新. 胆囊收缩素与消化道运动. 国外医学·消化疾病分册. 2002;22:112-115. |
| 5. | Dai Y, Liu JX, Li JX, Xu YF. Effect of pinaverium bromide on stress-induced colonic smooth muscle contractility disorder in rats. World J Gastroenterol. 2003;9:557-561. [PubMed] |
| 8. | van der Schaar PJ, Bremer Y, Lamers CB, Masclee AA. Role of cholecystokinin in relaxation of the proximal stomach. Scand J Gastroenterol. 2001;36:361-366. [PubMed] [DOI] |
| 10. | 周 吕, 柯 美云. 神经胃肠病学与动力(基础与临床). 第1版. 北京: 科学出版社 2005; 10-11. |
| 11. | Muinuddin A, Neshatian L, Gaisano HY, Diamant NE. Calcium source diversity in feline lower esophageal sphincter circular and sling muscle. Am J Physiol Gastrointest Liver Physiol. 2004;286:G271-G277. [PubMed] [DOI] |
| 12. | Straathof JW, Mearadji B, Lamers CB, Masclee AA. Effect of CCK on proximal gastric motor function in humans. Am J Physiol. 1998;274:G939-G944. [PubMed] |
| 13. | Castedal M, Björnsson E, Gretarsdottir J, Fjälling M, Abrahamsson H. Scintigraphic assessment of interdigestive duodenogastric reflux in humans: distinguishing between duodenal and biliary reflux material. Scand J Gastroenterol. 2000;35:590-598. [PubMed] [DOI] |
| 14. | Si XM, Huang L, Lv P, Xia H, Luo HS. Effects of cholecystokinin-8 induced gastric dysmotility on bile regurgitation during stress and molecular mechanisms. Regul Pept. 2006;136:64-71. [PubMed] [DOI] |
| 15. | Li B, Wu Q, Shi JS, Sun AS, Huang XN. Effects of protopine on intracellular calcium and the PKC activity of rat aorta smooth muscle. Shengli Xuebao. 2005;57:240-246. [PubMed] |
| 16. | Bai M, Trivedi S, Lane CR, Yang Y, Quinn SJ, Brown EM. Protein kinase C phosphorylation of threonine at position 888 in Ca2+o-sensing receptor (CaR) inhibits coupling to Ca2+ store release. J Biol Chem. 1998;273:21267-21275. [PubMed] [DOI] |