修回日期: 2010-06-29
接受日期: 2010-07-12
在线出版日期: 2010-08-18
目的: 探讨黄芪汤逆转二甲基亚硝胺(dimethylnitrosamine, DMN)诱导的大鼠肝纤维化的作用机制.
方法: 采用DMN诱导大鼠肝纤维化, 造模4 wk, 随机分为正常组, 2 wk模型组, 4 wk模型组. 造模结束后, 将模型组随机分为模型对照组, 黄芪汤组. 黄芪汤组于第5周起灌胃, 模型对照组以同体积生理盐水灌胃. 2 wk、4 wk、6 wk末分别收集大鼠肝组织, 免疫印迹法检测Fas、caspase-8、caspase-3、MMP-9、TIMP-1、TIMP-2蛋白表达; 实时定量PCR法检测α-SMA mRNA表达; 明胶酶图法检测肝组织MMP-2和MMP-9的活性.
结果: 与正常组相比, 模型组Fas、caspase-8、caspase-3、MMP-9、TIMP-1、TIMP-2蛋白表达量、α-SMA mRNA表达量、MMP-2活性和MMP-9活性均于造模后逐渐升高, 4 wk时达到高峰. 与6 wk模型对照组相比, 黄芪汤组Fas、caspase-8、caspase-3、TIMP-1、TIMP-2蛋白表达量, α-SMA mRNA表达量、MMP-2活性明显降低(1.05±0.02 vs 1.17±0.04, 1.41±0.04 vs 1.98±0.06, 0.86±0.01 vs 1.19±0.04, 1.03±0.03 vs 1.58±0.06, 1.16±0.04 vs 1.53±0.01, 3.12±0.47 vs 8.48±0.45, 2.15±0.03 vs 2.33±0.05, 均P<0.05或0.01). MMP-9蛋白表达及活性均显著升高(1.21±0.00 vs 1.12±0.01, 1.25±0.07 vs 1.10±0.04, 均P<0.05或0.01).
结论: 黄芪汤显示了良好的抗肝纤维化作用, 作用机制与其抑制肝细胞凋亡, 抑制HSC活化, 调控MMPs/TIMPs系统, 促进ECM降解有关.
引文著录: 闫晓风, 刘平, 孙明瑜, 王晓玲. 黄芪汤对二甲基亚硝胺诱导大鼠肝纤维化模型作用的机制. 世界华人消化杂志 2010; 18(23): 2410-2415
Revised: June 29, 2010
Accepted: July 12, 2010
Published online: August 18, 2010
AIM: To investigate the mechanisms underlying the therapeutic effect of Huangqi Decoction against dimethylnitrosamine (DMN)-induced liver fibrosis in rats.
METHODS: Liver fibrosis was induced in rats by intraperitoneal injection of DMN for 4 wk. Rats were randomly divided into two groups: normal group and model group. Fibrotic rats in the model group were further randomly divided into two subgroups: model control subgroup and Huangqi Decoction subgroup. The Huangqi Decoction subgroup was intragastrically administered Huangqi Decoction for 2 wk, while the model control subgroup was administered equal volume of saline. At the end of 2, 4 and 6 wk, hepatic tissue samples were collected to detect the protein expression of Fas, caspase-8, caspase-3, matrix metallopeptidase-9 (MMP-9), tissue inhibitor of metalloproteinase 1 (TIMP-1) and TIMP-2 by Western blot, mRNA expression of α-SMA by real time-PCR, and MMP-2 and MMP-9 activity by gelatin enzymography.
RESULTS: Compared with the normal group, the expression levels of Fas, caspase-8, caspase-3, TIMP-1 and TIMP-2 proteins and α-SMA mRNA as well as MMP-2 and MMP-9 activity in liver tissue increased gradually in the model group and peaked at 4 wk. Compared with the model control subgroup, the expression levels of Fas, caspase-8, caspase-3, TIMP-1 and TIMP-2 proteins and α-SMA mRNA as well as MMP-2 activity at 6 wk were significantly reduced (1.05 ± 0.02 vs 1.17 ± 0.04, 1.41 ± 0.04 vs 1.98 ± 0.06, 0.86 ± 0.01 vs 1.19±0.04, 1.03 ± 0.03 vs 1.58 ± 0.06, 1.16 ± 0.04 vs 1.53 ± 0.01, 3.12 ± 0.47 vs 8.48 ± 0.45 and 2.15 ± 0.03 vs 2.33 ± 0.05, respectively; all P < 0.05 or 0.01), and MMP-9 protein expression and activity were significantly increased (1.21 ± 0.00 vs 1.12 ± 0.01 and 1.25 ± 0.07 vs 1.10 ± 0.04, respectively; both P < 0.05 or 0.01) in liver tissue in the Huangqi Decoction subgroup.
CONCLUSION: Huangqi Decoction exerts significant anti-fibrotic effects perhaps by inhibiting hepatic cell apoptosis and hepatic stellate cell (HSC) activation, modulating the MMPs/TIMPs system, and promoting extracellular matrix (ECM) degradation.
- Citation: Yan XF, Liu P, Sun MY, Wang XL. Mechanisms underlying the therapeutic effect of Huangqi Decoction against dimethylnitrosamine-induced liver fibrosis in rats. Shijie Huaren Xiaohua Zazhi 2010; 18(23): 2410-2415
- URL: https://www.wjgnet.com/1009-3079/full/v18/i23/2410.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i23.2410
肝纤维化是继发于各种原因引起的肝脏的一种损伤修复反应过程[1], 是肝硬化的早期和必经阶段, 在一定情况下可被逆转[2-5]. 目前认为肝脏损伤-肝实质炎症、坏死-肝星状细胞(hepatic stellate cell, HSC)激活-大量肝脏内细胞外基质(extracellular matrix, ECM)沉积, 是肝纤维化发生机制的核心环节. 其中肝细胞凋亡是肝纤维化进展的重要促动因素, HSC激活, ECM降解减少是肝纤维化发生的重要环节. 本实验在前期实验的基础上进一步探讨黄芪汤对二甲基亚硝胺(dimethylnitrosamine, DMN)诱导的大鼠肝纤维化的作用机制.
Wistar大鼠, ♂, 54只, 清洁级, 体质量150-180 g, 购自中国科学院上海实验动物中心, 上海中医药大学实验动物中心饲养, 造模和观察, 正常饮食饮水. 黄芪汤由黄芪、炙甘草组成, 制成粗粉末. 水煎, 浓缩煎出液制成流浸膏, 真空干燥后冷藏保存. DMN购自日本东京化成株式会社. 小鼠抗Fas单克隆抗体(BD Bioscience公司); 兔抗caspase-8单克隆抗体 (CHEMICON公司); 兔抗caspase-3单克隆抗体(Cell Signaling Technology公司); 小鼠抗MMP-9单克隆抗体(Calbiochem公司); 小鼠抗TIMP-1单克隆抗体(Lab Vision公司); 小鼠TIMP-2单克隆抗体(Lab Vision公司). 逆转录试剂盒(Revert AidTM First Strand cDNA Synthesis Kit), Ferments Life Sciences(购于晶美生物工程有限公司); 荧光定量PCR检测试剂盒, SYBR Green Ex TaqTM(perfect Real Time), TaKaRa Biotechnology(Dalian)Co.Ltd, (购自上海皓嘉科技发展有限公司).
1.2.1 造模及分组: 采用Ala-Kokko方法[6]复制肝纤维化模型. 模型组40只大鼠以2 mL/kg剂量于每周前3 d连续腹腔注射0.5%的DMN溶液(以生理盐水稀释), 共4 wk. 正常组大鼠腹腔注射等量生理盐水. 在造模的2、4 wk分别处死正常组大鼠3只/模型组大鼠4只, 正常组大鼠3只/模型组大鼠6只, 作为用药前动态观察. 造模结束后, 将模型组大鼠随机分为模型对照组(15只), 黄芪汤组(15只), 另外还剩下正常组(8只). 黄芪汤组于第5周起, 按65 kg体质量成人临床用量的8倍量用蒸馏水10 mL稀释灌胃, 每日1次, 共2 wk. 正常组与模型对照组以同体积生理盐水灌胃. 实验结束时戊巴比妥钠麻醉, 打开腹腔, 取肝, 称质量后, 以Eppendorf管分装后液氮速冻, -80 ℃保存备用.
1.2.2 免疫印迹法检测肝组织Fas、caspase-8、caspase-3、MMP-9、TIMP-1、TIMP-2蛋白表达: 提取肝组织蛋白, 定量, 与SDS上样缓冲液混合, 95 ℃-100 ℃变性5 min; 制胶, 上样, 电泳, 切胶, 半干转膜器恒流300 mA转PVDF膜70 min; 1×TTBS洗膜5 min×3次, 以5%脱脂奶粉TTBS封闭, 室温震荡1 h; 置于经封闭液稀释的一抗(Fas: 1:5 000; caspase-8: 1:100; caspase-3: 1:1 000; MMP-9: 1:100; TIMP-1: 1:200; TIMP-2: 1:4 000)中, 4℃轻摇过夜; 1×TTBS洗膜5 min×3次, 置于经1×TTBS稀释的二抗中, 室温震荡1 h, TTBS洗5 min×3次, 除去未结合的二抗. 暗室中发光, 压片, 显影, 定影; 应用复日FR-200生物电泳图象分析系统分析底片中的目的条带, 计算机自动读取并记录每条带的光密度值. 目的条带与内参(GAPDH)条带光密度的比值为目的蛋白的相对表达量, 正常组蛋白的相对表达量计为1.
1.2.3 实时定量PCR法检测α-SMA mRNA表达量: 提取肝组织总RNA, 反转录后进行PCR扩增. 18S为内参. 引物如下: α-SMA Forward: 5'-CGAGAGGACGTTGTTAGCATAGAG-3', Reverse: 5'-GGGCATCCACGAAACCA-3'; 18S Forward: 5'-GTAACCCGTTGAACCCCATT-3', Reverse: 5'-CCATCCAATCGGTAGTAGCG-3'. PCR反应条件: 95 ℃预变性10 s; 95 ℃变性5 s, 退火延伸并作一步, 温度58 ℃, 20 s, 共40个循环.
1.2.4 明胶酶图法检测肝组织MMP-2、MMP-9活性: 提取肝组织蛋白, 定量, 制备SDS聚丙烯酰胺凝胶, 含0.1%明胶的8%分离胶, 5%堆积胶, 取含50 μg总蛋白的匀浆液与4倍样品缓冲液混和后上样, 进行还原但非变性电泳. 电泳条件: 4 ℃, 60 V, 时间约2.5 h. 电泳结束后, 凝胶置于洗脱液中洗脱45 min×2, 然后以漂洗液漂洗30 min×2. 其后, 将凝胶置于孵育液中, 37 ℃孵育18 h. 孵育结束后经考马斯亮蓝染色液染色4 h, 可显示出MMP-2和MMP-9位于蓝色背景上的透亮带. 应用复日FR-200生物电泳图像分析系统在灰阶模式下扫描电泳凝胶, 并分析MMPs活性条带灰度密度值, 正常组MMPs活性计为1.
统计学处理 计量资料以mean±SD表示, 采用SPSS11.5中的ANOVA程序进行单因素方差分析, 组间比较采用q检验, P<0.05为差异有统计学意义.
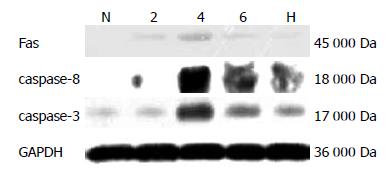
各时间点模型组大鼠肝组织Fas、caspase-8、caspase-3相对表达量显著高于正常组(P<0.01), 4 wk模型组大鼠肝组织Fas、caspase-8、caspase-3表达最高, 6 wk有所下降. 与6 wk模型组相比, 黄芪汤组大鼠肝组织Fas(P<0.01), caspase-8(P<0.01), caspase-3(P<0.01)蛋白表达显著降低(图1, 表1).
各时间点模型组及黄芪汤组大鼠肝组织α-SMA mRNA表达显著高于正常组(P<0.01), 4 wk模型组大鼠肝组织表达最高; 6 wk有所下降, 与6 wk模型组相比, 黄芪汤组大鼠肝组织α-SMA mRNA表达显著降低(P<0.01).
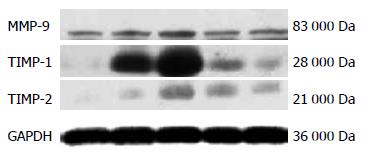
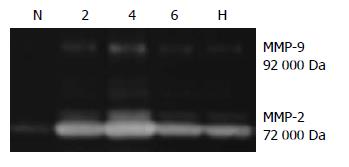
各时间点模型组大鼠肝组MMP-9、TIMP-1、TIMP-2蛋白表达, MMP-2、MMP-9活性显著高于正常组, 4 wk模型组最高, 6 wk有所下降; 与6 wk模型组相比, 黄芪汤组大鼠肝组织TIMP-1, TIMP-2蛋白表达(P<0.05), MMP-2活性显著降低(均P<0.05), MMP-9蛋白表达(P<0.05)及MMP-9活性明显升高(P<0.01, 图2, 3, 表2, 3).
肝纤维化是由肝细胞损伤引起炎症反应、肝纤维组织增生和肝细胞结节状再生3种改变反复交错进行的过程, 是一个缓慢而动态的过程, 涉及细胞、细胞因子、ECM之间一系列复杂的变化[7-9]. 肝细胞凋亡是肝细胞增生不良、肝纤维化进展的重要促动因素.
细胞凋亡在人体组织细胞中普遍存在, 他由基因编程控制, 许多基因参与此过程的调节, 细胞凋亡是有核细胞通过启动自身内部的遗传机制激活内源性DNA内切酶而发生的一种主动细胞死亡的过程. 正常肝组织中肝细胞凋亡少见, 随着肝纤维化发生、发展, 肝细胞凋亡出现显著的变化. 细胞凋亡可能是不同类型肝病细胞死亡的共同通路[10], 严重慢性病毒性肝炎患者肝细胞凋亡明显增加[11], 原发性胆汁性肝硬化患者肝中肝细胞和胆管上皮细胞凋亡率增加[12].
课题组前期研究证实[13,14], 黄芪汤能显著改善大鼠肝组织病理变化, 降低羟脯氨酸(Hyp)含量, 降低血ALT、AST、ALP、GGT活性, 进而有效逆转肝纤维化. 本研究基于前期良好的药效学基础, 进一步探讨黄芪汤抗肝纤维化的作用机制. 结果显示, 2、4、6 wk模型组大鼠肝组织凋亡相关蛋白Fas、caspase-8、caspase-3表达量明显高于正常组, 黄芪汤明显减少模型大鼠Fas、caspase-8、caspase-3蛋白表达量, 与α-SMA mRNA表达量趋势一致. 提示肝细胞凋亡、HSC激活之间存在密切的因果关系, 黄芪汤可有效抑制肝细胞凋亡及HSC激活.
细胞凋亡的途径主要有3条, 他们是: 线粒体通路、死亡受体通路、内质网通路. Fas、caspase-8、caspase-3是死亡受体通路的主要蛋白. 研究发现[15-19], 在肝脏疾病中, 肝细胞凋亡主要是通过Fas/FasL途径介导所致. 有研究证实[21], DMN诱导细胞凋亡, 与死亡受体信号结合, 诱导肝细胞凋亡, 通过细胞外信号释放趋化性/炎症性因子加重肝损伤并激活HSC; HSC可以吞噬肝细胞凋亡小体, 增强促纤维形成基因及死亡配体的表达. 黄以群等[22]研究表明, 苦参素可显著降低慢性乙型肝炎患者血清中FasL、Fas、TNF-α、IL-6水平. 严茂祥等[17]研究认为中药复方肝力克可调节肝纤维化大鼠肝细胞的凋亡水平, 抑制肝纤维化大鼠肝细胞Fas/FasL, Bcl-2/Bax的表达. 黄芪汤抑制肝细胞凋亡, 可能通过死亡受体途径发挥主要作用.
HSC的过度激活是肝纤维化的中心环节, 并最终导致大量ECM的合成, 而α-SMA蛋白的过度表达是HSC活化的标志. α-SMA蛋白表达的增强提示大量成纤维细胞的侵入和活化, 进一步合成胶原. 本实验结果显示, 大鼠肝组织α-SMA mRNA表达随模型进展明显持续升高, 黄芪汤能够明显减少模型大鼠α-SMA mRNA表达量, 说明在外界因素的刺激下, HSC激活并增殖, 导致ECM合成分泌增多, 从而发生肝纤维化, 且肝纤维化程度随刺激因素的持续而进行性加重, 而黄芪汤可通过抑制HSC激活与增殖达到抗肝纤维化的作用.
目前认为肝纤维化是各种原因导致的肝损伤持续存在, 组织发生修复反应时因ECM合成和代谢失衡, 导致ECM产生多于降解, ECM在肝内异常沉积而引起的病理过程, 是一个涉及复杂的细胞及分子机制的动态过程[23]. 影响ECM合成和降解平衡的因素很多, 其中调控ECM代谢的细胞因子失衡是最重要原因[24].
肝组织中, 基质金属蛋白酶(matrix metalloproteinases, MMPs)及其抑制因子基质金属蛋白酶组织抑制因子(tissue inhibitor of metal protease, TIMPs)在纤维形成和纤维降解中发挥重要作用[25], MMPs促进ECM降解, 而TIMPs通过抑制MMPs阻止ECM降解[26,27]. 正常情况下, MMPs/TIMPs处于动态平衡, 调节肝内ECM的合成和降解, 维持其质和量的稳定. 病理状态下MMPs/TIMPs失衡与肝炎、肝纤维化、肝硬化的发生发展有密切关系[28].
MMP-2是相对分子质量72 000 Da的明胶酶, 以无活性的前体形式产生, 激活后可以分解基底膜的主要成分Ⅳ型胶原, 后者是维持HSC于生理性静息状态的必要物质, 而活化的HSC不仅能产生大量的ECM, 也是肝内MMP-2的主要来源, MMP-2通过降解正常的内皮下基质, 破坏肝HSC等多种细胞生存的内环境, 有利于HSC的激活, 因而MMP-2与HSC活化两者互为因果, 在肝纤维化早期尤为突出, 并使纤维化进程不断推进[29]. Murawaki等[30]检测了肝组织内MMP-2酶原含量, 其升高程度与肝组织胶原含量呈正相关. Takahara等[31]证实MMP-2参与了肝纤维化过程中肝组织的重塑, 活动性评分呈正相关. 本实验结果与上述研究非常一致, DMN大鼠肝组织MMP-2活性随着模型的加重逐渐升高, 4 wk时达到高峰. 与6 wk模型组相比, 黄芪汤组MMP-2活性明显降低, 表明黄芪汤可下调MMP-2的表达来改善HSC等多种细胞生存的内环境, 使HSC活化减少, 从而使肝纤维化程度减轻. 由此提示, 下调MMP-2表达, 从而改善HSC等多种细胞生存的内环境, 使HSC活化较少, 是黄芪汤有效治疗实验性大鼠肝纤维化的机制之一.
MMP-9是相对分子质量92 000 Da的明胶酶, 主要来源于库弗细胞[32], 以酶原形式分泌, 被激活后形成Ⅳ型胶原酶, 降解破坏ECM和基底膜[33]. 关于MMP-9在肝纤维化中的作用目前尚有争议[34]. 黄芪汤组大鼠肝组织蛋白表达MMP-9显著升高, TIMP-1, 2明显降低, MMP-9活性明显增强. 提示黄芪汤可以显著提高MMP-9活性, 促进MMP-9而抑制TIMP-1, 2表达, 降解过度沉积的ECM, 维持MMPs/TIMPs调控的动态平衡.
前期研究[13]根据中医以方测证理论认为DMN大鼠肝硬化的病机既有气虚又有湿阻, 两者并重. 但单纯补气有助湿之弊, 单纯祛湿有伤正之虞. 黄芪汤重用黄芪为君, 补中气助气化, 气足则湿邪得化, 湿去则正气得复, 再少以甘草为臣佐, 补中益气, 助黄芪补中气, 共同达到补气祛湿之功用. 切中DMN大鼠纤维化的病机特点. 以上研究结果结合现代研究[35-37], 提示黄芪汤具有明显的抗肝纤维化的作用, 其作用机制与抑制肝细胞凋亡, 抑制HSC活化、调控MMPs/TIMPs系统, 促进ECM降解有关.
肝纤维化是各种慢性肝病发展的共同途径, 也是进一步向肝硬化发展的必经之路, 在一定情况下可被逆转, 但若病因持续存在, 肝纤维化逐渐加重, 肝小叶及血管等逐渐被改建, 最终发展为不可逆转的肝硬化. 如何逆转肝纤维化成为当今肝病学界的热点问题.
朱传武, 主任医师, 江苏省苏州市第五人民医院传染科; 姚登福, 教授, 南通大学附属医院分子医学中心
黄芪汤重用黄芪为君, 少以甘草为臣佐, 共同达到补气祛湿之功用. 药效学结果显示可有效逆转肝纤维化, 但其抗肝纤维化的机制还有待进一步研究.
有研究证实, 二甲基亚硝胺(DMN)诱导细胞凋亡, 与死亡受体信号结合, 诱导肝细胞凋亡, 通过细胞外信号释放趋化性/炎症性因子加重肝损伤并激活HSC; HSC可以吞噬肝细胞凋亡小体, 增强促纤维形成基因及死亡配体的表达.
本研究以中医经典方剂黄芪汤为研究对象, 从分子生物学角度探讨其抗肝纤维化的作用机制.
本研究显示, 黄芪汤可抑制肝细胞凋亡, 抑制HSC活化、调控MMPs/TIMPs系统, 促进ECM降解, 进一步提示其具有抗肝纤维化的作用, 为本方的临床应用奠定了良好的基础.
本文选题尚可, 设计合理, 结论具有一定的临床参考价值.
编辑: 李军亮 电编:吴鹏朕
| 2. | Friedman SL. Hepatic fibrosis -- overview. Toxicology. 2008;254:120-129. [PubMed] [DOI] |
| 3. | Tsukada S, Parsons CJ, Rippe RA. Mechanisms of liver fibrosis. Clin Chim Acta. 2006;364:33-60. [PubMed] [DOI] |
| 4. | Rovida E, Navari N, Caligiuri A, Dello Sbarba P, Marra F. ERK5 differentially regulates PDGF-induced proliferation and migration of hepatic stellate cells. J Hepatol. 2008;48:107-115. [PubMed] [DOI] |
| 5. | Bennett RG, Dalton SR, Mahan KJ, Gentry-Nielsen MJ, Hamel FG, Tuma DJ. Relaxin receptors in hepatic stellate cells and cirrhotic liver. Biochem Pharmacol. 2007;73:1033-1040. [PubMed] [DOI] |
| 6. | Ala-Kokko L, Pihlajaniemi T, Myers JC, Kivirikko KI, Savolainen ER. Gene expression of type I, III and IV collagens in hepatic fibrosis induced by dimethylnitrosamine in the rat. Biochem J. 1987;244:75-79. [PubMed] |
| 8. | Lamireau T, Desmoulière A, Bioulac-Sage P, Rosenbaum J. [Mechanisms of hepatic fibrogenesis]. Arch Pediatr. 2002;9:392-405. [PubMed] [DOI] |
| 9. | Mattioli B, Straface E, Quaranta MG, Giordani L, Viora M. Leptin promotes differentiation and survival of human dendritic cells and licenses them for Th1 priming. J Immunol. 2005;174:6820-6828. [PubMed] |
| 10. | Jiang Z, Liu Y, Savas L, Smith L, Bonkovsky H, Baker S, Banner B. Frequency and distribution of DNA fragmentation as a marker of cell death in chronic liver diseases. Virchows Arch. 1997;431:189-194. [PubMed] [DOI] |
| 12. | Reynaert H, Chavez M, Geerts A. Vascular endothelial growth factor and liver regeneration. J Hepatol. 2001;34:759-761. [PubMed] [DOI] |
| 15. | Jodo S, Kung JT, Xiao S, Chan DV, Kobayashi S, Tateno M, Lafyatis R, Ju ST. Anti-CD95-induced lethality requires radioresistant Fcgamma RII+ cells. A novel mechanism for fulminant hepatic failure. J Biol Chem. 2003;278:7553-7557. [PubMed] [DOI] |
| 16. | Xia M, Xu C, Ji S, Xue S. Shedding of Fas ectodomain that affects apoptosis of hepatocytes occurring in regenerative liver. J Gastroenterol. 2002;37:1042-1047. [PubMed] [DOI] |
| 17. | Bajt ML, Vonderfecht SL, Jaeschke H. Differential protection with inhibitors of caspase-8 and caspase-3 in murine models of tumor necrosis factor and Fas receptor-mediated hepatocellular apoptosis. Toxicol Appl Pharmacol. 2001;175:243-252. [PubMed] [DOI] |
| 18. | Matsui H, Hikichi Y, Tsuji I, Yamada T, Shintani Y. LIGHT, a member of the tumor necrosis factor ligand superfamily, prevents tumor necrosis factor-alpha-mediated human primary hepatocyte apoptosis, but not Fas-mediated apoptosis. J Biol Chem. 2002;277:50054-50061. [PubMed] [DOI] |
| 19. | Nakae H, Zheng YJ, Wada H, Tajimi K, Endo S. Involvement of IL-18 and soluble fas in patients with postoperative hepatic failure. Eur Surg Res. 2003;35:61-66. [PubMed] [DOI] |
| 25. | Hemmann S, Graf J, Roderfeld M, Roeb E. Expression of MMPs and TIMPs in liver fibrosis - a systematic review with special emphasis on anti-fibrotic strategies. J Hepatol. 2007;46:955-975. [PubMed] [DOI] |
| 26. | Olaso E, Friedman SL. Molecular regulation of hepatic fibrogenesis. J Hepatol. 1998;29:836-847. [PubMed] [DOI] |
| 28. | Iredale JP. Tissue inhibitors of metalloproteinases in liver fibrosis. Int J Biochem Cell Biol. 1997;29:43-54. [PubMed] [DOI] |
| 29. | Nagase H. Activation mechanisms of matrix metalloproteinases. Biol Chem. 1997;378:151-160. [PubMed] |
| 30. | Murawaki Y, Yamada S, Ikuta Y, Kawasaki H. Clinical usefulness of serum matrix metalloproteinase-2 concentration in patients with chronic viral liver disease. J Hepatol. 1999;30:1090-1098. [PubMed] [DOI] |
| 31. | Takahara T, Furui K, Yata Y, Jin B, Zhang LP, Nambu S, Sato H, Seiki M, Watanabe A. Dual expression of matrix metalloproteinase-2 and membrane-type 1-matrix metalloproteinase in fibrotic human livers. Hepatology. 1997;26:1521-1529. [PubMed] [DOI] |
| 32. | Feldstein AE, Canbay A, Angulo P, Taniai M, Burgart LJ, Lindor KD, Gores GJ. Hepatocyte apoptosis and fas expression are prominent features of human nonalcoholic steatohepatitis. Gastroenterology. 2003;125:437-443. [PubMed] [DOI] |
| 33. | 周 建华, 王 文祥, 文 继舫, 曹 慧秋, 沈 明. MMP-2、MMP-9、TIMP-1、TIMP-2在非小细胞肺癌中的表达及临床病理学 意义. 实用预防医学. 2006;12:23-26. |
| 34. | Reif S, Somech R, Brazovski E, Reich R, Belson A, Konikoff FM, Kessler A. Matrix metalloproteinases 2 and 9 are markers of inflammation but not of the degree of fibrosis in chronic hepatitis C. Digestion. 2005;71:124-130. [PubMed] [DOI] |
| 36. | 宋 少刚, 杨 雁, 陈 敏珠. 黄芪总提物对大鼠肝星状细胞增殖及产生胶原的影响. 中国临床药理学与治疗学. 2001;6:111-113. |
| 37. | 宋 少刚, 杨 雁, 路 景涛, 周 爱武, 陈 敏珠. 黄芪总甙抗肝纤维化作用及其机制. 第七届中国抗炎免疫药理学术会议论文摘要集. 2000;17:9. |