修回日期: 2010-06-16
接受日期: 2010-06-28
在线出版日期: 2010-08-08
目的: 探讨肝再生过程中线粒体通透性转换的作用.
方法: 将SD大鼠105只随机分成3个实验组: 肝再生(PH)组、环孢菌素A(CsA)处理组和对照(SH)组, 每组取7个时间点; PH组和CsA组大鼠经70%肝切除, CsA组用CsA进行灌胃. 用透射电镜观察线粒体超微结构的变化, 并检测肝组织匀浆内丙二醛(MDA)的变化.
结果: 透射电镜显示在PH后24 h时线粒体发生重度肿胀, 线粒体明显增大变圆, 基质变淡, 甚至完全空泡化, 嵴明显缩短甚至消失; 72 h时中度肿胀, 6 h、120 h时轻度肿胀, 内质网也有类似的变化; CsA组在0 h、3 h和6 h时轻度肿胀, 24 h中度肿胀, 72 h和168 h时则明显收缩. 肝组织中MDA在PH后3 h时轻度升高, 到24 h时达到最高, 之后逐渐下降, 到120 h时恢复正常. CsA组MDA的变化规律与PH组的基本一致, 但在(0-120 h)的各个时间点自由基含量明显高于PH组.
结论: 肝再生过程中, 线粒体的超微结构变化和肝组织MDA的变化可能与线粒体通透性转换有关, 尤其在24 h时变化最显著, 这种变化与肝再生的启动密切相关.
引文著录: 周运恒, 曹广亚, 袁斌, 焦炳华, 缪明永. 肝线粒体超微结构和自由基在大鼠肝再生过程中的变化. 世界华人消化杂志 2010; 18(22): 2302-2307
Revised: June 16, 2010
Accepted: June 28, 2010
Published online: August 8, 2010
AIM: To investigate the role of mitochondria permeability transition (MPT) in liver regeneration.
METHODS: One hundred and five male Sprague-Dawley rats were randomly divided into three groups: partial hepatectomy (PH) group, cyclosporin A (CsA) group and sham-operated (SH) group. Animals in the PH and CsA groups underwent 2/3 partial hepatectomy. Animals in the CsA group were administered CsA before the surgery. The animals in each group were further divided into seven sub-groups. Ultrastructural morphology of mitochondria in remnant liver after PH was determined by electron microscopy. The content of malondialdehyde (MDA) in liver tissue was also measured.
RESULTS: Remarkable changes were observed in the morphology and ultrastructure of the liver mitochondria at 24 h after PH, including conspicuous swelling, increased membrane permeability, reduced number of cristae, and matrix vacuolation. At 72 h, moderate mitochondrial swelling was observed, while, at other time points, mild mitochondrial swelling was seen. Mitochondrial permeability increased at 0, 3 and 6 h in the CsA group, but decreased at 24 and 72 h when compared with the PH group. Similar changes in endoplasmic reticulum were also noted. The content of MDA increased at 3 h after PH, peaked at 24 h, and then decreased and returned to normal level at 120 h. The contents of MDA at all time points in the CsA group were significantly higher than those in the PH group.
CONCLUSION: The changes in mitochondrial ultrastructure and MDA level are closely associated with MPT during live regeneration in rats, especially prominent at 24 h after PH. The changes in mitochondrial ultrastructure and MDA level in liver tissue is possibly related to the initiation of liver regeneration after PH.
- Citation: Zhou YH, Cao GY, Yuan B, Jiao BH, Miao MY. Changes in mitochondrial ultrastructure and malondialdehyde level in regenerating liver tissue in rats. Shijie Huaren Xiaohua Zazhi 2010; 18(22): 2302-2307
- URL: https://www.wjgnet.com/1009-3079/full/v18/i22/2302.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i22.2302
大鼠经70%肝切除后(partial hepatectomy, PH), 其残余肝组织再生过程非常显著, 大约经过7-10 d就可以恢复到原来的体积和体质量. 研究肝再生分子机制必将对肝脏移植、创伤、各种肝病及肝肿瘤诊治具有重要意义. 但是目前对肝再生的分子机制, 尤其是肝再生启动和终止的机制仍不清楚. 而能量代谢的调控始终是肝细胞再生过程中的重要环节, 线粒体作为细胞生命活动中一个非常重要的细胞器, 他不仅为细胞活动各个环节提供所需的能量, 而且直接参与细胞内许多信号转导过程, 与细胞许多生命活动有关[1,2]. 近年来关于肝再生与线粒体通透性转换(mitochondrial permeability transition, MPT)的关系研究比较多, 发现在肝再生过程中MPT有一些明显特征性的变化, 提示线粒体可能是肝再生过程的一个重要调节点, 可能与肝再生的启动和终止有关[3-5]. 我们通过离体实验研究发现: 在大鼠肝再生早期(PH后0-24 h)和后期(PH后120-168 h)都表现为肝线粒体先收缩后肿胀, 也即通透性先下降后增高[6]. 但是线粒体由于纯化技术和活性不稳定等原因, 在体和离体的结构和功能可能会有所不同, 而且目前国内外在此方面的研究比较少, 仅见Ferri等[7]关于在肝再生早期线粒体超微结构在PH后24 h发生肿胀的报道.
MPT受许多因素影响, 其中活性氧族(reactive oxygen species, ROS)是一个重要的诱导因素, 线粒体消耗的氧约有2%-5%用于生成ROS, 主要是是呼吸链复合物Ⅰ、Ⅲ漏出的电子直接与氧反应生成的; 线粒体通透性转换孔开放又可引起线粒体产生ROS[8,9]. 有研究发现肝再生早期肝线粒体氧化磷酸化下降时, 肝线粒体内自由基显著升高和GSH含量下降, 而当肝线粒体氧化磷酸化恢复上升时, 自由基则逐步下降, 两者呈现十分明显的消长关系[10]. 但是整个肝再生过程的自由基变化与MPT的关系还未见报道. 我们通过建立肝再生模型, 并用线粒体通透性转换抑制剂环保菌素A(cyclosporin A, CsA)对肝再生过程进行在体的干预, 系统研究肝再生过程中肝脏线粒体超微结构的变化, 自由基代谢产物丙二醛(malondialdehyde, MDA)与MPT之间的关系, 以期进一步探讨线粒体通透性的改变与肝再生之间的关系.
实验动物分组SD大鼠, ♂, 8 wk左右, 体质量200-250 g, 购于中国人民解放军第二军医大学实验动物中心, 正常饮食, 室温24 ℃±2 ℃, 每天光照12 h. 日立H-800型透射电镜, LKB超薄切片机, Model 100A高精度天平(美国精密仪器公司), 722-S分光光度计. 考马斯亮蓝试剂盒为上海申能博彩生物科技有限公司, MDA检测试剂盒为南京建成生物工程研究所, 环孢素软胶囊(Novartis, 诺华制药, 德国), 橄榄油为意大利原装进口, 多聚甲醛和EPON 812包埋剂为Sigma公司.
1.2.1 分组: 105只大鼠随机分成3个实验组: 肝再生(PH)组、CsA处理的肝再生(CsA)组和对照(sham-operated, SH)组, 每组取7个时间点, 分别是术后0、3、6、24、72、120和168 h, 每个时间点取5只动物. CsA组在手术前4 d和手术后1 d按照20 mg/(kg•d)的CsA进行灌胃, CsA用橄榄油(5 g/L)溶解, 同时PH和SH组的所有大鼠按照相同的剂量用安慰剂橄榄油灌胃[11].
1.2.2 造模: PH组和CsA组大鼠用乙醚麻醉后, 切除肝左叶和中叶(约为全肝的70%)[12]; SH组动物同样施行麻醉和开腹, 但不切肝.
1.2.3 透射电镜: 各个时间点5只大鼠同时断头处死, 迅速分离肝组织, 用锋利的刀片在每只大鼠的肝右叶切取4块1 mm×1 mm×1 mm大小组织, 用40 g/L多聚甲醛固定4 h, 1%锇酸固定2 h时; 0.1 mol/L PBS漂洗 10 min; 丙酮梯度脱水: 30、50、70、90%各1次, 每次10 min, 100%丙酮脱水3次, 每次10 min; EPON 812包埋剂浸透、包埋、聚合; LKB超薄切片机切片; 铀染色30 min, 铅染色5-10 min; 日立 H-800透射电镜观察.
1.2.4 10%肝匀浆的制备: 动物断头取肝, 称肝质量, 加入10 mL/g分离介质(Buffer A: 250 mmol/L甘露醇、75 mmol/L蔗糖、0.1 mmol/L K+-EDTA、0.5 mmol/L K+-EGTA、10 mmol/L K+-HEPES、pH7.2). 用Teflon芯的玻璃匀浆器匀浆, 低速离心3 000 r/min, 15 min, 取上清用于测定肝MDA含量, 整个分离过程严格控制在4 ℃中进行.
1.2.5 丙二醛(MDA)的测定: 用考马斯亮蓝试剂盒测定蛋白浓度, 按照操作说明测定和计算各时间点肝组织匀浆中MDA的含量.
统计学处理 采用SPSS13.0统计分析软件, 组间比较用t检验, 数据均以mean±SD表示. P<0.05差异有统计学意义.
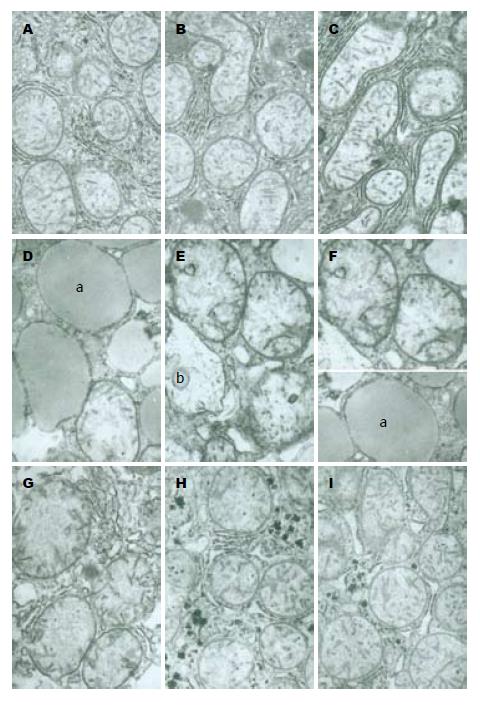
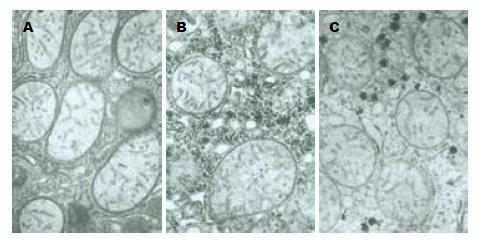
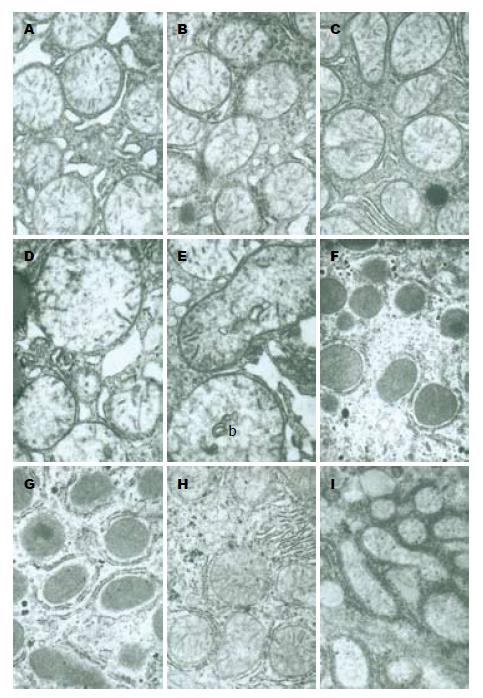
在PH组内, 0、3和168 h时, 线粒体基本正常, 外膜完整, 基质和嵴清楚, 粗面和光滑内质网基本正常; 在6 h和120 h时, 线粒体轻度肿胀, 基质较淡, 嵴缩短, 粗面内质网和光滑内质网轻度扩张; 在24 h时, 线粒体质量度肿胀, 体积增大变圆, 基质电子密度变低, 颜色很淡甚至空泡化, 嵴明显缩短甚至消失溶解, 部分出现嵴肿胀, 部分线粒体外膜膨胀鼓泡, 甚至破裂, 内质网极度扩张; 在72 h时线粒体中度扩张, 形态变圆基质变淡, 嵴明显缩短, 部分线粒体外膜膨胀破裂, 内质网也有类似的变化(图1). 在SH组内, SH后3 h和168 h, 线粒体基本正常, 外膜完整, 基质和嵴清楚, 粗面和光滑内质网基本正常; SH后24 h线粒体轻微肿胀, 基质稍淡, 嵴部分轻微缩短, 内质网中度扩张(图2). 在CsA组, 0、3和6 h时线粒体轻度肿胀; 在24 h时线粒体中度肿胀, 基质变淡, 部分甚至空泡化, 嵴明显缩短, 部分出现嵴肿胀, 外膜局部破裂, 线粒体体积增大变圆, 内质网中度扩张; 在72和168 h时线粒体明显收缩, 体积变小, 嵴清晰, 基质电子密度增加, 粗面内质网扩张, 数量明显增加(图3).
在PH组, MDA在早期3 h时开始升高, 到24 h时达到峰值, 然后逐渐下降, 到120 h时恢复正常; 在CsA组与PH组的变化规律基本一致, 但在(3-72 h)阶段的各时间点, MDA含量则显著高于PH组(P<0.01, 表1).
在本实验中, 我们发现肝再生过程中与对照组相比, PH组在术后24和72 h时线粒体的超微结构变化最明显, 发生重度肿胀, 72 h时发生中度肿胀, 同时内质网也有类似的变化. 说明在PH后24和72 h时线粒体的通透性增高, 这与Guerrieri等[13]的研究基本一致, 他们也认为在PH后24 h时线粒体的通透性最大, 而且此时有一些线粒体基质酶如苹果酸脱氢酶、天冬氨酸氨基转移酶释放到胞液中. 我们通过离体实验研究发现线粒体通透性在早期和后期都升高, 早期的这些变化与我们在体实验的结果相一致, 但是后期的变化规律与在体的变化情况明显不一致, 我们在体实验发现在肝再生后期(PH后120、168 h)线粒体和内质网的结构已经基本恢复正常, 与SH组基本一致, 并没有发生肿胀. 而在离体情况下线粒体的通透性变化可能是因为对Ca2+的敏感性发生变化, 并不表现在结构上.
而用CsA处理后的动物在肝再生早期(0、3、6 h)时线粒体有轻度的肿胀, 同时发现0 h和3 h时内质网明显肿胀, 表明内质网功能增强, 这些变化可能与CsA对肝脏的毒性作用有关. 有学者认为CsA在肝移植后作为免疫抑制剂时对肝再生有一定的毒性作用[14]. 在24 h时线粒体和内质网的肿胀程度比对应的PH组低, 在72 h和168 h时线粒体发生明显收缩, 这可能与CsA对线粒体通透性直接抑制作用有关.
在肝再生过程中, 线粒体超微结构的特征性变化, 尤其是在PH后24 h时, 线粒体发生重度肿胀, 72 h时发生中度肿胀, 到后期恢复正常, 一方面说明在肝再生过程中线粒体肿胀是可逆性的. 另一方面, 线粒体肿胀可能与MPT直接相关. 这种改变可能有利于线粒体内外的物质和离子交换, 尤其是24 h时超微结构变化最明显, 这意味着肝再生过程中线粒体超微结构的变化与肝再生的发生和发展有一定的相关性.
线粒体呼吸链是体内氧自由基的主要来源, 同时线粒体膜中含有较丰富的多不饱和脂肪酸, 易受氧自由基尤其是羟自由基的攻击, 发生脂质过氧化反应, 使线粒体膜结构改变, 膜镶嵌的一系列酶空间排列紊乱, 活性降低, 从而使膜通透性改变. MDA是自由基的代谢产物, 其高低可反应机体细胞自由基水平程度. 在本实验中, 我们发现在PH后3 h时MDA轻度升高, 到24 h时达到最高, 之后逐渐下降, 到120 h时恢复正常. Crumm等[15]研究发现在肝再生的早期(0-48 h)线粒体ATP酶活性显著降低, 这可能提示自由基的增多抑制ATP酶活性, 从而诱导肝再生的启动.
CsA组在肝再生过程中(0-72 h)阶段自由基显著升高, Kim等[16]研究发现CsA可以引起PH后24 h肝组织自由基升高, 并认为CsA促进自由基的升高可能是与CsA的免疫抑制剂的不良反应有关. Rezzani等[17]研究发现CsA在肝移植术后, 还会引起肝细胞中毒样的形态学改变以及细胞内氧化作用和抗氧化作用的失衡.
肝再生早期自由基升高确切机制不太清楚, 可能与Ca2+升高或抗氧化系统的削弱等多方面有关, MPT又与许多因素有关, 如Ca2+是线粒体的一个重要诱导剂, 与线粒体膜通透性有着密切的关系. 有研究报道肝再生过程PH后24 h肝线粒体内Ca2+明显升高, Ca2+增加可以诱导ROS的产生, 从而使线粒体膜通透性升高, 同时Ca2+也可以通过线粒体通透性转运孔(permeability transition pore, PTP)转运, 从而来调节细胞和线粒体的功能[18,19].
MDA在肝再生早期显著升高, 而且MDA在时相上比MPT变化更早, 提示肝再生早期MPT的变化可能是由自由基升高而引起的. 同时自由基与MPT是互为因果关系, 两者的相互影响可能在肝再生过程中起很重要的作用. 尤其是在PH后24 h时MDA含量最高, 而此时线粒体的超微结构变化最明显, 线粒体的肿胀可能与线粒体功能代偿性增强有关, 而这种变化对肝再生的发生有着积极的意义, 但是MPT变化的具体机制和意义仍需要进一步研究.
线粒体是肝再生过程的一个重要调节点, 可能与肝再生的启动和终止有关, 研究肝再生分子机制必将对肝脏移植、创伤、各种肝病及肝肿瘤诊治起到重要作用.
王蒙, 副教授, 中国人民解放军第二军医大学附属东方肝胆外科医院肝外综合治疗一科
近年来关于肝再生与线粒体通透性转换的关系研究比较多, 目前对肝再生的分子机制, 尤其是肝再生启动和终止的机制仍不清楚.
Crumm等研究发现在肝再生的早期(0-48 h)线粒体ATP酶活性显著降低, 这可能提示自由基的增多抑制ATP酶活性, 从而诱导肝再生的启动.
本研究通过观察整个肝再生过程自由基和线粒体超微结构的变化来研究肝再生过程中线粒体通透性转换的作用.
本研究选题较好, 内容新颖, 学术价值较好.
编辑: 曹丽鸥 电编:何基才
| 1. | Fausto N, Campbell JS, Riehle KJ. Liver regeneration. Hepatology. 2006;43:S45-S53. [PubMed] [DOI] |
| 2. | Duchen MR. Roles of mitochondria in health and disease. Diabetes. 2004;53 Suppl 1:S96-S102. [PubMed] [DOI] |
| 3. | Hernández-Muñoz R, Sánchez-Sevilla L, Martínez-Gómez A, Dent MA. Changes in mitochondrial adenine nucleotides and in permeability transition in two models of rat liver regeneration. Hepatology. 2003;37:842-851. [PubMed] [DOI] |
| 4. | Zhong Z, Theruvath TP, Currin RT, Waldmeier PC, Lemasters JJ. NIM811, a mitochondrial permeability transition inhibitor, prevents mitochondrial depolarization in small-for-size rat liver grafts. Am J Transplant. 2007;7:1103-1111. [PubMed] [DOI] |
| 5. | Theruvath TP, Snoddy MC, Zhong Z, Lemasters JJ. Mitochondrial permeability transition in liver ischemia and reperfusion: role of c-Jun N-terminal kinase 2. Transplantation. 2008;85:1500-1504. [PubMed] [DOI] |
| 7. | Ferri D, Moro L, Mastrodonato M, Capuano F, Marra E, Liquori GE, Greco M. Ultrastructural zonal heterogeneity of hepatocytes and mitochondria within the hepatic acinus during liver regeneration after partial hepatectomy. Biol Cell. 2005;97:277-288. [PubMed] [DOI] |
| 8. | Armstrong JS, Yang H, Duan W, Whiteman M. Cytochrome bc(1) regulates the mitochondrial permeability transition by two distinct pathways. J Biol Chem. 2004;279:50420-50428. [PubMed] [DOI] |
| 9. | Kowaltowski AJ, Castilho RF, Vercesi AE. Mitochondrial permeability transition and oxidative stress. FEBS Lett. 2001;495:12-15. [PubMed] [DOI] |
| 10. | Yang S, Tan TM, Wee A, Leow CK. Mitochondrial respiratory function and antioxidant capacity in normal and cirrhotic livers following partial hepatectomy. Cell Mol Life Sci. 2004;61:220-229. [PubMed] [DOI] |
| 11. | Daoudaki M, Fouzas I, Stapf V, Ekmekcioglu C, Imvrios G, Andoniadis A, Demetriadou A, Thalhammer T. Cyclosporine a augments P-glycoprotein expression in the regenerating rat liver. Biol Pharm Bull. 2003;26:303-307. [PubMed] [DOI] |
| 12. | Higgins GM, Anderson RM. Experimental pathology of the liver: Restoration of the liver of the white rat following partial surgical removal. Arch Pathol. 1931;12:186-202. |
| 13. | Guerrieri F, Pellecchia G, Lopriore B, Papa S, Esterina Liquori G, Ferri D, Moro L, Marra E, Greco M. Changes in ultrastructure and the occurrence of permeability transition in mitochondria during rat liver regeneration. Eur J Biochem. 2002;269:3304-3312. [PubMed] [DOI] |
| 14. | Blanc P, Etienne H, Daujat M, Fabre I, Pichard L, Domergue J, Joyeux H, Fourtanier G, Maurel P. Antiproliferative effect of FK 506 and cyclosporine on adult human hepatocytes in culture. Transplant Proc. 1991;23:2821-2824. [PubMed] |
| 15. | Crumm S, Cofan M, Juskeviciute E, Hoek JB. Adenine nucleotide changes in the remnant liver: An early signal for regeneration after partial hepatectomy. Hepatology. 2008;48:898-908. [PubMed] [DOI] |
| 16. | Kim YI, Kobayashi M, Egashira T, Kawano K, Morimoto A, Kai T, Shimada T. Augmentation of hepatocyte proliferation by immunosuppressant pretherapy is associated with up-regulation of malondialdehyde production. Res Exp Med (Berl). 1993;193:337-345. [PubMed] [DOI] |
| 17. | Rezzani R, Buffoli B, Rodella L, Stacchiotti A, Bianchi R. Protective role of melatonin in cyclosporine A-induced oxidative stress in rat liver. Int Immunopharmacol. 2005;5:1397-1405. [PubMed] [DOI] |
| 18. | Kanno T, Sato EE, Muranaka S, Fujita H, Fujiwara T, Utsumi T, Inoue M, Utsumi K. Oxidative stress underlies the mechanism for Ca(2+)-induced permeability transition of mitochondria. Free Radic Res. 2004;38:27-35. [PubMed] [DOI] |
| 19. | Lemasters JJ, Theruvath TP, Zhong Z, Nieminen AL. Mitochondrial calcium and the permeability transition in cell death. Biochim Biophys Acta. 2009;1787:1395-1401. [PubMed] |