修回日期: 2010-06-16
接受日期: 2010-06-28
在线出版日期: 2010-07-28
目的: 探讨胃肠道间质瘤(gastrointestinal stromal tumors, GIST)的临床诊断、治疗方式及预后因素.
方法: 回顾性分析华中科技大学同济医学院附属协和医院普外科2002-01/2008-10收治的GIST患者67例的临床病理及随访资料, 采用Kaplan-meier法比较不同因素对生存率的影响, 并用Cox多因素回归分析评价其预后.
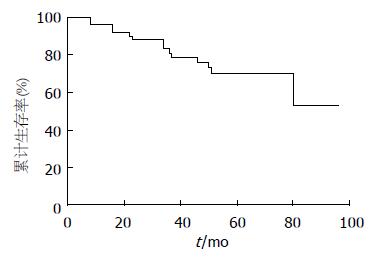
结果: 间质瘤67例, 位于胃31例、小肠23例、直肠7例、胃肠道外6例. 免疫组织化学检测CD117分子阳性率为97.0%, CD34分子阳性率为85.1%. 所有随访患者53例其1年、3年、5年生存率分别为96.2%、81.1%、70.5%. 单因素分析显示美国国立卫生研究院(national institute of health, NIH)2008年关于GIST的危险度分级与生存率有密切关系(P<0.05). 高风险组中甲磺酸伊马替尼辅助治疗者较单纯手术治疗者疗效显著提高(P<0.05). 多因素分析显示危险分级和甲磺酸伊马替尼治疗是影响预后的因素.
结论: GIST的NIH危险度分级和甲磺酸伊马替尼辅助治疗与患者术后生存率密切相关. 肿瘤手术后复发主要发生于高风险组, 高风险组患者给予甲磺酸伊马替尼治疗可获得更大收益.
引文著录: 夏泽锋, 陈少飞, 陶凯雄, 蔡开琳, 帅晓明, 韩高雄, 王继亮, 杜寒松, 郑威强, 王国斌. 胃肠道间质瘤67例. 世界华人消化杂志 2010; 18(21): 2266-2270
Revised: June 16, 2010
Accepted: June 28, 2010
Published online: July 28, 2010
AIM: To investigate the clinical characteristics of and prognostic factors for gastrointestinal stromal tumors (GIST).
METHODS: The clinicopathological data for 67 patients with gastrointestinal tumors treated between January 2002 and October 2008 at our hospital were analyzed retrospectively. All these patients were treated by surgery. Kaplan-Meier survival analysis and Cox regression model were used to evaluate the prognostic factors for GIST.
RESULTS: Of all the 67 cases, 31 tumors were located in the stomach, 23 in the small intestine, 7 in the rectum, and 6 were out of the gastrointestinal tract. The positive rates of CD117 and CD34 expression were 97.0% and 85.1%, respectively. The 1-, 3- and 5-year survival rates in 53 patients undergoing follow-up were 96.2%, 81.1% and 70.5%, respectively. Univariate analysis revealed that the risk classification of GIST published by National Institute of Health (NIH) in 2008 was associated with the survival rate in GIST patients. In the high-risk group, adjuvant imatinib mesylate therapy after surgery improved the prognosis significantly. Multivariate analysis using Cox hazard proportional model revealed that the risk classification and administration of imatinib mesylate could affect the prognosis of GIST patients.
CONCLUSION: The NIH risk classification for GIST and imatnib mesylate treatment are related to the survival rate of GIST patients. Surgical resection is still the main therapy for GIST though targeted therapy will play a more important role in future. As postoperative recurrence mainly occurs in the high-risk group, these GIST patients will get more benefit from adjuvant Gleevec treatment.
- Citation: Xia ZF, Chen SF, Tao KX, Cai KL, Shuai XM, Han GX, Wang JL, Du HS, Zheng WQ, Wang GB. Diagnosis, treatment and prognosis of gastrointestinal stromal tumors: an analysis of 67 cases. Shijie Huaren Xiaohua Zazhi 2010; 18(21): 2266-2270
- URL: https://www.wjgnet.com/1009-3079/full/v18/i21/2266.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i21.2266
胃肠道间质瘤(gastrointestinal stromal tumors, GIST)是最为常见的胃肠道间叶组织来源的肿瘤, 年发病率约为1/10万-2/10万[1], 其概念由Mazur和Clark于1983年首次提出[2]. 近十余年来, 随着临床病理和分子生物学技术的发展, 对GIST的认识也更加深入[3]. 以甲磺酸伊马替尼(又称格列卫)为代表的分子靶向药物的应用, 标志着GIST的治疗已经进入了外科手术和分子靶向药物相结合的时代[4,5]. 但GIST症状隐匿, 难以早期诊断及治疗, 手术后易复发、转移, 预后因素尚未完全明确等问题仍困扰临床[6]. 甲磺酸伊马替尼等分子靶向药物由于诸多条件的限制, 尚未得到广泛应用, 如何使患者能从术后辅助化疗中得到最大收益也成为临床关注的焦点. 本研究回顾性分析华中科技大学同济医学院附属协和医院普通外科2002-01/2008-10收治的67例资料较为完整的GIST患者的临床病理资料, 结合随访结果进行分析, 旨在总结GIST的诊治经验, 探讨预后因素, 以期提高GIST的诊治水平, 为术后有选择地采用适当综合治疗提供参考.
67例GIST患者均经为初治, 原发并经手术治疗, 术后病理检查和免疫组织化学染色确诊. 其中男32例, 女35例, 男女性别比为1:1.1. 年龄28-76(平均年龄51.9±12.1)岁, 中位年龄53岁. 67例GIST原发部位分别为: 胃31例(46.3%), 小肠23例(34.3%), 结直肠7例(10.4%), 胃肠道外(网膜, 肠系膜)6例(9.0%). GIST患者首发症状为消化道出血者31例(46.3%), 依其病灶部位不同分别表现为呕血、黑便、血便或仅为单纯性贫血. 以腹部包块为主要表现者15例(22.4%), 腹痛6例(9.0%), 出现腹胀、停止排便排气等肠梗阻症状6例(9.0%), 尿频尿急1例(1.4%), 食欲不振、乏力、呃逆等非特异性症状3例(4.5%), 另有4例无特殊症状在体检时偶然发现, 2例在其他手术术中意外发现.
1.2.1 影像学检查: 除2例在其他手术中意外发现、1例经剖腹探查明确病灶部位外, 其余GIST患者术前主要采用腹部B超、CT、电子胃镜、超声内镜、胶囊内镜、MRI、结肠镜、钡剂灌肠、数字减影血管造影等检查方法等明确肿瘤原发部位.
1.2.2 治疗: 本组所有67例GIST均实施手术治疗, 其中64例完全切除, 3例行姑息性切除. 31例胃部病变中, 11例行胃局部楔形切除术, 2例行肿瘤剥除术, 7例行胃大部切除术, 2例行全胃切除术, 联合脏器切除术9例. 发生于小肠的23例GIST中, 3例行单纯肿瘤切除术, 14例行肠段切除、端端吻合术, 5例行联合脏器切除, 1例因肿瘤广泛腹腔内转移仅行姑息性手术. 7例直肠GIST均行Miles术. 胃肠道外GIST共6例, 3例行肿瘤切除术, 1例联合左半结肠切除, 1例因肿瘤包绕肠系膜血管根部, 大量腹水, 无法完整切除, 行肿瘤活检术, 1例因广泛转移行姑息性手术.
1.2.3 肿瘤生物学行为判断标准: GIST生物学行为的评价主要参考2008年美国国立卫生研究院(national institutes of health, NIH)提出的针对原发可切除GIST的危险度分级(表1). 与Fletcher标准[7]不同, 新的分级增加了肿瘤原发部位和肿瘤破裂作为评价预后的指标.
| 肿瘤原发部位 | 肿瘤大小(cm) | 核分裂象(个/50HPF) | 分级 |
| 任何部位 | <2.0 | ≤5 | 极低度风险 |
| 任何部位 | 2.1-5.0 | ≤5 | 低度风险 |
| 胃 | 2.1-5.0 | >5 | 中度风险 |
| 任何部位 | <5.0 | 6-10 | 中度风险 |
| 胃 | 5.1-10.0 | ≤5 | 中度风险 |
| 肿瘤破裂 | 任何大小 | 任何计数 | 高度风险 |
| 任何部位 | >10 | 任何计数 | 高度风险 |
| 任何部位 | 任何大小 | >10 | 高度风险 |
| 任何部位 | >5.0 | >5 | 高度风险 |
| 非胃来源 | 2.1-5.0 | >5 | 高度风险 |
| 非胃来源 | 5.1-10.0 | ≤5 | 高度风险 |
1.2.4 随访: 采用病史索引的方法了解患者的诊疗情况, 所有病例均通过电话进行随访, 末次随访时间为2010-01-04, 随访内容包括患者生存、肿瘤复发情况, 甲磺酸伊马替尼辅助治疗情况及不良反应等. 生存时间定义为手术治疗之日至末次随访或死亡之间所经历的时间.
统计学处理 使用SPSS17.0软件对资料进行统计学分析. 计数资料的比较采取χ2检验, 单因素生存分析应用Kaplan-merie法(Log-rank检验), 多因素分析应用Cox回归分析, P<0.05为具有统计学意义.
67例GIST直径1.2-30.0 cm, 平均8.8 cm±6.2 cm. 显微镜下观察肿瘤主要由梭形细胞或上皮样细胞组成, 部分呈混合型. 部分体积较大的肿瘤含有出血、坏死、囊性变. 免疫组织化学染色显示, CD117阳性率为97.0%(65/67); CD34阳性率为85.1%(57/67); SMA阳性率为33.8%(22/65); S-100阳性率为6.2%(4/64). 所有清扫的淋巴结均未发现肿瘤转移.
67例GIST患者中, 1例患者围手术期死亡, 13例失访, 53例获得随访, 随访率80.3%. 随访时间8-96 mo, 平均47.4 mo. 64例肿瘤完全切除的患者, 按照NIH对于原发可切除GIST分级, 属于极低度风险4例, 低度风险16例, 中度风险12例, 高度风险32例.
获得随访的53例GIST, 手术均完整切除肿瘤, 15例手术治疗后出现复发、转移, 时间为手术后4-36 mo, 转移的部位涉及肝、腹腔、盆腔. 15例出现复发、转移的GIST中: 属于低度风险组1例, 中度风险1例, 高度风险13例. 不同危险度分级之间肿瘤复发率有显著性差异(表2).
| 项目 | 肿瘤复发、转移 | 总计 | P值 | |
| 阳性 | 阴性 | |||
| NIH分级 | 0.016 | |||
| 极低度风险 | 0 | 3 | 3 | |
| 低度风险 | 1 | 13 | 14 | |
| 中度风险 | 1 | 5 | 7 | |
| 高度风险 | 13 | 17 | 29 | |
12例患者在手术完整切除肿瘤后行甲磺酸伊马替尼辅助治疗, 治疗时间6-60 mo, 中位治疗时间为22 mo, 随访时间28-96 mo, 中位随访时间为57 mo. 12位患者属于低度风险1例, 中度风险2例, 高度风险9例. 2例死亡, 均属于高度风险组, 其余均存活. 各风险组中甲磺酸伊马替尼辅助治疗对肿瘤复发率及患者死亡率的影响无统计学意义. 所有患者甲磺酸伊马替尼剂量均为400 mg/d, 常见的不良反应有血细胞减少、恶性呕吐等消化道反应等, 均可耐受.
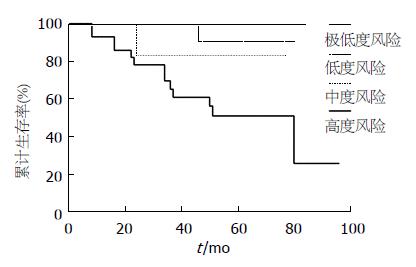
所有随访的53例患者中, 14例死亡, 1、3、5年总体生存率分别为96.2%、81.1%、70.5%, 总体生存曲线见图1. 单因素分析比较年龄、性别、NIH危险度分级、肿瘤坏死、CD117分子、CD34分子、腹腔镜手术方式、术后甲磺酸伊马替尼辅助治疗等对生存率的影响, 显示肿瘤的危险度分级分级对生存率的影响具有统计学意义(表3), 其生存曲线见图2. 危险度分级中属于高度风险的病例, 甲磺酸伊马替尼辅助治疗者与未辅助治疗者之间生存率的差异具有统计学意义(P<0.05).
| χ2值 | 自由度 | P值 | |
| 年龄 | 0.403 | 1 | 0.526 |
| 性别 | 0.180 | 1 | 0.672 |
| NIH危险度分级 | 8.966 | 3 | 0.030 |
| 肿瘤坏死 | 0.782 | 1 | 0.377 |
| CD117 | 0.154 | 1 | 0.695 |
| CD34 | 1.212 | 1 | 0.271 |
| 腹腔镜手术 | 0.207 | 1 | 0.649 |
| 甲磺酸伊马替尼治疗 | 1.667 | 1 | 0.097 |
将上述各因素进行Cox回归分析, 分析结果显示NIH的危险度分级、甲磺酸伊马替尼辅助治疗是影响GIST预后的重要因素(表4).
| 变量 | 偏回归系数 | 自由度 | P值 | 风险比(HR) | HR95%可信区间 |
| 危险度分级 | 1.394 | 1 | 0.003 | 4.030 | 1.602-10.136 |
| 甲磺酸伊马替尼治疗 -2.050 | 1 | 0.023 | 0.129 | 0.022-0.753 |
GIST症状隐匿, 可发生于整个胃肠道, 本组胃GIST占46.3%, 小肠GIST占34.3%, 直肠和胃肠道外GIST占10.4%和9.0%, 与文献报道相似[8]. GIST临床表现多样, 主要取决于肿瘤的大小和所在部位. 消化道出血、腹痛不适、腹部包块是最常见的症状, 此外部分患者可有肠梗阻、进食哽咽、消瘦、乏力等非特异性表现. GIST临床表现的多样性, 给早期诊断带来了极大的困难. 本组患者肿瘤平均大小为8.8 cm, 大于国外报道的5-8 cm, 可能是患者发现、就诊不及时, 影响肿瘤进展有关.
GIST常见的临床表现多样且不典型, 使影像学检查在GIST诊断中扮演重要的角色. 但对于不同部位的GIST, 各种检查方法的敏感性不同. 本研究中胃GIST主要依赖于B超、胃镜、超声胃镜、钡餐等诊断, 尤其是超声胃镜, 对黏膜下病变的诊断有独特的优势, 14例患者接受超声胃镜检查, 其中8例术前明确GIST诊断, 确诊率显著高于其他诊断方法. 鉴于此临床上可将超声内镜作为鉴别黏膜下肿瘤的首选方法. CT对小肠、胃肠道外GIST的诊断有重要意义, 主要表现为向腔内或腔外突出的软组织肿块, 增强扫描多表现为均匀强化[9]. CT扫描还可以明确肿瘤与附近血管关系, 有助于术前评估手术风险、确定手术方式. 本组中1例患者肿瘤包绕肠系膜血管根部, 即通过CT检查于术前发现, 与术中所见相符. 上述各方法无优劣之分, 诊断上应结合临床表现, 根据病变可能所在的部位选取最简单、有效的辅助检查方法.
病理学检查, 尤其是免疫组织化学检查, 在GIST诊断和鉴别诊断中发挥着举足轻重的作用. CD117已成为GIST特征性标记[10], 本组患者中CD117阳性率为97.0%, GIST的另一标记CD34分子的阳性率达85.1%. 目前大多数GIST仍主要依靠这两项指标的阳性结果得到诊断.
GIST的预后因素一直是研究的热点之一, 本研究中单因素分析结果显示GIST的危险度分级为影响预后的因素; 多因素回归分析中, 危险度分级、甲磺酸伊马替尼辅助治疗对生存率有影响. NIH的危险度分级以肿瘤的大小和核分裂象计数为基础, 兼顾了肿瘤的原发部位和是否破裂等因素, 在评估GIST生物学行为上具有重要作用, 随着危险度升高, 患者的生存率显著下降. 多因素分析中危险度分级风险比高达4.030, 即分级每增高一级, 死亡风险是原来的4.030倍. 本研究中术后出现肿瘤复发、转移15例, 13例属于高风险组, 死亡病例也主要见于中、高度风险患者, 可见危险度分级是判断肿瘤生物学行为、评价预后的一项重要指标. 一般认为高度风险组GIST占20%-30%, 而本研究中高危者达50.0%, 可能与患者就诊较晚, 诊疗水平较低有关. 新的NIH分级与以往的Fletcher分级相比, 添加了肿瘤原发部位这一因素, Miettinen等[11]的研究也表明原发部位也是GIST独立的预后危险因素, 并得到了循证医学的支持, 胃与小肠GIST在基因表达水平上的差异也使其具有分子生物学基础. 此外, 肿瘤是否破裂对患者预后也有显著影响, 因为无论肿瘤的自发破裂还是手术中破裂均导致术后复发的风险增加. 值得指出的是, 甲磺酸伊马替尼在多因素分析中成为明显的保护因素, 风险比为0.129, 即使用甲磺酸伊马替尼治疗者死亡风险降低近8倍.
外科手术切除目前仍是GIST最有效的治疗方法, 手术原则是尽量争取R0切除. 由于GIST极少发生淋巴结转移, 因此除有明确淋巴结转移征象外, 不常规行淋巴结清扫[12]. 手术后复发是GIST治疗面临的一个主要问题, 约50%患者在手术治疗后复发. 本研究中15例患者术后出现复发、转移, 转移的部位涉及肝、腹腔、盆腔. NIH危险度分级属于中、高风险组的患者复发率明显高于其他组. 因此对中高风险组患者及时复查, 尽早发现肿瘤复发, 并采取适当的治疗措施, 是提高GIST患者生存率的关键. 复发GIST的治疗也是临床上的难点, 一般认为对于复发的患者, 病灶可以手术切除者仍以手术切除为首选治疗方法, 不适合手术切除的, 可考虑综合治疗. 甲磺酸伊马替尼治疗使肿瘤缩小后能手术切除者应尽量手术, 手术后继续分子靶向治疗, 防止复发[13,14].
GIST对传统的放疗及化疗均不敏感[15]. 近年来, 分子靶向药物甲磺酸伊马替尼已经成为转移、复发、不可切除GIST的一线治疗药物. 国际多中心, 随机、对照、双盲的临床试验ASOCOG Z9001的初步结果表明: 直径大于3 cm的GIST完整切除后甲磺酸伊马替尼辅助治疗能明显减少患者的复发率[16]. 越来越多的研究表明, 甲磺酸伊马替尼辅助治疗可提高复发和晚期GIST的治疗效果, 减少肿瘤复发. 因此甲磺酸伊马替尼治疗应主要针对危险度分级为中、高度风险者以及伴有其他高转移风险因素的患者, 这些患者能从中获得更大的收益. 北美医学协作组三期临床试验CALGB150105的研究结果表明甲磺酸伊马替尼治疗的效果还与kit的基因表型有关, 含有外显子11的治疗效果优于含有外显子及野生型GIST的治疗效果[17]. 甲磺酸伊马替尼使GIST的治疗进入了一个新的时代, 但目前仍存在诸多问题, 如甲磺酸伊马替尼治疗的剂量和最佳疗程, 甲磺酸伊马替尼原发性耐药和继发性耐药等, 仍需我们进一步的研究.
胃肠道间质瘤是最为常见的胃肠道间叶组织来源的肿瘤, 其表现多样, 术前诊断困难. CD117分子是胃肠道间质瘤相对特异性的分子标记. 酪氨酸激酶抑制剂-甲磺酸伊马替尼的应用使间质瘤的治疗进入了新的时代.
万军, 主任医师, 中国人民解放军解放军总医院南楼老年消化科; 陈钟, 主任医师, 南通大学附属医院普外科.
胃肠道间质瘤的生物学行为很难判定, 术后复发率极高. 虽然甲磺酸伊马替尼在间质瘤的治疗中取得了巨大的成功, 但随之出现的原发和继发性耐药及其可能的机制都是目前亟待解决的问题. 新型的酪氨酸激酶抑制剂的研发也是当务之急.
Silva等报道, 间质瘤细胞染色体的不稳定性导致的染色体片段的缺失或者添加也对患者的生存情况有明显影响. 其基因组的复杂度在多因素分析中也是患者预后的独立影响因素.
本文采用了2008年NIH关于原发可切除间质瘤的危险度分级评价肿瘤的生物学行为, 并进行预后分析. 该分级增加了肿瘤原发部位这一因素, 在肿瘤生物学行为的评价中更为准确可靠.
目前胃肠道间质瘤的大规模临床试验中, 基于临床病理资料的危险度分级仍多采用2002年提出的Fletcher分级方案. 该方案尚未纳入肿瘤部位以及肿瘤是否破裂等重要资料, 有可能对临床试验的结果产生比较大的影响. 2008年NIH分级与以往的Fletcher分级相比, 添加了肿瘤原发部位这一因素, 有分子生物学及循证医学两方面的证据, 得出的结果会更具意义.
本文选题新颖, 资料详尽, 结果可靠, 对临床有一定的参考价值.
编辑: 李军亮 电编:吴鹏朕
| 1. | Gold JS, Dematteo RP. Combined surgical and molecular therapy: the gastrointestinal stromal tumor model. Ann Surg. 2006;244:176-184. [PubMed] [DOI] |
| 2. | Mazur MT, Clark HB. Gastric stromal tumors. Reappraisal of histogenesis. Am J Surg Pathol. 1983;7:507-519. [PubMed] [DOI] |
| 3. | Hirota S, Isozaki K, Moriyama Y, Hashimoto K, Nishida T, Ishiguro S, Kawano K, Hanada M, Kurata A, Takeda M. Gain-of-function mutations of c-kit in human gastrointestinal stromal tumors. Science. 1998;279:577-580. [PubMed] [DOI] |
| 4. | Miettinen M, Lasota J. Gastrointestinal stromal tumors--definition, clinical, histological, immunohistochemical, and molecular genetic features and differential diagnosis. Virchows Arch. 2001;438:1-12. [PubMed] [DOI] |
| 6. | Kitamura Y. Gastrointestinal stromal tumors: past, present, and future. J Gastroenterol. 2008;43:499-508. [PubMed] [DOI] |
| 7. | Fletcher CD, Berman JJ, Corless C, Gorstein F, Lasota J, Longley BJ, Miettinen M, O'Leary TJ, Remotti H, Rubin BP. Diagnosis of gastrointestinal stromal tumors: a consensus approach. Int J Surg Pathol. 2002;10:81-89. [PubMed] [DOI] |
| 8. | Stamatakos M, Douzinas E, Stefanaki C, Safioleas P, Polyzou E, Levidou G, Safioleas M. Gastrointestinal stromal tumor. World J Surg Oncol. 2009;7:61. [PubMed] [DOI] |
| 9. | Gupta P, Tewari M, Shukla HS. Gastrointestinal stromal tumor. Surg Oncol. 2008;17:129-138. [PubMed] [DOI] |
| 10. | Hasegawa T, Matsuno Y, Shimoda T, Hirohashi S. Gastrointestinal stromal tumor: consistent CD117 immunostaining for diagnosis, and prognostic classification based on tumor size and MIB-1 grade. Hum Pathol. 2002;33:669-676. [PubMed] [DOI] |
| 11. | Miettinen M, Lasota J. Gastrointestinal stromal tumors: review on morphology, molecular pathology, prognosis, and differential diagnosis. Arch Pathol Lab Med. 2006;130:1466-1478. [PubMed] |
| 13. | Andtbacka RH, Ng CS, Scaife CL, Cormier JN, Hunt KK, Pisters PW, Pollock RE, Benjamin RS, Burgess MA, Chen LL. Surgical resection of gastrointestinal stromal tumors after treatment with imatinib. Ann Surg Oncol. 2007;14:14-24. [PubMed] [DOI] |
| 14. | Seshadri RA, Rajendranath R. Neoadjuvant imatinib in locally advanced gastrointestinal stromal tumors. J Cancer Res Ther. 2009;5:267-271. [PubMed] [DOI] |
| 15. | Miettinen M, Sobin LH, Lasota J. Gastrointestinal stromal tumors of the stomach: a clinicopathologic, immunohistochemical, and molecular genetic study of 1765 cases with long-term follow-up. Am J Surg Pathol. 2005;29:52-68. [PubMed] [DOI] |
| 16. | 詹 文华, 王 鹏志, 邵 永孚, 伍 晓汀, 顾 晋, 李 荣, 万 德森, 丁 克峰, 师 英强, 丁 吉人. 伊马替尼术后辅助治疗胃肠间质瘤的多中心前瞻性临床试验中期报告. 中华胃肠外科杂志. 2006;9:383-387. |
| 17. | Heinrich MC, Owzar K, Corless CL, Hollis D, Borden EC, Fletcher CD, Ryan CW, von Mehren M, Blanke CD, Rankin C. Correlation of kinase genotype and clinical outcome in the North American Intergroup Phase III Trial of imatinib mesylate for treatment of advanced gastrointestinal stromal tumor: CALGB 150105 Study by Cancer and Leukemia Group B and Southwest Oncology Group. J Clin Oncol. 2008;26:5360-536. [PubMed] [DOI] |