修回日期: 2010-06-17
接受日期: 2010-06-22
在线出版日期: 2010-07-28
目的: 检测临床结肠癌组织标本中UCP2的表达及分布, 并分析其与临床病理学改变间的关系及其临床意义.
方法: 免疫组织化学方法检测结肠癌患者体内结肠腺瘤, 结肠增生性息肉及正常结肠组织中UCP2的分布, 定量PCR及Western blot方法检测癌旁及结肠癌组织中UCP2的表达, 并分析UCP2的表达情况与临床病理学间的关系及临床意义.
结果: UCP2 mRNA在肿瘤组织中的表达量约是癌旁组织的4倍, UCP2蛋白在肿瘤组织中的表达量约是癌旁组织的3倍. UCP2主要在细胞质中表达, 在正常结肠黏膜组织中几乎无表达. 在结肠癌组织中癌细胞胞质呈均一棕黄色, 阳性染色率高且强, UCP2在结肠癌组织中的阳性表达率达85.9%. 其在结肠腺瘤组织中也有一定量的表达, 阳性染色率55%, 增生性息肉阳性染色率为20%. UCP2的表达量在临床分为Ⅲ和Ⅳ期的结肠癌组织中明显高于I和II期, UCP2在有转移患者中的阳性表达率高于无转移患者.
结论: UCP2在人结肠癌组织中高表达, UCP2的表达情况与肿瘤的转移及临床分期有关.
引文著录: 蒯筱漪, 李正阳, 张红杰. 线粒体解偶联蛋白2在结肠癌中的表达及其临床意义. 世界华人消化杂志 2010; 18(21): 2202-2208
Revised: June 17, 2010
Accepted: June 22, 2010
Published online: July 28, 2010
AIM: To detect the distribution and expression of uncoupling protein 2 (UCP2) and to analyze its relationship with clinicopathological parameters in colon cancer.
METHODS: The distribution of UCP2 in colon cancer, colon adenoma, colon hyperplastic polyps and normal colon tissue was detected by immunohistochemistry. The expression of UCP2 mRNA and protein in colon cancer and tumor-adjacent normal tissue was detected by quantitative RT-PCR and Western blot, respectively. The relationship between UCP2 expression and clinicopathological parameters in colon cancer was then analyzed.
RESULTS: Quantitative RT-PCR and Western blot analyses showed that the expression levels of UCP2 mRNA and protein in cancer tissue were about 4- and 3-fold higher than those in tumor-adjacent normal colon tissue, respectively. UCP2 was mainly localized in the cytoplasm compartment in cancer tissue, but was almost undetectable in normal colon mucosa. The positive rates of UCP2 expression in colon adenocarcinoma, colon adenoma and hyperplastic colonic polyps were 85.9%, 55% and 20%, respectively. The expression level of UCP2 in patients with stage III/IV colon cancer was significantly higher than that in patients with stage I/ II disease. The positive rate of UCP2 expression was higher in colon cancer patients with metastasis than in those without metastasis.
CONCLUSION: The expression level of UCP2 is higher in colon cancer than in normal colon tissue. UCP2 may be involved in tumor progression and metastasis in colon cancer.
- Citation: Kuai XY, Li ZY, Zhang HJ. Clinical significance of mitochondrial uncoupling protein 2 expression in colon cancer. Shijie Huaren Xiaohua Zazhi 2010; 18(21): 2202-2208
- URL: https://www.wjgnet.com/1009-3079/full/v18/i21/2202.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i21.2202
结肠癌是威胁人类健康的恶性肿瘤之一, 在发达国家结肠癌已成为死亡率位居第2位的恶性肿瘤, 近年我国随着人们生活水平的提高和饮食结构的改变, 结肠癌的发病率有明显上升趋势, 尤其经济较发达的沿海城市和东部地区, 结肠癌在我国大部分地区已经成为发病率上升最快的恶性肿瘤之一[1,2]. 目前结肠癌的病因及发病机制尚不完全明确. 在研究细胞核中抑癌基因、原癌基因的变化等方面, 人类取得了很大的成就, 但仍有些问题不能解释, 促使学者们寻找细胞核外的促癌或抑癌因素. 近期的研究表明线粒体的功能障碍与肿瘤的发生发展有关. 解偶联蛋白2(uncoupling protein-2, UCP2)是线粒体内膜蛋白, 具有负调节活性氧簇(reactive oxygen species, ROS)的产生作用[3]. 有研究表明UCP2过表达与肿瘤适应性机制的形成有关. 肿瘤细胞适应性机制包括对细胞生长抑制的抵抗及细胞凋亡的逃逸, 而这些事件的发生与细胞处于氧化应激状态有关[4,5]. Horimoto等[6]应用免疫组织化学技术对结肠腺癌、绒毛管状腺瘤、增生性息肉组织标本进行检测发现腺癌阳性染色86.0%、腺瘤58.8%、增生性息肉11.1%, 结肠癌组织中UCP2表达明显高于癌旁组织, UCP2在肠上皮细胞由良性到恶性的转化过程中可能发挥了作用. 然而目前UCP2在结肠癌的发生发展中的作用尚不明确, 结肠癌组织中UCP2的高表达与临床病理学特征及预后又有着怎样的联系? 这是我们关注的问题. 因此, 我们对临床结肠癌组织标本中UCP2的表达进行了检测, 并分析其与临床病理学改变间的关系及其临床意义.
15对结肠癌组织标本来自南京医科大学第一附属医院外科手术标本, 包括癌组织和癌旁正常组织(距病变5 cm以上, 病理证实无肿瘤细胞浸润). 另选取增生性息肉10例(年龄34-72, 平均56.2岁)、正常结肠组织10例(年龄32-71岁, 平均50.2岁), 绒毛管状腺瘤20例(年龄28-76岁, 平均59.4岁)、78例结肠癌患者(包括前面15例结肠癌)组织切片行免疫组织化学检测UCP2的表达. 78例结肠癌患者平均年龄60.7(年龄范围31-78)岁. 在78例结肠癌患者中, 女33例(占总例数42.3%)男45例(占总例数57.7%), 年龄大于60岁42例(占总例数53.8%), 小于60岁36例(占总例数46.2%); 按肿瘤初发生长的部位, 左半结肠癌44例(占总病例的56.4%), 右半结肠34例(占总病例43.6%); 按临床分期, Ⅰ期有10例(占总病例数12.82%), Ⅱ期17例(占总病例数21.79%), Ⅲ期37例(占总病例数47.44%), Ⅳ期14例(占总病例数17.95%); 按肿瘤的分化程度, 肿瘤分化良好16例(占总病例数20.51%), 肿瘤分化中度38例(占总病例数48.72%), 肿瘤分化程度为重度24例(占总病例数30.77%).
RNA抽提试剂盒(TRIzol Reagent, Cat. No. 15596-018购自Invitrogen); 逆转录试剂盒来自Promerga公司; 实时定量PCR引物和TaqMan荧光探针由上海闪晶公司设计与合成. UCP2引物序列: R: 5'-TCAGAATGGTGCCCATCACA-3'; F: 5'-CCGGTTACAGATCCAAGGAGAA-3'. GAPDH引物序列: R: 5'-ACCCTGTTGCTGTAGCCA-3'; F: 5'-CCACTCCTCCACCTTTGAC-3. 兔抗人UCP2多克隆抗体(LS-C41270, 购自LifeSpan BioSciences); UCP2抗体(C-20, sc6525, Santa Cruz biotechnology, inc, USA)及细胞色素C(cytochrome C, 6H2, sc-13561, Santa Cruz biotechnology, inc, USA); 辣根过氧化物酶(HRP)标记的羊抗兔二抗购自美国Santa Cruz公司. SP试剂盒购自福建迈新公司; DAB显色剂购自武汉博士德公司; 定量PCR仪(ABI Prism 7300, Applied Biosystems, Foster City, CA, USA); 线粒体蛋白提取试剂盒; BCA蛋白分析试剂盒(Pierce, Rockford, USA); PBS缓冲液(pH7.2-7.4); 0.01 mol/L柠檬酸盐缓冲液; 1 mol/L的TBS缓冲液(pH8.0); 3%甲醇-H2O2溶液; 封裱剂.
1.2.1 免疫组织化学检测结肠组织中UCP2分布与表达[6,7]: 常规脱蜡和水化后PBS洗片; 滴加3% H2O2在TMA上, 室温静置10 min后PBS洗; 抗原修复10 min; PBS洗片后滴加UCP2抗体50 μL(按1:70 V/V, 在稀释液中加入0.05% Tween), 4 ℃过夜; 第2天室温平衡, PBS洗片后滴加二抗(1:1 500, V/V)50 μL, 37 ℃ 1 h; PBS洗片, DAB显色, 自来水冲洗10 min, 苏木素复染40 s; 常规洗片、脱水、透明、封片, 进行镜检. 每次染色同时设置阴性对照片子. 免疫组织化学结果判断标准: 光学显微镜高倍镜下, 以棕色颗粒染色出现于胞质者为阳性细胞, 每例随机观察5个高倍视野, 每个视野100个细胞, 计算阳性细胞百分数. 阳性细胞<15%计为阴性, 阳性细胞≥15%计为阳性. 按染色强度分阴性(0), 轻度阳性(+1), 中度(+2), 重度(+3).
1.2.2 定量PCR检测结肠癌及癌旁组织中UCP2 mRNA的表达[6,8,9]: (1)以TRIzol试剂提取结肠癌、癌旁组织、结肠腺瘤、息肉及正常结肠组织标本总RNA, 提取方法按说明书进行; (2)cDNA的逆转录; (3)定量PCR测定UCP2 mRNA: 选用ABI Prism 7300定量PCR仪, 进行定量PCR检测, UCP2引物和内参照GAPDH引物序列见材料部分. UCP2 gene: 每一反应体系: 10×Buffer 2 μL, Mg2+ 1.6 μL, dNTPs(2.5 mmol/L)1.6 μL, Primer-UCP2 0.8 μL; Taq酶0.2 μL; Probe1+2 0.14 μL, dH2O 12.73 μL, 每一反应体系: 20 μL. GAPDH: 10×Buffer 2 μL, Mg2+ 1.6 μL, dNTPs 1.6 μL, Primer GPDH 0.8 μL, Taq酶0.2 μL, Probe1+2 0.14 μL, dH2O 12.73 μL. 每一标本做3个复孔, 每一反应孔内加样品cDNA 1 μL. 扩增条件为95 ℃ 5 min, 接着40循环95 ℃ 30 s, 60 ℃, 1 min, 最后一循环为72 ℃ 3 min. 基因表达相对量 = 2Δct×100(Δct = ct目的基因-ct内参).
1.2.3 Western blot检测结肠癌及癌旁组织中UCP2的蛋白表达[6,9,10]: (1)蛋白的提取与定量: 采用线粒体蛋白提取试剂盒, 线粒体蛋白提取, 按说明书进行. 选取BCA-100蛋白定量测定试剂盒, 按说明书进行蛋白定量操作; (2)制胶与样品准备: 分离胶浓度选择12.5%; 取样品蛋白30-60 μg, 加入适量的6×loading Buffer, 100 ℃煮沸5 min; (3)电泳与转膜: 按每块胶20 mA恒流电泳; 按3 mA/cm2恒流电转70 min; (4)免疫标记及显影: UCP2(1:1 000, V/V), 细胞色素C(1:2 000), 4 ℃过夜; HRP标记的二抗(1: 2 000), 与膜共孵育1 h; (5)取出PVDF膜, 在脱色摇床上用Washing Buffer洗3遍; 将ECL底物以1:20的比例稀释, 与膜共孵育90 s, 在膜上放一张X光片; 细胞色素C胶片浸泡30 s, UCP2浸泡1-2 min, 清水洗后放入定影液中, 待胶片变透明后清水洗后, 晾干, 排片.
统计学处理 实验数据以mean±SD表示. 各组间以χ2检验评估. UCP2表达肿瘤预后的危险因素相关分析选取Kaplan-Meier单因素及多因素危险模式分析. 线性回归和Pearson r值做相关性分析. P<0.05认为差异有统计学意义.
结肠癌组织UCP2 mRNA的表达高于癌旁正常结肠组织, 肿瘤组织中UCP2 mRNA的表达约是癌旁组织4倍, 具有统计学差异(表1).
| 患者编号 | 组织 | UCP2 mRNA相对量(2Δct×100) | T/P |
| 1 | T | 8.12 | 3.45 |
| P | 2.35 | ||
| 2 | T | 19.68 | 5.70 |
| P | 3.45 | ||
| 3 | T | 13.60 | 2.96 |
| P | 4.60 | ||
| 4 | T | 21.40 | 2.32 |
| P | 9.21 | ||
| 5 | T | 26.20 | 3.67 |
| P | 12.70 | ||
| 6 | T | 78.60 | 2.51 |
| P | 31.20 | ||
| 7 | T | 86.50 | 3.59 |
| P | 24.10 | ||
| 8 | T | 12.31 | 6.00 |
| P | 20.50 | ||
| 9 | T | 45.20 | 8.85 |
| P | 5.10 | ||
| 10 | T | 36.10 | 0.84 |
| P | 42.60 | ||
| 11 | T | 9.12 | 2.37 |
| P | 3.85 | ||
| 12 | T | 3.67 | 1.78 |
| P | 2.05 | ||
| 13 | T | 10.34 | 4.40 |
| P | 2.35 | ||
| 14 | T | 17.63 | 5.86 |
| P | 3.01 | ||
| 15 | T | 6.54 | 4.47 |
| P | 1.46 | ||
| 平均T/P比 | 3.92 |
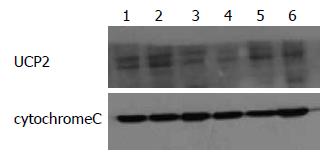
结肠癌组织UCP2的表达高于癌旁正常结肠组织, 肿瘤组织中UCP2的表达约是癌旁组织的3倍, 具有统计学差异(表2, 图1).
| 患者编号 | 组织 | UCP2蛋白量(Total Gray) | T/P |
| 1 | T | 2.10 | 2.14 |
| P | 0.98 | ||
| 2 | T | 4.16 | 5.33 |
| P | 0.78 | ||
| 3 | T | 2.45 | 2.82 |
| P | 0.87 | ||
| 4 | T | 5.14 | 4.25 |
| P | 1.21 | ||
| 5 | T | 3.02 | 3.70 |
| P | 0.82 | ||
| 6 | T | 6.24 | 2.70 |
| P | 2.31 | ||
| 7 | T | 5.55 | 5.00 |
| P | 1.09 | ||
| 8 | T | 8.27 | 3.93 |
| P | 2.10 | ||
| 9 | T | 9.43 | 8.65 |
| P | 1.08 | ||
| 10 | T | 1.96 | 0.78 |
| P | 2.51 | ||
| 11 | T | 3.15 | 3.80 |
| P | 0.83 | ||
| 12 | T | 7.12 | 2.13 |
| P | 3.34 | ||
| 13 | T | 4.51 | 3.72 |
| P | 1.21 | ||
| 14 | T | 7.12 | 5.45 |
| P | 1.31 | ||
| 15 | T | 2.54 | 4.17 |
| P | 0.62 | ||
| 平均T/P比 | 3.27 |
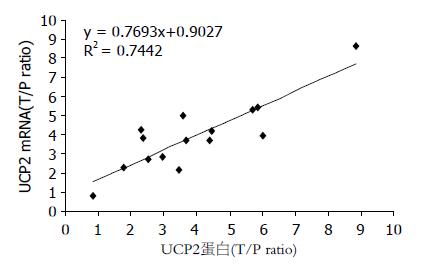
癌组织和癌旁组织UCP2蛋白表达与mRNA表达呈正相关性, 即在癌组织中UCP2的表达无论在mRNA水平及蛋白水平均有高表达(图2).
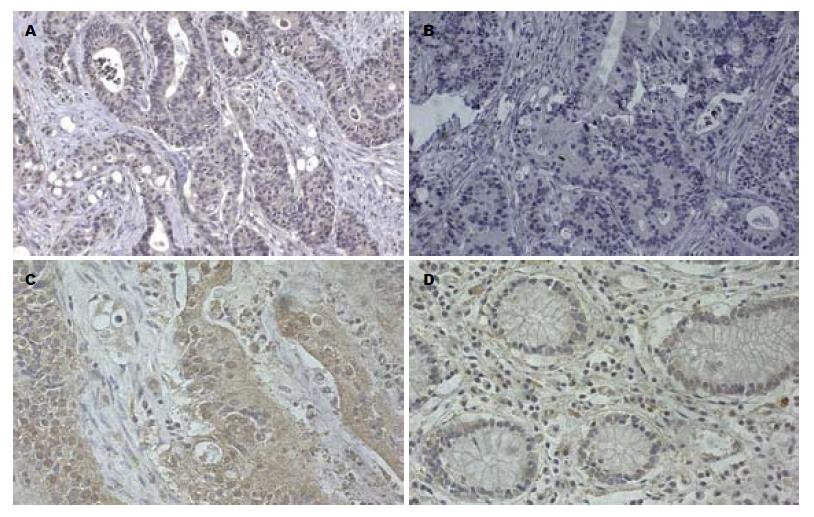
UCP2主要在细胞质中表达, 在正常结肠黏膜组织中几乎无表达, 在结肠癌组织中癌细胞胞质呈均一棕黄色染色(图3), 阳性染色率高且强, 在结肠癌组织中的阳性表达率达85.9%, 且其表达以染色呈中度和强阳性为主, 在结肠腺瘤组织中也有一定量的表达, 阳性染色率55%, UCP2在正常结肠组织, 结肠增生性息肉, 结肠腺瘤及结肠癌中的表达情况具体见表3.
| 分组 | n | 阴性 | 阳性 | 阳性表达率(%) | ||
| 轻度 | 中度 | 强阳性 | ||||
| 正常组织 | 10 | 10 | 0 | 0 | 0 | 0.0 |
| 增生性息肉 | 10 | 9 | 2 | 0 | 0 | 20.0 |
| 结肠腺瘤 | 20 | 9 | 3 | 6 | 2 | 55.0 |
| 结肠癌 | 78 | 10 | 15 | 30 | 22 | 85.9 |
UCP2的表达在临床分期为stageⅢ和Ⅳ期的结肠癌组织中明显高于处于stageⅠ+Ⅱ的患者, 差异有显著性, UCP2的表达似乎与分化状态无关, 此结果有待于扩大样本量的进一步研究(表4).
UCP2是解偶联蛋白家族之一, 相对分子质量为32 000-34 000 Da[11], 是一种线粒体内膜阴离子转运蛋白, 1997年两个研究小组几乎同时报道了一种和UCP1有很高同源性的蛋白质, 命名为UCP2[12]. UCP2基因有高度的保守性, 人和鼠类有95%同源序列, 哺乳动物和鱼类之间有85%同源序列. UCP2与UCP1有56%的同源氨基酸[13,14]. UCP2具有介导离子渗透, 影响ATP合成、参与体内脂代谢和调控细胞内ROS产生等作用. 有研究表明UCP2通过调控细胞内ROS的产生, 介导了应激状态下的脑部及心肌细胞损伤机制[15,16], UCP2升高可抑制ROS的产生, 保护细胞免受氧化应激损伤. UCP2也通过对ROS的调控, 介导了肿瘤细胞的适应性反应[14,17]. 国外有学者的研究结果显示UCP2在结肠癌组织中高表达[6], 这种高表达在结肠肿瘤中具有何种作用与肿瘤的临床病理特征间又有着怎样的关系呢?
我们通过定量PCR方法对来自15例结肠癌患者的手术配对标本(结肠癌组织和癌旁组织)的UCP2 mRNA表达进行测定, 结果显示结肠癌组织中UCP2 mRNA的表达明显高于癌旁正常组织, 肿瘤组织中UCP2 mRNA的表达大约是癌旁正常组织的4倍(T/P = 3.92, n = 15), 有显著性差异(P<0.05), 提示结肠癌组织存在UCP2 mRNA的表达上调. 我们同时采用Western blot方法检测癌与癌旁组织中UCP2蛋白表达, 发现在结肠癌组织中也存在UCP2蛋白的高表达. 这些结果提示结肠癌组织中的UCP2表达上调是发生在转录水平的, 此结果与Horimoto等[6]的报道一致.
我们同时用免疫组织化学的方法对正常结肠组织, 增生性息肉, 结肠腺瘤和结肠癌组织切片UCP2的表达进行了检测, 发现UCP2表达在结肠癌及腺瘤组织中有高表达(阳性表达率分别为: 85.9%和55%), 而在增生性息肉表达率20%, 且细胞阳性染色为轻度染色阳性, 正常结肠组织中几乎无阳性染色, 从正常结肠组织到结肠上皮细胞的增生到肿瘤性病变中UCP2的表达逐渐增多, 这一结果与Horimoto[6]等的研究结果是一致的, 提示UCP2可能在肿瘤的发生发展中起到一定的作用, 参与了肿瘤的形成. 我们对78例结肠癌患者的临床病理改变与UCP2的表达做检测分析, 发现结肠癌Ⅲ期和Ⅳ期患者的结肠癌组织中UCP2表达率明显高于Ⅰ期和Ⅱ期的患者, 不同临床病理分期患者的结肠癌组织中UCP2表达的测定分析显示其结肠癌组织中UCP2的表达随着肿瘤从Ⅰ期和Ⅱ期到Ⅲ期到Ⅳ期, 其表达逐渐增加(Ⅰ期和Ⅱ期结肠癌组织中UCP2阳性表达率57.1%, Ⅲ期阳性表达率70.6%, Ⅳ期为83.3%), 提示UCP2的表达可能与肿瘤分期有关. 从我们对78例结肠癌患者的结肠组织切片的检测结果看, UCP2的表达似乎与肿瘤组织的分化程度无关, 由于我们的样本数不够大, 有待于扩大样本数, 做进一步的研究. 从肿瘤转移的相关因素分析看, UCP2的高表达与转移相关, 肿瘤转移与组织分化程度有关.
有关UCP2在肿瘤中的研究目前甚少, 现有的实验研究资料在某种程度上尚有矛盾的地方. 给予结肠癌Lovo细胞系以照射处理后其UCP2的表达较未照射的细胞有升高[18], 来自DNA芯片的一项结果提示, 给予凋亡敏感的淋巴瘤细胞系以照射处理后UCP2的转录量高于凋亡抵抗细胞[19]. 这些研究结果提示UCP2所致的线粒体膜电位的减低, 可激活细胞死亡通路. 而最近有关UCP2的研究结果, 他们的研究发现, 对药物抵抗的多种肿瘤细胞系都有着UCP2的高表达及低线粒体膜电位, 他们的研究提示, UCP2介导了肿瘤细胞适应性反应, 避免了ROS介导的细胞凋亡[20].
总之, 来自国外的报道和我们的研究均提示UCP2在人结肠癌组织中高表达, 这种表达与肿瘤的分期有关. 肿瘤细胞可能利用UCP2发挥其代谢适应性, 避免ROS介导的细胞凋亡. 在非肿瘤细胞中UCP2可以作为机体的适应性调节因素, 避免氧化应激对细胞的损害, UCP2成为细胞保护因素[14,17]. 在肿瘤细胞中UCP2的升高, 可以使肿瘤细胞避免药物、缺氧等不利环境的刺激, 适应性存活的结果是使肿瘤产生耐药性[21,22], 有关UCP2在结肠癌中的作用及其作用机制有待进一步研究.
结肠癌是威胁人类健康的恶性肿瘤之一, 在发达国家结肠癌已成为死亡率位居第2位的恶性肿瘤, 在我国大部分地区结直肠癌已成为发病率上升最快的恶性肿瘤之一. 目前其病因及发病机制尚不完全明确. 近期的研究表明线粒体的功能障碍与肿瘤的发生发展有关. 解偶联蛋白2是线粒体内膜蛋白, 有研究表明其过表达与肿瘤适应性机制的形成有关.
杜雅菊, 主任医师, 哈尔滨医科大学附属第二医院消化内科.
在研究结肠癌病因及发病机制领域中, 目前, 人们对细胞核中的抑癌基因, 原癌基因变化等方面的研究取得了很大的成就, 但仍有些问题不能解释, 促使学者们寻找细胞核外的促癌或抑癌因素.
目前有关UCP2在肿瘤中的研究甚少. 有研究结果提示UCP2所致的线粒体膜电位的减低, 可激活细胞死亡通路. 而最近又有研究结果提示UCP2通过对ROS调控, 介导了肿瘤细胞适应性反应, 这种适应性反应的形成可能与其参与Warburg效应有关. 来自国外的报道和本课题组的研究均提示UCP2在人结肠癌组织中高表达.
UCP2在结肠癌中高表达, 然而目前UCP2在结肠癌的发生发展中的作用尚不明确, 结肠癌组织中UCP2的高表达与临床病理学特征及预后有着怎样的联系? 这是本研究关注的问题, 因此, 本课题组对临床结肠癌组织标本中UCP2的表达进行了检测, 并分析了其与临床病理学改变间的关系及UCP2的表达的临床意义.
在肿瘤细胞中UCP2的升高, 可以使肿瘤细胞避免药物、缺氧等不利环境的刺激, 最终使肿瘤产生抗性, 因而进一步开展有关UCP2在结肠癌中作用的研究, 为寻找新的治疗靶点提供了理论基础.
解偶联蛋白2(UCP2): 是一种线粒体内膜阴离子转运蛋白, 有研究表明其过表达与肿瘤适应性机制的形成有关. 在非肿瘤细胞中UCP2可以作为机体的适应性调节因素, 避免氧化应激对细胞的损害, UCP2成为细胞保护因素.
本文设计合理, 结论可靠, 具有一定的临床意义.
编辑: 李军亮 电编:吴鹏朕
| 1. | Tischoff I, Tannapfel A. [Epigenetic alterations in colorectal carcinomas and precancerous lesions]. Z Gastroenterol. 2008;46:1202-1206. [PubMed] [DOI] |
| 3. | Brand MD, Affourtit C, Esteves TC, Green K, Lambert AJ, Miwa S, Pakay JL, Parker N. Mitochondrial superoxide: production, biological effects, and activation of uncoupling proteins. Free Radic Biol Med. 2004;37:755-767. [PubMed] [DOI] |
| 4. | Benhar M, Engelberg D, Levitzki A. ROS, stress-activated kinases and stress signaling in cancer. EMBO Rep. 2002;3:420-425. [PubMed] [DOI] |
| 5. | Lenaz G. The mitochondrial production of reactive oxygen species: mechanisms and implications in human pathology. IUBMB Life. 2001;52:159-164. [PubMed] [DOI] |
| 6. | Horimoto M, Resnick MB, Konkin TA, Routhier J, Wands JR, Baffy G. Expression of uncoupling protein-2 in human colon cancer. Clin Cancer Res. 2004;10:6203-6207. [PubMed] [DOI] |
| 7. | Rashid A, Wu TC, Huang CC, Chen CH, Lin HZ, Yang SQ, Lee FY, Diehl AM. Mitochondrial proteins that regulate apoptosis and necrosis are induced in mouse fatty liver. Hepatology. 1999;29:1131-1138. [PubMed] [DOI] |
| 8. | Vogler S, Pahnke J, Rousset S, Ricquier D, Moch H, Miroux B, Ibrahim SM. Uncoupling protein 2 has protective function during experimental autoimmune encephalomyelitis. Am J Pathol. 2006;168:1570-1575. [PubMed] [DOI] |
| 9. | McLeod CJ, Aziz A, Hoyt RF Jr, McCoy JP Jr, Sack MN. Uncoupling proteins 2 and 3 function in concert to augment tolerance to cardiac ischemia. J Biol Chem. 2005;280:33470-33476. [PubMed] [DOI] |
| 10. | Horimoto M, Fülöp P, Derdák Z, Wands JR, Baffy G. Uncoupling protein-2 deficiency promotes oxidant stress and delays liver regeneration in mice. Hepatology. 2004;39:386-392. [PubMed] [DOI] |
| 11. | Saleh MC, Wheeler MB, Chan CB. Uncoupling protein-2: evidence for its function as a metabolic regulator. Diabetologia. 2002;45:174-187. [PubMed] [DOI] |
| 12. | Fleury C, Neverova M, Collins S, Raimbault S, Champigny O, Levi-Meyrueis C, Bouillaud F, Seldin MF, Surwit RS, Ricquier D. Uncoupling protein-2: a novel gene linked to obesity and hyperinsulinemia. Nat Genet. 1997;15:269-272. [PubMed] [DOI] |
| 13. | Borecký J, Maia IG, Arruda P. Mitochondrial uncoupling proteins in mammals and plants. Biosci Rep. 2001;21:201-212. [PubMed] [DOI] |
| 14. | Krauss S, Zhang CY, Lowell BB. The mitochondrial uncoupling-protein homologues. Nat Rev Mol Cell Biol. 2005;6:248-261. [PubMed] [DOI] |
| 15. | Arsenijevic D, Onuma H, Pecqueur C, Raimbault S, Manning BS, Miroux B, Couplan E, Alves-Guerra MC, Goubern M, Surwit R. Disruption of the uncoupling protein-2 gene in mice reveals a role in immunity and reactive oxygen species production. Nat Genet. 2000;26:435-439. [PubMed] [DOI] |
| 16. | Degasperi GR, Romanatto T, Denis RG, Araújo EP, Moraes JC, Inada NM, Vercesi AE, Velloso LA. UCP2 protects hypothalamic cells from TNF-alpha-induced damage. FEBS Lett. 2008;582:3103-3110. [PubMed] [DOI] |
| 17. | Finkel T, Holbrook NJ. Oxidants, oxidative stress and the biology of ageing. Nature. 2000;408:239-247. [PubMed] [DOI] |
| 18. | Sreekumar A, Nyati MK, Varambally S, Barrette TR, Ghosh D, Lawrence TS, Chinnaiyan AM. Profiling of cancer cells using protein microarrays: discovery of novel radiation-regulated proteins. Cancer Res. 2001;61:7585-7593. [PubMed] |
| 19. | Voehringer DW, Hirschberg DL, Xiao J, Lu Q, Roederer M, Lock CB, Herzenberg LA, Steinman L, Herzenberg LA. Gene microarray identification of redox and mitochondrial elements that control resistance or sensitivity to apoptosis. Proc Natl Acad Sci U S A. 2000;97:2680-2685. [DOI] |
| 20. | Harper ME, Antoniou A, Villalobos-Menuey E, Russo A, Trauger R, Vendemelio M, George A, Bartholomew R, Carlo D, Shaikh A. Characterization of a novel metabolic strategy used by drug-resistant tumor cells. FASEB J. 2002;16:1550-1557. [PubMed] [DOI] |
| 21. | Collins P, Jones C, Choudhury S, Damelin L, Hodgson H. Increased expression of uncoupling protein 2 in HepG2 cells attenuates oxidative damage and apoptosis. Liver Int. 2005;25:880-887. [PubMed] [DOI] |
| 22. | Derdak Z, Mark NM, Beldi G, Robson SC, Wands JR, Baffy G. The mitochondrial uncoupling protein-2 promotes chemoresistance in cancer cells. Cancer Res. 2008;68:2813-2819. [PubMed] [DOI] |