修回日期: 2010-06-04
接受日期: 2010-06-07
在线出版日期: 2010-07-18
目的: 研究蛋白酶激活受体-2(PAR-2)在原发性肝癌(PHC)中的蛋白表达水平, 并探讨其临床价值.
方法: 采用免疫组织化学和免疫荧光技术检测41例PHC患者癌组织和癌旁正常组织中PAR-2的蛋白表达水平.
结果: PAR-2在PHC组织及癌旁正常组织中均有不同程度的表达, 癌旁组织主要表现为核周胞质染色, 而肝癌组织呈弥漫性胞质染色. PHC与癌旁组织的表达差异具有显著性意义(92.67±8.53 vs 57.52±7.31, P<0.05); 不同组织学类型的肝癌表达不均衡, 肝细胞癌高于胆管细胞癌, 但差异无统计学意义(141.05±18.36 vs 112.10±10.05, P>0.05); 肿瘤转移者高于无转移者, 差异有统计学意义(167.83±8.91 vs 73.25±4.05, P<0.05).
结论: PAR-2在PHC中高表达; PAR-2的表达与PHC的发生和发展密切相关.
引文著录: 海鸥, 谢立群, 李轩, 郑艳敏, 周静. 蛋白酶激活受体-2在原发性肝癌组织中的表达. 世界华人消化杂志 2010; 18(20): 2159-2162
Revised: June 4, 2010
Accepted: June 7, 2010
Published online: July 18, 2010
AIM: To investigate the expression of proteinase-activated receptor-2 (PAR-2) protein in primary hepatic carcinoma (PHC) and to evaluate its clinical value.
METHODS: Immunohistochemistry and immunofluorescence were used to examine the expression of PAR-2 protein in cancer tissue and cancer-adjacent normal tissue from 41 patients with PHC.
RESULTS: The expression pattern of PAR-2 protein was different between cancer tissue and cancer-adjacent normal tissue. Perinuclear cytoplasmic staining was noted in normal tissue, while cancer tissue showed diffuse cytoplasmic staining. PAR-2 labeling index was significantly higher in cancer tissue than in normal tissue (92.67 ± 8.53 vs 57.52 ± 7.31, P < 0.05). Although PAR-2 labeling index was higher in hepatocarcinoma than in cholangiocarcinoma, no statistical significance was observed in PAR-2 labeling index between them (141.05 ± 18.36 vs 112.10 ± 10.05, P > 0.05). PAR-2 labeling index was significantly higher in patients with cancer metastasis than in those without cancer metastasis (167.83 ± 8.91 vs 73.25 ± 4.05, P < 0.05).
CONCLUSION: PAR-2 is over-expressed in PHC. PAR-2 expression is closely related with the development and progression of PHC.
- Citation: Hai O, Xie LQ, Li X, Zheng YM, Zhou J. Expression of proteinase-activated receptor-2 in primary hepatic carcinoma. Shijie Huaren Xiaohua Zazhi 2010; 18(20): 2159-2162
- URL: https://www.wjgnet.com/1009-3079/full/v18/i20/2159.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i20.2159
蛋白酶激活受体-2(proteinase activated receptor-2, PAR-2)是与G蛋白相偶联, 含有7个跨膜单位的蛋白酶激活受体家族成员之一, 其复杂多样的生理作用, 独特的激活与灭活方式, 以及在消化系统中的广泛分布, 特别是PAR-2与消化系肿瘤的关系备受关注. 基础研究证实PAR-2与恶性肿瘤的增殖、侵袭转移密切相关. 本实验旨对PAR-2在原发性肝癌(primary hepatic carcinoma, PHC)及癌旁组织中的表达态势进行研究, 以期明确PAR-2表达特点及与PHC临床病理因素的关系.
标本取自本院肝胆外科2000-2006年肝癌手术后存档的组织石蜡标本41例, 设为肝癌组; 同一标本距肿瘤边缘5 cm以外的肝脏组织设为对照组. 全部病例包括病史、症状指征、胸部X线检查、CT、部分病例经MRI进一步明确诊断. 均经病理证实. 根据1987年国际抗癌联盟(UICC)的肝癌TMN分期方案, 41例中, Ⅰ期3例, Ⅱ期9例, Ⅲ期13例, Ⅳ期16例; 依据细胞分型, 肝细胞癌39例, 胆管细胞癌2例, 其中男36例, 女5例, 平均年龄(57.6±3.0)岁, 所有患者术前均未进行任何抗肿瘤治疗. 羊多抗PAR-2(C-17):sc-8205为Santa Cruz公司产品, 购于北京中杉生物技术有限公司; FITC标记抗体、链霉菌抗生物素蛋白-过氧化物酶(SP)免疫组织化学试剂盒、3, 3-二氨基联苯胺(DAB)显色试剂, 购于福州迈新生物技术开发有限公司.
1.2.1 标本处理: 41例肝癌手术切除标本. 10%甲醛固定, 石蜡包埋, 常规切片和染色.
1.2.2 免疫组织化学染色: 切片常规脱蜡至水化, PBS液洗; 枸橼酸盐进行热抗原修复12 min; 0.3% H2O2封闭内源性过氧化酶10 min, 双蒸水清洗; 5%-10%正常山羊血清封闭; 滴加1:50 PAR-2羊多抗, 4 ℃冰箱过夜, PBS液洗; 滴加生物素标记二抗工作液, 室温孵育10 min, PBS液洗; 滴加辣根酶标记链霉卵白素工作液, 室温孵育10 min, PBS液洗; 滴加新鲜配置的DAB显色液, 室温下显色, 显微镜下控制显色时间(3-5 min), 蒸馏水洗; 苏木素复染、脱水、透明、中性树胶封片. 用PBS代替一抗作为阴性对照, 以已知的阳性反应组织作阳性对照.
1.2.3 免疫荧光染色: 4 μm厚石蜡切片, 经脱蜡、水化、热抗原修复、0.3% H2O2封闭内源性过氧化酶、血清封闭; 滴加一抗, 4 ℃冰箱过夜, PBS液洗; 滴加FITC荧光标记的二抗孵育(稀释比例1:10), 荧光显微镜观察PAR-2在组织中的表达.
1.2.4 结果判定: PAR-2阳性判定标准为免疫染色阳性物质呈棕黄色, 高倍镜下着色区呈颗粒状或弥漫性, 着色主要定位于胞质中, 胞核内有少量表达, 肿瘤间质未见表达. 用计算机图像分析系统随机选择等面积内(重复3次), 计数癌和癌旁组织PAR-2阳性细胞数, 用标记指数(labeling index, LI)百分比表示.
统计学处理 实验数据采用SPSS11.5统计软件处理, 测定值以mean±SD表示, 成组资料均数比较采用t检验, 检验水准α = 0.05, 并进行双侧检验. P<0.05表示差异有统计学意义.
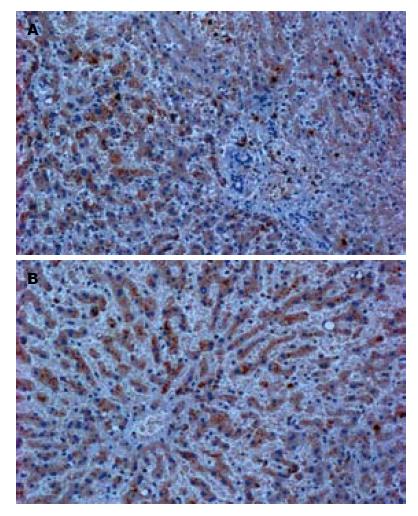
肝癌组织(图1A)和癌旁正常组织(图1B)中均可见PAR-2表达的阳性细胞, 棕黄色颗粒集中于胞质中; 肝癌组织呈弥漫性胞质染色, 癌旁正常组织巢状分布, 阳性表达减低, 呈核周胞质染色. PHC组织阳性细胞百分比为92.67±8.53, 癌旁阳性细胞百分比为57.52±7.31, 两组均数差异有统计学意义(t = 8.5891, P<0.05). PAR-2在患者不同年龄、性别、肝癌分型以及淋巴结转移中表达情况的比较结果见表1, PAR-2表达与不同患者年龄、性别、肿瘤病理分型无关(P>0.05), 但与淋巴结转移密切相关, 差异有统计学意义(P<0.05).
| 分类 | n | PAR-2标记指数(LI%) |
| 性别 | ||
| 男 | 36 | 101.23±8.60 |
| 女 | 5 | 76.54±4.65 |
| 年龄(岁) | ||
| <50 | 19 | 87.63±6.25 |
| ≥50 | 22 | 92.32±7.55 |
| 病理分型 | ||
| 肝细胞肝癌 | 39 | 141.05±18.36 |
| 胆管细胞癌 | 2 | 112.10±10.05 |
| 淋巴结转移 | ||
| 有 | 16 | 167.83±8.91a |
| 无 | 25 | 73.25±4.05 |
蛋白酶激活受体(proteinase activated receptors, PARs)是与G蛋白相偶联、含有7个跨膜单位的受体家族成员, 现已发现PAR-1、PAR-2、PAR-3、PAR-4四种亚型[1]. 人类编码PAR-2 的基因位于5q13染色体, 其中编码人类以及小鼠PAR-2的基因结构相似, 均为双外显子. 在蛋白水平, PAR-2是开放阅读框编码397个氨基酸的跨膜蛋白, 与小鼠PAR-2的同源性为83%, 与大鼠PAR-2的同源性为85%. 在分子水平, 这类受体均由细胞外区(N-末端和细胞外袢)、跨膜区(7个跨膜螺旋)及细胞内区(细胞内袢和C-末端)组成. 含7个跨膜螺旋是该类受体的共同结构特点. C-末端与受体失敏(desensitation)和信号转导有关; N-末端含有相应受体的蛋白酶裂解位点, 同时细胞外袢2在PAR-2激活中也起到关键作用[2]. PAR-2作为胰蛋白酶、类胰蛋白酶、凝血因子Ⅶa、Ⅹa和其他未知蛋白水解酶的受体, 易暴露于能使其激活的蛋白酶中, 是许多消化系腺体外分泌的直接调控者, 影响消化系统功能, 与消化系疾病关系密切, 是一类具有正负多功能的细胞因子受体, 可被人工合成的5-6个外源性氨基酸合成肽裂解, 激活后可产生多种生物学效应. 这类人工合成的小分子多肽被称为PAR-2激动剂. 通过对人工合成多肽氨基端和羧基端的结构修饰, 现已设计合成多种PAR-2激动剂(PAR-2-activated peptide, PAR-2-AP), 主要包括NH2-SLIGKV和tc-LIGRLO, 已被广泛应用于各项研究, 他们能够在体内外重复相应配体的所有作用, 部分结果已在PAR-2基因敲除的小鼠中得到证实[3]. PAR-2广泛分布于消化系统各种组织和细胞, 其中包括肿瘤细胞. 实验证实PAR-2的生物活性与肿瘤的发生发展密切相关, 具有促进炎症、抑制肿瘤细胞凋亡、促进肿瘤血管生长、增强肿瘤细胞侵袭能力等作用[4-8]. 我们前期体外实验将设计合成的PAR-2激动剂(2f-LIGRLO-NH2)作用于肝脏肿瘤细胞(HepG2), 发现PAR-2高表达的肿瘤细胞, 其细胞生长能力增强, 不仅能够促进凋亡抑制、增强促血管内皮细胞迁移能力, 而且能够明显增强基质金属蛋白酶-2(matrix metalloproteinase-2, MMP-2)、表皮生长因子受体(epidermal growth factor receptor, EGFR)、血管内皮生长因子(vascular endothelial growth factor, VEGF)等多种参与肿瘤生长及血管生成的相关因子表达. 应用PAR-2拮抗剂(LRGILS-NH2)则抑制肿瘤细胞的生长和转移.
镜下观察发现PHC组织中PAR-2阳性细胞表达量及表达强度高于癌旁正常组织. 说明PAR-2蛋白表达与PHC存在密切联系. 不同组织学类型的肝癌表达不均衡, 肝细胞癌略高于胆管细胞癌, 两者差异并无统计学意义, 然而PAR-2表达水平有随原发瘤分化程度高而阳性表达减低的趋势, 可能与不同细胞分型PHC的不同生物学特性、发展机制以及不同的信号通路有关; 分化较好的癌细胞与正常的肝脏细胞相似, PAR-2表达量少; 分化较差的癌细胞异型性明显, 常有巨核瘤细胞出现, PAR-2着色很强. 此外, 肿瘤细胞远处转移者显著高于无转移者. 进一步从不同角度证实了PAR-2对恶性肿瘤发生和进展的推动作用. 推测其促进机制可能在于: (1)胰蛋白酶裂解后激活PAR-2, 使细胞内Ca2+动员, 转活表皮生长因子受体(EGFR), 进而激活经典ras依赖的ERK1/2通路, ERK1/2移位于细胞核并激活核蛋白, 引起DNA复制、细胞增殖效应[9]; (2)胰蛋白酶激活PAR-2促进蛋白激酶C(PKC)依赖的MAP激酶级联反应, 促进Ca2+活动和肿瘤细胞的有丝分裂[10]; (3)PAR-2激活后与TF共同作用特异性上调IL-8的表达, 导致细胞迁移效果明显增强[11]; (4)PAR-2激活后可诱导Jun激活区域凝结蛋白1(Jun activation domain-binding protein 1, Jab1)的蛋白修饰作用, 使细胞骨架成份在细胞内重新分布, 以致膜表达蛋白被降解进入胞质[12]. PAR-2表达和在细胞内定位异常是否意味着肿瘤的恶性程度更高、侵袭力更强, 也更加容易出现淋巴结转移, 这一定论需要更为深入的探索. 上述依据有力的证实PAR-2与恶性肿瘤的侵袭转移密切相关, 因此, 对PAR-2的研究有助于筛选出一类新的有临床应用价值的肿瘤学标志物, 并有可能成为肿瘤治疗的新靶点.
PAR-2与消化系肿瘤的关系备受关注. 新近发现, PAR-2与肿瘤的增殖、生长、转移具有密切关系, 关于PAR-2对肿瘤的影响作用及其分子机制的研究也越来越多, 并取得了新的进展.
黄志勇, 教授, 华中科技大学同济医院普外科
PAR-2在肿瘤的增殖、生长、转移中起着关键作用, 基于对PAR-2相关的肿瘤治疗新靶点必将成为新的研究热点.
越来越多的研究表明, 在众多的肿瘤细胞中都有PAR-2表达, 且强度高于正常组织细胞, 学者们认为激活的PAR-2很可能通过下游的信号通路促进了肿瘤的增殖和转移.
本文选题较新, 结果可靠, 对研究PAR-2在肝癌组织上的表达及与肝癌患者临床病例特征的关系有重要意义.
编辑: 曹丽鸥 电编:何基才
| 1. | Kawabata A. [Physiological functions of protease-activated receptor-2]. Nippon Yakurigaku Zasshi. 2003;121:411-420. [PubMed] [DOI] |
| 2. | Cottrell GS, Amadesi S, Schmidlin F, Bunnett N. Protease-activated receptor 2: activation, signalling and function. Biochem Soc Trans. 2003;31:1191-1197. [PubMed] [DOI] |
| 3. | Vergnolle N. Clinical relevance of proteinase activated receptors (pars) in the gut. Gut. 2005;54:867-874. [PubMed] |
| 4. | Steinhoff M, Buddenkotte J, Shpacovitch V, Rattenholl A, Moormann C, Vergnolle N, Luger TA, Hollenberg MD. Proteinase-activated receptors: transducers of proteinase-mediated signaling in inflammation and immune response. Endocr Rev. 2005;26:1-43. [PubMed] [DOI] |
| 5. | Ossovskaya VS, Bunnett NW. Protease-activated receptors: contribution to physiology and disease. Physiol Rev. 2004;84:579-621. [PubMed] [DOI] |
| 6. | 胡 新红, 周 红, 王 婷. 蛋白酶激活受体1和2在结肠癌细胞的表达及其作用初探. 江苏大学学报(医学版). 2007;17:23-27. |
| 7. | Jahan I, Fujimoto J, Alam SM, Sato E, Sakaguchi H, Tamaya T. Role of protease activated receptor-2 in tumor advancement of ovarian cancers. Ann Oncol. 2007;18:1506-1512. [PubMed] [DOI] |
| 8. | Caruso R, Pallone F, Fina D, Gioia V, Peluso I, Caprioli F, Stolfi C, Perfetti A, Spagnoli LG, Palmieri G. Protease-activated receptor-2 activation in gastric cancer cells promotes epidermal growth factor receptor trans-activation and proliferation. Am J Pathol. 2006;169:268-278. [PubMed] [DOI] |
| 9. | DeFea KA, Zalevsky J, Thoma MS, Déry O, Mullins RD, Bunnett NW. beta-arrestin-dependent endocytosis of proteinase- activated receptor 2 is required for intracellular targeting of activated ERK1/2. J Cell Biol. 2000;148:1267-1281. [PubMed] [DOI] |
| 10. | van der Merwe JQ, Moreau F, MacNaughton WK. Protease-activated receptor-2 stimulates intestinal epithelial chloride transport through activation of PLC and selective PKC isoforms. Am J Physiol Gastrointest Liver Physiol. 2009;296:G1258-G1266. [PubMed] [DOI] |
| 11. | Schaffner F, Ruf W. Tissue factor and PAR2 signaling in the tumor microenvironment. Arterioscler Thromb Vasc Biol. 2009;29:1999-2004. [PubMed] [DOI] |
| 12. | Luo W, Wang Y, Hanck T, Stricker R, Reiser G. Jab1, a novel protease-activated receptor-2 (PAR-2)-interacting protein, is involved in PAR-2-induced activation of activator protein-1. J Biol Chem. 2006;281:7927-7936. [PubMed] [DOI] |