修回日期: 2010-05-17
接受日期: 2010-05-25
在线出版日期: 2010-07-18
目的: 探讨肝硬化患者骨髓CD34+造血干细胞的表达及意义.
方法: 行骨髓穿刺术, 收集31例肝硬化患者和15例健康对照的骨髓液, 流式细胞仪检测骨髓液CD34+细胞占单个核细胞比例, 并比较随肝脏储备功能不同的Child A、Child B、Child C级患者, 其骨髓CD34+细胞表达水平是否存在差异.
结果: 肝硬化患者和健康对照组骨髓CD34+细胞占单个核细胞的比例分别为6.30%和1.87%, 差异有统计学意义(t = 3.906, P<0.05). 随肝脏储备功能不同的Child A、Child B、Child C级患者, 其骨髓CD34+细胞表达率分别为7.01%±2.1%、4.58%±2.56%、7.72%±1.49%, 三者之间差异无统计学意义(F = 3.586, P>0.05).
结论: 肝硬化患者骨髓CD34+干细胞细胞增加, 随肝功能Child-Pugh分级不同CD34+干细胞表达无差异, CD34+增加可能对肝硬化的病情有积极的作用.
引文著录: 刘拉羊, 王顺达, 党双锁, 程延安, 周芙玲, 高宁, 贾晓黎, 张欣. 骨髓CD34+细胞在肝硬化患者中的表达及意义. 世界华人消化杂志 2010; 18(20): 2155-2158
Revised: May 17, 2010
Accepted: May 25, 2010
Published online: July 18, 2010
AIM: To analyze the significance of bone marrow CD34+ levels in cirrhotic patients.
METHODS: Bone marrow fluid was obtained from 31 cirrhotic patients and 15 healthy controls. The percentage of bone marrow CD34+ cells among mononuclear cells was detected by flow cytometry.
RESULTS: The percentage of bone marrow CD34+ cells among mononuclear cells was significantly higher in cirrhotic patients than in normal controls (6.30% vs 1.87%, t = 3.906, P < 0.05). The percentages of bone marrow CD34+ cells were not significantly different among patients with Child-Pugh A, B, and C cirrhosis (7.01 ± 2.1%, 4.58 ± 2.56% and 7.72 ± 1.49%, F = 3.586, P > 0.05).
CONCLUSION: The levels of bone marrow CD34+ cells increase in cirrhotic patients. Liver function grade is not correlated with bone marrow CD34+ cell levels in cirrhotic patients. Increased bone marrow CD34+ cells may contribute to the pathogenesis of cirrhosis.
- Citation: Liu LY, Wang SD, Dang SS, Cheng YA, Zhou FL, Gao N, Jia XL, Zhang X. Significance of bone marrow CD34+ cell levels in cirrhotic patients. Shijie Huaren Xiaohua Zazhi 2010; 18(20): 2155-2158
- URL: https://www.wjgnet.com/1009-3079/full/v18/i20/2155.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i20.2155
造血干细胞具有极高的自我更新能力, 多向分化重建长期造血的潜能以及修复组织损伤的能力. 因这些特殊的生物学特性, 造血干细胞在体内的表达对于处于病态的机体起着重要的作用. 肝硬化(hepatic cirrhosis)是多种慢性肝病的共同结果, 肝硬化病理情况下, 一方面表现为外周血三系细胞降低, 通常以血小板减少为主; 另一方面表现为肝脏肝细胞、胆管细胞受损. 因此, 本研究检测在肝硬化病理情况下骨髓CD34+细胞的表达并探讨其意义.
31例肝硬化患者均系在西安交通大学医学院第二附属医院肝病治疗中心住院的患者, 其中女14例, 男17例. 15例对照组来源于无血液系统疾病及肝脏疾患者群, 男9例, 女6例. 肝硬化患者均符合1995年全国第5次传染病和寄生虫病会议修订《病毒性肝炎防治》方案中肝炎肝硬化诊断标准. 排除非肝硬化原因引起的脾大、外周血减少症的患者, 如Budd-Chiari综合征、白血病等. 主要仪器和试剂: 流式细胞仪FACS Calibur(美国BD公司生产)、离心机(上海仪器厂生产)、肝功能生化检测仪(日立7170型全自动生化分析仪); CD34单克隆抗体、异硫氰酸荧光素标记CD34蛋白抗体(CD34/FITC)(北京博奥森生物技术有限公司)、红细胞裂解液(杭州博日科技有限公司)、PBS液等.
1.2.1 肝硬化肝脏损害严重程度: 应用Child-Pugh分级积分评估. 按肝性脑病、腹水、总胆红素、白蛋白、凝血酶原时间进行评分. A级5-6分, 肝功能较好, 为12例; B 级7-9分, 肝功能中等, 为11例; C级10-15分, 肝功能损害严重, 为8例.
1.2.2 流式细胞仪检测骨髓液CD34+的表达: 所有患者取髂后上棘为穿刺点行骨髓穿刺术抽取骨髓血3 mL, 骨髓液用肝素抗凝, 肝素钠用量为100 kU/L. FITC标记的CD34+单克隆抗体10 μL加入100 μL骨髓液. 样本置于常温下孵化30 min, 然后加入2 mL红细胞裂解液常温下反应10 min, 1 000 r/min离心后弃废液, PBS液洗细胞2次, 上机检测.
统计学处理 所有数据分析均应用SPSS17.0统计软件分析. 所得数据以mean±SD表示, 率的比较采用独立样本t检验; 多个率的比较采用单因素方差分析, P<0.05认为有统计学意义.
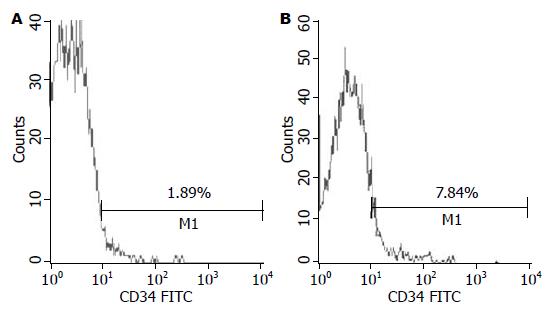
按照Milan法FITC染色检测肝炎肝硬化患者骨髓液CD34+细胞占单个核细胞的百分数, 流式细胞仪检测结果如图1所示.
骨髓液CD34+细胞占单个核细胞的比例在肝炎肝硬化组和对照组分别是1.87%±0.53%和6.30%±2.48%(t = 3.906, P<0.01).
对于肝硬化组, 在按Child-Pugh分级的A级、B级、C级三组中骨髓CD34+细胞占单个核细胞的比例分别是7.01%±2.10%、4.58%±2.56%和7.72%±1.49%(F = 3.586, P>0.05).
造血干细胞是人体造血组织中能自我更新, 又能分化产生各系血细胞的一类细胞, 同时具有多向分化和修复组织损伤的能力. CD34抗原是人们普遍认同的造血干/祖细胞的代表性表面标志[2]. 肝硬化作为临床一种常见的由不同病因引起的慢性、进行性、弥漫性肝病, 是多种慢性肝病的共同结果, 肝硬化失代偿期, 通常血小板计数减少[3]为主的外周血细胞减少. 同时, 肝硬化长时间的慢性肝损伤使得肝脏细胞和胆管细胞大量受损, 试验室检查表现为肝脏功能减低.
本课题研究表明, 在肝硬化时, 骨髓CD34+造血干细胞在单个核细胞的比例约为6.30%, 而正常人为1.87%. 这与文献所报道[4]的正常人骨髓低密度单个核细胞中CD34+细胞所占的比例(1%-4%)一致, 肝硬化组与对照组之间的差异有统计学意义(P<0.05). 可见, 与正常人比较肝硬化病理情况下骨髓CD34+细胞的数量是增加的.
骨髓内CD34+干细胞是多潜能造血干细胞, 他能够自我更新, 并且能分化成外周血中的所有细胞, 包括红细胞, 血小板, 中性粒细胞, 嗜酸/碱性粒细胞, 单核细胞和淋巴细胞[5]. 外周血细胞受损时, 机体必须不断地产生各类血细胞来补充丢失的细胞, 才能维持外周血细胞的相对恒定, 满足机体生理需要. 目前认为, 所有血细胞都来源于造血干细胞. 因此, 造血干细胞与血液疾病关系密切. CD34+细胞计数可用于临床上骨髓或外周血干细胞移植所采集干细胞数量的估计, 对于造血功能重建的预测以及评价骨髓造血情况有重要作用. Soligo等和Oriani等检测骨髓增生异常综合征(myelodysplastic syndrome, MDS)患者骨髓单个核细胞(BMMNC)中CD34+细胞比例发现, MDS-RA患者CD34+表达率无明显变化, 而MDS-RAEB患者中明显增高, 从而认为CD34+细胞的检测可能作为MDS预后的一个重要价值指标[6,7]. 肝硬化时外周血细胞减少, 而骨髓造血干细胞表达增加, 是否是由于外周血的减少而引起造血细胞增加并发育成血细胞从而补充肝硬化时受损的血细胞并不清楚. 但肝硬化状态下外周血细胞的祖细胞处于增生状态, 这时有利于补充外周血细胞的丢失. 因此, 肝硬化造血干细胞增加对补充外周血细胞有积极作用. 干细胞的另一重要特征是修复损伤组织的能力. 当组织受损时, 造血干细胞可以分化为相应的细胞来修复受损组织. 肝硬化病理情况下肝脏受损, 造血干细胞可分化为非造血谱系细胞, 例如肝卵圆细胞(hepatic oval cells, HOCs)、肝细胞和胆管细胞[8-10]从而修复受损肝脏. 造血干细胞修复肝脏, 首先是造血干细胞被SDF-1/CXCR4由骨髓动员到外周血, 由外周血到达受损肝脏[11,12]. 无论肝脏再生的机制如何, 造血干细胞向受损的肝脏移动起着重要的作用[13]. 因此, 我们猜测肝硬化时骨髓CD34+造血干细胞增加正是由于外周血细胞减少以及肝脏受损后造血干细胞受到动员后引起的.
但是我们发现随着肝脏功能Child-Pugh分级不同, 肝功能为A级、B级、C级的患者, 其骨髓CD34+细胞在单个核细胞所占的比例分别为7.01%、4.58%、7.72%, 三者之间差异无统计学意义(P>0.05). 这说明随着肝脏损伤程度不同, 骨髓CD34+细胞的表达无明显改变. 这也意味着随着肝硬化患者外周血细胞减少的加重和肝脏损害程度的加重, 骨髓CD34+细胞的数目并没有更加增多, 骨髓对于外周血细胞减少和肝脏损害的代偿能力受到了限制. 而至于A、B、C三级患者其骨髓CD34+细胞水平没有明显差异的原因, 值得进一步的研究.
肝硬化失代偿期, 一方面, 肝细胞大量受损; 另一方面, 外周血细胞减少. 此时骨髓造血干细胞可能参与了的外周血细胞减少的补偿以及受损的肝脏的修复. 因此, 肝硬化时骨髓CD34+造血干细胞表达增加对机体的恢复有积极的作用. 然而, 肝硬化患者虽有机体干细胞自我修复能力, 但由于引起肝硬化的病因未解除, 骨髓CD34+造血干细胞表达不再进一步增加, 最终肝硬化多数患者病情会进一步进展.
肝硬化处于失代偿期时, 并发的脾功能亢进症(hypersplenism, 简称脾亢)和血细胞减少互为因素, 相互影响, 是造成病情进展加快、加重的重要原因. 探讨肝硬化外周血细胞减少的成因对于阐明失代偿期肝硬化的发生机制意义重大.
钱林学, 教授, 首都医科大学附属北京友谊医院内科
CD34+细胞数可作为骨髓造血干/祖细胞数量检测的可靠指标. 本文试图通过流式细胞仪检测肝硬化患者骨髓液CD34+细胞数的变化, 初步研究肝硬化时骨髓的造血干细胞的状况对外周血细胞变化的影响.
Yao等报道CD34抗原是人们普遍认同的造血干/祖细胞的代表性表面标志.
本文首次研究发现在肝硬化时骨髓CD34+造血干细胞在单个核细胞的比例约为6.30%, 而正常人为1.87%. 提示肝硬化的情况下骨髓CD34+细胞的数量较正常人是增加的.
本实验研究发现在肝硬化这种病理状态下, 骨髓的造血干细胞也出现了代偿性增生, 检测CD34+对于判断骨髓的增生状态有意义. 对于在肝硬化时造血干细胞受何种因素调控的机制有待进一步研究.
本文选题较新, 设计合理, 对临床医师有较好的参考价值.
编辑: 曹丽鸥 电编:何基才
| 2. | Yao CL, Chu IM, Hsieh TB, Hwang SM. A systematic strategy to optimize ex vivo expansion medium for human hematopoietic stem cells derived from umbilical cord blood mononuclear cells. Exp Hematol. 2004;32:720-727. [PubMed] [DOI] |
| 3. | Toghill PJ, Green S. Splenic influences on the blood in chronic liver disease. Q J Med. 1979;48:613-625. [PubMed] |
| 4. | Silvestri F, Banavali S, Baccarani M, Preisler HD. The CD34 hemopoietic progenitor cell associated antigen: biology and clinical applications. Haematologica. 1992;77:265-273. [PubMed] |
| 5. | Shizuru JA, Negrin RS, Weissman IL. Hematopoietic stem and progenitor cells: clinical and preclinical regeneration of the hematolymphoid system. Annu Rev Med. 2005;56:509-538. [PubMed] [DOI] |
| 6. | Soligo DA, Oriani A, Annaloro C, Cortelezzi A, Calori R, Pozzoli E, Nosella D, Orazi A, Deliliers GL. CD34 immunohistochemistry of bone marrow biopsies: prognostic significance in primary myelodysplastic syndromes. Am J Hematol. 1994;46:9-17. [PubMed] [DOI] |
| 7. | Oriani A, Annaloro C, Soligo D, Pozzoli E, Cortelezzi A, Lambertenghi Deliliers G. Bone marrow histology and CD34 immunostaining in the prognostic evaluation of primary myelodysplastic syndromes. Br J Haematol. 1996;92:360-364. [PubMed] [DOI] |
| 8. | Petersen BE, Bowen WC, Patrene KD, Mars WM, Sullivan AK, Murase N, Boggs SS, Greenberger JS, Goff JP. Bone marrow as a potential source of hepatic oval cells. Science. 1999;284:1168-1170. [PubMed] [DOI] |
| 9. | Alison MR, Poulsom R, Jeffery R, Dhillon AP, Quaglia A, Jacob J, Novelli M, Prentice G, Williamson J, Wright NA. Hepatocytes from non-hepatic adult stem cells. Nature. 2000;406:257. [PubMed] [DOI] |
| 10. | Theise ND, Nimmakayalu M, Gardner R, Illei PB, Morgan G, Teperman L, Henegariu O, Krause DS. Liver from bone marrow in humans. Hepatology. 2000;32:11-16. [PubMed] [DOI] |
| 11. | Lapidot T, Petit I. Current understanding of stem cell mobilization: the roles of chemokines, proteolytic enzymes, adhesion molecules, cytokines, and stromal cells. Exp Hematol. 2002;30:973-981. [PubMed] [DOI] |
| 12. | Petit I, Szyper-Kravitz M, Nagler A, Lahav M, Peled A, Habler L, Ponomaryov T, Taichman RS, Arenzana-Seisdedos F, Fujii N. G-CSF induces stem cell mobilization by decreasing bone marrow SDF-1 and up-regulating CXCR4. Nat Immunol. 2002;3:687-694. [PubMed] [DOI] |