修回日期: 2010-05-17
接受日期: 2010-05-25
在线出版日期: 2010-07-18
目的: 探讨胃癌超声造影的增强强度和胃癌病灶微血管密度(microvessel density, MVD)的相关性.
方法: 住院手术并有病理明确诊断的37例胃癌患者作为研究对象.术前进行超声造影检查, 应用声学定量软件绘制胃癌病灶和癌旁正常胃壁的时间-强度曲线, 定量分析超声造影的增强强度, 术后病理标本应用抗CD34免疫组织化学法染色并检测肿瘤的MVD, 分析胃癌病灶超声造影的增强强度和MVD的相关性.
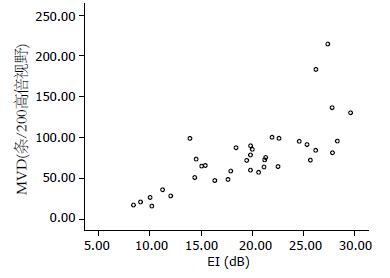
结果: 37例胃癌病灶的增强强度高于癌旁正常胃壁(19.46±5.97 vs 14.25±2.55, P<0.01), 胃癌病灶的MVD高于癌旁正常胃壁(84.68±37.99 vs 21.09±5.49, P<0.01), 差异有统计学意义.胃癌病灶的增强强度和MVD呈正相关(r = 0.77, P<0.01).
结论: 胃癌病灶的超声造影增强强度和MVD呈正相关, 胃癌超声造影可以评价肿瘤新生血管生成和生物学行为.
引文著录: 刘大铭, 黄丽萍, 张宏宇, 陈艳春. 胃癌超声造影的增强强度和微血管密度的相关性制. 世界华人消化杂志 2010; 18(20): 2109-2113
Revised: May 17, 2010
Accepted: May 25, 2010
Published online: July 18, 2010
AIM: To investigate the correlation between the enhanced intensity (EI) revealed by contrast-enhanced ultrasonography (CEUS) and microvessel density (MVD) in gastric cancer.
METHODS: Thirty-seven patients who had pathologically confirmed gastric cancer and underwent CEUS were enrolled in this study. Parameters of the time-intensity curve (TIC), including peak intensity (PI) and basic intensity (BI) of gastric cancer and normal gastric wall, were analyzed. EI (EI = PI - BI) was then calculated. Immunohistochemical staining for CD34 was performed to evaluate MVD. The correlation between EI and MVD was then analyzed.
RESULTS: The EI in gastric cancer lesions was significantly higher than that in normal gastric wall (19.46 ± 5.97 vs 14.25 ± 2.55, P < 0.01). The MVD in gastric cancer lesions was also significantly higher than that in normal gastric wall (84.68 ± 37.99 vs 21.09 ± 5.49, P < 0.01). There was a positive linear correlation between EI and MVD in gastric cancer lesions (r = 0.77, P < 0.01).
CONCLUSION: EI is positively correlated with MVD in patients with gastric cancer. CEUS may be used for assessing the angiogenesis, biological behavior and prognosis of gastric cancer.
- Citation: Liu DM, Huang LP, Zhang HY, Chen YC. Correlation between intensity of ultrasonographic contrast enhancement and microvessel density in gastric cancer. Shijie Huaren Xiaohua Zazhi 2010; 18(20): 2109-2113
- URL: https://www.wjgnet.com/1009-3079/full/v18/i20/2109.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i20.2109
胃癌是最常见的恶性肿瘤之一, 病死率占恶性肿瘤的首位[1]. 胃癌的新生血管是肿瘤生长、转移的基础, 肿瘤的微血管密度(microvessel density, MVD)是反映肿瘤血管生成活性和强度的重要指标[2]. 胃癌的MVD计数被认为是一种重要、独立的预后标志. 近年来, 对胃癌MVD的研究越来越受到重视, 但是MVD需要通过手术或者活检取材后才能获得, 我们对胃癌患者术前进行超声造影(contrast enhanced ultrasonography, CEUS)检查, 探讨胃癌CEUS时间-强度曲线的增强强度(enhanced intensity, EI)和术后病理MVD结果的相关性.
选自我院2008-06/2009-07经手术和病理明确诊断的胃癌患者37例, 其中男22例, 女15例, 年龄30-75(平均57.4±13.0)岁. 所有患者术前均未接受放疗、化疗, 也无长期服用非甾体类抗炎药或糖皮质激素病史. 造影剂采用Bracco公司的SonoVue(声诺维), 用5 mL生理盐水配成混悬液后, 每次2.4 mL经肘前浅静脉团注, 再用5 mL生理盐水冲管. 仪器采用GE公司LOGIQ 9超声诊断仪, 使用4C造影探头, 频率为2-4 MHz, 低机械指数0.07-0.10. 该机配备CPS(contrast pulse sequence)造影专用程序, TAD(tru agent detection)造影剂检测技术和声学定量分析软件. 免疫组织化学采用链霉素亲生物素-过氧化物酶(S-P)法, 通用型SP试剂盒、浓缩型DAB显色试剂盒及即用型鼠抗人原始造血细胞CD34单克隆抗体均购于北京中杉金桥生物技术公司.
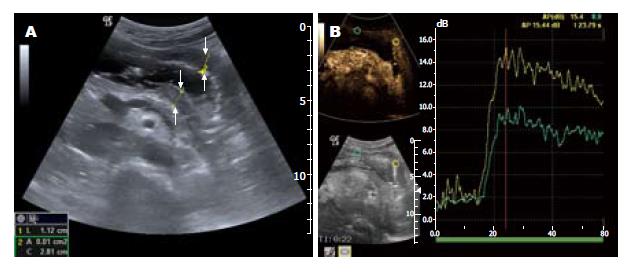
1.2.1 CEUS: 所有患者检查前禁食8 h以上, 检查时采用仰卧位, 首先饮用纯净水600-800 mL充盈胃腔后, 对胃进行整体扫查, 注意病灶部位的胃壁层次结构改变, 判定病变浸润深度、范围及毗邻脏器情况, 病灶数目、大小、回声特征. 选择好病灶的最佳观察切面后进入造影状态, 选择双幅显示模式, 此时显示屏上左侧显示二维图像(基波图像), 右侧几乎看不到病灶的灰阶图像, 显示为黑屏(为造影图像), 从左侧肘正中静脉以快速团注法注入声诺维混悬液2.4 mL, 同时启动超声仪器内置的计时器, 实时不间断地观察病灶的EI变化, 造影全过程不少于5 min, 造影全过程记录于超声仪内.
1.2.2 造影图像分析: 由两名医生对造影图像进行分析. 将感兴趣区(region of interest, ROI)分别放置于胃癌病灶及癌旁正常胃壁处, 声学定量软件生成时间-强度曲线(time-intensity curve, TIC), 记录曲线的峰值强度(peak intensity, PI)、基础强度(basic intensity, BI), 并分别计算病灶处及癌旁胃壁处的EI, EI(dB) = PI(dB)-BI(dB). 因胃肠蠕动等原因导致ROI偏离靶目标位置时, 逐帧移动图像, 相应的逐帧修正ROI放置的位置.
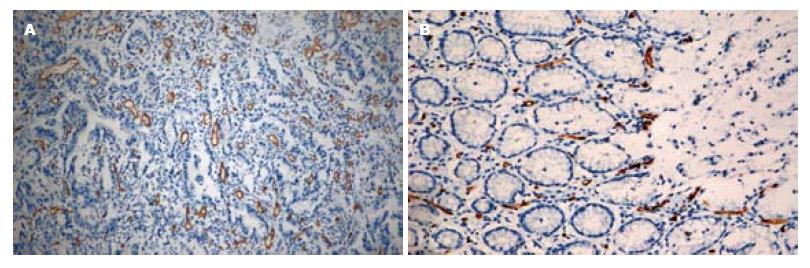
1.2.3 免疫组织化学MVD计数: 将手术切除组织制成蜡块, 取胃癌病灶及癌旁正常胃壁进行切片, 免疫组织化学抗CD34标记, 计数肿瘤组织的MVD. MVD的计数方法采用Weidner[3]的计数方法, 先在100倍低倍镜下寻找新生血管最密集区域, 即"热点", 然后在200倍高倍镜下观察染成棕色的单个细胞和细胞丛, 并以此作为一个血管. 若管腔很大很长, 单位面积内的血管数较少, 属于特殊类型的血管, 则采用Tanigawa等[4]报道的改良法计算, 即每40 μm长度的此类血管计数为一个MVD值, 分辨不清或染色模糊的细胞不计数. 结果判定在双盲法下进行.
统计学处理 采用SPSS13.0统计软件进行数据分析, 计量资料以mean±SD表示. 两样本均数比较采用t检验, 两变量间的相关关系采用Spearman等级相关分析, P<0.05为差异有统计学意义.
ROI放置于胃癌病灶和癌旁正常胃组织处, 可显示造影的TIC曲线(图1). 免疫组织化学染色: CD34阳性染色定位于血管内皮细胞, 呈棕黄色, 孤立的棕黄色血管内皮细胞或细胞簇代表一条单独的微血管(图2).
37例患者胃癌组织的EI高于癌旁正常胃壁, 组间差异有统计学意义(P<0.01). 胃癌病灶的MVD高于癌旁正常胃壁, 组间差异有统计学意义(P<0.01, 表1).
胃癌组织的EI和MVD相关性的散点图(图3), 二者呈正相关(r = 0.77, P<0.01).
胃癌同其他恶性肿瘤一样, 其主要的生物学特征之一是向周围组织浸润扩展的能力, 并能向远隔部位转移, 形成转移癌[5,6]. 术前评估胃癌的分期尤为重要, 临床多依赖增强CT、增强MRI或超声内镜[7-9]. 张艳华等[10]报道体表超声可以判定胃癌的某些生物学行为, 依此为胃癌患者进行术前准确分期, 确定手术切除范围, 选择最佳治疗方案[11,12], 为判定疗效及预后提供有价值信息.
普通的多普勒超声因为无法显示微血管, 无法评估肿瘤的血流灌注状态. 使用新型CEUS剂声诺维和低机械指数成像技术可以敏感获得微泡所代表的纯血流信息, 实时评价病灶的大血管和微血管的血流分布情况, 从而对病灶的血流状态做出诊断[13,14]. CEUS为一动态过程, 可观察某一病灶造影剂进入及流出的全过程, 这个实时操作过程是其他影像学技术无法比拟的. CEUS剂声诺维是目前国内唯一准许临床应用的CEUS剂, 近年来广泛应用于临床, 黄丽萍等[15]报道肝脏恶性肿瘤的CEUS增强表现与病理学类型及分化程度相关.
声诺维是真正的血池显像剂, 不会进入到血管外间隙中, 可准确反映病灶的血流动力学改变. 本研究对37例胃癌患者进行CEUS检查, 分析胃癌病灶及癌旁正常胃壁的TIC曲线的EI, 造影剂声诺维的SF6气体微泡和红细胞一起运行, 气体微泡密集的区域结合仪器的多脉冲图像技术, 显著提高了组织回声, 表现为CEUS高增强区, 由TIC曲线可以定量测量[16], 结果表明胃癌病灶的EI高于癌旁正常胃壁, 组间差异有统计学意义(P<0.01).
胃癌是一类多基因疾病, 癌基因的活化、抑癌基因的失活及许多血管生成因子与抑制因子的调节失衡, 在血管新生中起关键作用[17,18]. 肿瘤MVD是反映肿瘤血管生成活性和强度的可靠指标, 被认为是评价肿瘤血管生成的金标准, 被认为是一种重要、独立的预后标志. MVD越高, 肿瘤营养基础越好, 肿瘤容易生长, 研究显示新生血管较成熟血管更有穿透性, 导致瘤细胞容易进入血循环, 预后不佳[19]. 其所选取的血管内皮细胞标志物以CD34抗原特异性最高, 通常被研究用做MVD的标志物. CD34分子是一种重糖化Ⅰ型跨膜表面糖磷酸脂蛋白, 相对分子质量约110 000 Da, 在造血祖细胞, 血管内皮细胞, 胚胎纤维母细胞以及婴儿和成人纤维母细胞的某些细胞中选择表达, 除karposi肉瘤和血管内皮细胞瘤等少数肿瘤外, 绝大多数肿瘤实质细胞不表达CD34抗原, 而肿瘤间质细胞中仅血管内皮细胞表达[20], 微血管染色呈棕黄色, 染色密集区域位于癌巢及癌细胞密集区、癌灶边缘[21]. 胃癌治疗仍首选手术治疗, 术前准确判定分期尤为重要[22]. 文献报道胃癌MVD与胃癌淋巴结转移和分期有关, MVD值还与胃癌浸润深度有关. 通过研究MVD在胃癌中的表达, 探讨他们与胃癌浸润、转移的相关性, 可以为胃癌的病情判断提供依据[23,24].
肿瘤的血管生成是一个多因素作用、整体联动、动态变化的过程. 受多种因子的调节, 肿瘤血管的新生是促血管生成因子和血管生成抑制因子间失衡的结果. 人表皮生长因子(vessel endothelium growth factor, VEGF)是肿瘤血管生成的重要促进因子, 最近有很多研究针对这一因子进行研究, VEGF与肿瘤血管的生成密切相关, 并且VEGF与肿瘤的TNM分期和分级有关[25]. 肿瘤生长具有血管依赖性, 新生血管从宿主获取营养供给肿瘤, 又通过血管向宿主输送瘤细胞, 增强肿瘤病灶的远处转移能力. 阻断新生血管形成过程的任何一步, 将阻止肿瘤血管生成[26,27]. 最近许多研究证实了血管生成与胃癌侵袭性之间的联系, 同时也有许多研究证实抑制血管生成能显著抑制肿瘤的生长及转移, 文献报道VEGF阴性患者预后好于阳性者[28], VEGF可用于评估胃癌的抗血管肿瘤治疗, 在胃癌的治疗实验中已初步显示出良好的应用前景[29]. 文献报道MVD与VEGF之间存在明显正相关性, 所以胃癌MVD可以作为评估肿瘤血管生成抑制剂疗效的一个指标.
以往评价肿瘤血管生成多采用组织切片经免疫组织化学法检测肿瘤MVD, 但是这些研究是通过活检或手术后获得标本, 具有创伤性和不可重复性, 且方法繁琐耗时, 所得结果仅反映肿瘤较小区域的血管生成情况, 无法动态观察, 更无法观测功能及微血管循环情况. 本文CEUS研究结果显示胃癌组织MVD高于癌旁正常胃壁, 差异有统计学意义(P<0.01), 与文献报道结果相符[30]. 对37例胃癌组织进行抗CD34免疫组织化学染色, 计数病灶的MVD值, 并将其与CEUS TIC曲线的EI进行相关性分析, 结果表明两者呈正相关(r = 0.77, P<0.01). 因为声诺维是血池显像剂, 不会进入到血管外间隙中, 其SF6气体微泡密集的区域就是血管密集的区域, 表现为CEUS的高增强区, 同时说明造影微泡的数量和组织中新生血管程度有关, 肿瘤新生血管的出现改变了EI[31], 肿瘤MVD越大, 肿瘤EI越明显, 表现为造影TIC曲线EI越大. 说明CEUS的定量指标EI可以很好地反映胃癌病灶的MVD情况.
CEUS增强原理不同于增强CT和MRI扫描. 增强CT使用的小分子对比剂, 可透过血管壁扩散, 增强CT能反映肝脏肿瘤的血供特点, 并可定量反映病灶的灌注量以及毛细血管通透性, 增强MRI使用较广泛的也是小分子对比剂, 他可以扩散入细胞外间隙中, 而CEUS剂声诺维不会进入到血管外间隙中, 可准确反映病灶的血流信息. 有研究报道肿瘤MVD与增强CT的相关性, 结果表明肿瘤螺旋CT同层动态扫描所获得的强化峰值及强化比值均与癌组织MVD之间呈正相关, 并一定程度上反映VEGF表达水平. CEUS参数与VEGF表达水平的相关关系需进一步研究.
CEUS可实时观察病变区域造影剂进入及流出的全过程, 从而对肿瘤的血流灌注做出诊断, 其局限性在于一次注药只能观察某一个病灶的增强特点, 这一点不如增强CT及增强MRI, 我们认为各种影像学诊断方法应互为补充, 共同为病变的诊断及鉴别诊断提供全面的信息.
总之, CEUS检查简便易行、可重复性好、无放射性损伤, 可在术前、活体状态下动态评估胃癌的微血管生成情况, 能很好地反映胃癌病灶的MVD, 对进一步研究肿瘤的生物学行为, 预测肿瘤的发生发展和判定疗效及预后, 均具有临床实用意义.
胃癌的微血管密度(MVD)是反映肿瘤血管生成活性和强度的重要指标, 是一种重要、独立的预后标志. 但MVD计数需要通过手术或者活检取材后才能获得, 本研究对胃癌患者术前进行超声造影检查, 探讨超声造影的增强强度和MVD计数的相关性.
孙明军, 教授, 中国医科大学附属第一医院内镜中心; 欧希龙, 副教授, 东南大学中大医院消化科
术前判定胃癌的血流灌注状态多进行增强CT或增强MRI检查, 因普通超声检查无法显示微血管, 以往应用较少, 近来超声造影剂声诺维应用于临床, 因其可以动态、实时显示病灶的血流灌注状态, 超声造影开始应用于胃肠检查.
黄品同等报道胃癌超声造影的增强强度和微血管密度有相关性, 可以术前评估胃癌的血流灌注状态, 间接判定预后.
本文通过术前进行胃癌超声造影检查, 并将造影增强强度和术后病理MVD结果进行相关性分析, 证实其相关性, 胃癌术前超声造影可以评估肿瘤的血流灌注状态, 反映肿瘤新生血管生成.
本研究为术前判定胃癌病灶的血流灌注状态提供了信息, 为术前判定胃癌分期、预后评价提供了实验依据, 但因胃肠气体及胃肠蠕动对病灶显示的影响, 应该继续研究, 充分发挥优势, 减少超声检查时的干扰.
本文内容新颖, 研究方法科学, 有一定的临床意义.
编辑: 曹丽鸥 电编:何基才
| 2. | Qin LX, Tang ZY. The prognostic molecular markers in hepatocellular carcinoma. World J Gastroenterol. 2002;8:385-392. [PubMed] |
| 3. | Weidner N. Intratumor microvessel density as a prognostic factor in cancer. Am J Pathol. 1995;147:9-19. [PubMed] |
| 4. | Tanigawa N, Lu C, Mitsui T, Miura S. Quantitation of sinusoid-like vessels in hepatocellular carcinoma: its clinical and prognostic significance. Hepatology. 1997;26:1216-1223. [PubMed] |
| 7. | Wei WZ, Yu JP, Li J, Liu CS, Zheng XH. Evaluation of contrast-enhanced helical hydro-CT in staging gastric cancer. World J Gastroenterol. 2005;11:4592-4595. [PubMed] |
| 8. | Khushalani N. Cancer of the esophagus and stomach. Mayo Clin Proc. 2008;83:712-722. [PubMed] [DOI] |
| 11. | Liao SR, Dai Y, Huo L, Yan K, Zhang L, Zhang H, Gao W, Chen MH. Transabdominal ultrasonography in preoperative staging of gastric cancer. World J Gastroenterol. 2004;10:3399-3404. [PubMed] |
| 12. | Chen CY, Hsu JS, Wu DC, Kang WY, Hsieh JS, Jaw TS, Wu MT, Liu GC. Gastric cancer: preoperative local staging with 3D multi-detector row CT--correlation with surgical and histopathologic results. Radiology. 2007;242:472-482. [PubMed] [DOI] |
| 13. | Klein D, Jenett M, Gassel HJ, Sandstede J, Hahn D. Quantitative dynamic contrast-enhanced sonography of hepatic tumors. Eur Radiol. 2004;14:1082-1091. [PubMed] [DOI] |
| 14. | von Herbay A, Vogt C, Willers R, Häussinger D. Real-time imaging with the sonographic contrast agent SonoVue: differentiation between benign and malignant hepatic lesions. J Ultrasound Med. 2004;23:1557-1568. [PubMed] |
| 16. | Shiyan L, Pintong H, Zongmin W, Fuguang H, Zhiqiang Z, Yan Y, Cosgrove D. The relationship between enhanced intensity and microvessel density of gastric carcinoma using double contrast-enhanced ultrasonography. Ultrasound Med Biol. 2009;35:1086-1091. [PubMed] [DOI] |
| 17. | Yokozaki H, Yasui W, Tahara E. Genetic and epigenetic changes in stomach cancer. Int Rev Cytol. 2001;204:49-95. [PubMed] [DOI] |
| 18. | 唐 忠辉, 陈 华生, 邹 宗楷, 蔡 韶滨, 苏 海燕, 沈 洪武, 吴 文乔, 林 莉, 王 元亨. TFF3和CD147在不同胃黏膜病变中的 表达及其与血管生成的关系. 世界华人消化杂志. 2008;16:3631-3636. [DOI] |
| 20. | Kimura H, Nakajima T, Kagawa K, Deguchi T, Kakusui M, Katagishi T, Okanoue T, Kashima K, Ashihara T. Angiogenesis in hepatocellular carcinoma as evaluated by CD34 immunohistochemistry. Liver. 1998;18:14-19. [PubMed] [DOI] |
| 21. | 路 艳艳, 田 字彬, 魏 良洲, 孔 心涓, 赵 清喜, 李 玉军, 孙 显路. TFF3在胃癌、癌前病变及胃腺瘤中的表达及其与血管 生成的关系. 世界华人消化杂志. 2009;17:3688-3692. [DOI] |
| 23. | Zhao ZS, Zhou JL, Yao GY, Ru GQ, Ma J, Ruan J. Correlative studies on bFGF mRNA and MMP-9 mRNA expressions with microvascular density, progression, and prognosis of gastric carcinomas. World J Gastroenterol. 2005;11:3227-3233. [PubMed] |
| 24. | 赖 铭裕, 廖 晓霞, 林 瑶光, 梁 志海, 陈 晖, 李 素艳, 蒋 敦科, 刘 莹. 三叶因子1与胃癌发生发展过程中血管生成的关系. 世界华人消化杂志. 2009;17:931-934. [DOI] |
| 26. | Kerbel RS. Tumor angiogenesis. N Engl J Med. 2008;358:2039-2049. [PubMed] [DOI] |
| 27. | Harlozinska A. Progress in molecular mechanisms of tumor metastasis and angiogenesis. Anticancer Res. 2005;25:3327-3333. [PubMed] |
| 28. | Saito H, Tsujitani S, Kondo A, Ikeguchi M, Maeta M, Kaibara N. Expression of vascular endothelial growth factor correlates with hematogenous recurrence in gastric carcinoma. Surgery. 1999;125:195-201. [PubMed] |
| 31. | Park YN, Kim YB, Yang KM, Park C. Increased expression of vascular endothelial growth factor and angiogenesis in the early stage of multistep hepatocarcinogenesis. Arch Pathol Lab Med. 2000;124:1061-1065. [PubMed] |