修回日期: 2010-06-11
接受日期: 2010-06-22
在线出版日期: 2010-07-18
目的: 观察负载肿瘤抗原的树突状细胞(dendritic cells, DCs)所致敏的T淋巴细胞联合吉西他滨(GEM)抑制胰腺癌BxPC-3细胞生长的作用.
方法: 以反复冻融法提取BxPC-3的全细胞抗原, 致敏DCs后刺激T淋巴细胞的增殖和活化. 以酶联免疫吸附实验(ELISA)检测不同刺激环境下T细胞培养上清中IL-2、IFN-γ、TNF-α、IL-10和TGF-β的含量. 以细胞集落形成实验、细胞杀伤实验(MTT法)和流式细胞仪测凋亡率, 检测T淋巴细胞、GEM以及两者联合应用对BxPC-3细胞生长的抑制效应.
结果: BxPC-3细胞裂解物致敏的DCs能显著促进T淋巴细胞分泌IL-2、IFN-γ和TNF-α(1379 ng/L±307 ng/L, 1 269 ng/L±264 ng/L, 1 062 ng/L±172 ng/L vs 370 ng/L±64 ng/L, 420±114 ng/L, 515±27 ng/L, 均P<0.01), 而IL-10和TGF-β的分泌较少(P>0.05). 与阴性对照组相比, 活化T淋巴细胞、GEM以及两者联合应用对BxPC-3细胞的生长均有一定的抑制作用, 但两者联合应用时对BxPC-3细胞的杀伤率和致凋亡率最高, 而集落形成率最低, 差异均具有统计学意义(51.41%±3.64%, 51.7% vs 5.54%±1.61%, 93.4%, 均P<0.01).
结论: 负载胰腺癌BxPC-3细胞抗原的DCs可诱导出杀伤肿瘤细胞的免疫活性T淋巴细胞, 并且联合GEM后能显著抑制肿瘤细胞的生长. 生物治疗联合化疗抑制胰腺癌细胞生长的作用明显, 将有很好的临床应用前景.
引文著录: 余少培, 杨静. 吉西他滨联合免疫效应细胞对胰腺癌细胞BxPC-3生长的抑制. 世界华人消化杂志 2010; 18(20): 2095-2101
Revised: June 11, 2010
Accepted: June 22, 2010
Published online: July 18, 2010
AIM: To investigate the effect of gemcitabine (GEM) in combination with T lymphocytes activated by BxPC-3 cell whole lysate-pulsed dendritic cells (DCs) on the growth of BxPC-3 cells.
METHODS: After T lymphocytes were incubated with monocyte-derived DCs sensitized with whole lysate of BxPC-3 cells, the concentrations of IL-2, IFN-γ, TNF-α, IL-10 and TGF-β in cell supernatants were measured by enzyme-linked immunosorbent assay (ELISA). Subsequently, GEM and activated T lymphocytes, alone or in combination, were added into cultured BxPC-3 cells. After incubation for 24 h, BxPC-3 cell proliferation was measured by methyl thiazolyl tetrazolium (MTT) assay and colony formation assay, and early apoptosis of BxPC-3 cells was detected by flow cytometry.
RESULTS: After stimulation with sensitized DCs, the secretion of IL-2, IFN-γ and TNF-α by T lymphocytes was significantly enhanced (1 379 ng/L ± 307 ng/L vs 370 ng/L ± 64 ng/L, 1 269 ng/L ± 264 ng/L vs 420 ± 114 ng/L, and 1 062 ng/L ± 172 ng/L vs 515 ± 27 ng/L, all P < 0.01), while the production of IL-10 and TGF-β showed no significant changes (both P > 0.05). Compared with the negative control group, activated T lymphocytes and GEM, alone or in combination, could inhibit the growth of BxPC-3 cells. The death rate and apoptosis rate were highest, and the rate of colony formation was lowest in BxPC-3 cells treated with activated T lymphocytes and GEM in combination.
CONCLUSION: DCs sensitized with BxPC-3 cell whole lysate can induce the formation of tumor-killing cytotoxic T cells. Dendritic cell-induced immunoeffector cells in combination with gemcitabine have stronger tumor-killing activity than immunoeffector cells alone.
- Citation: Yu SP, Yang J. Gemcitabine in combination with dendritic cell-induced immunoeffector cells inhibits the growth of BxPC-3 cells. Shijie Huaren Xiaohua Zazhi 2010; 18(20): 2095-2101
- URL: https://www.wjgnet.com/1009-3079/full/v18/i20/2095.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i20.2095
胰腺癌是消化系恶性程度最高的肿瘤之一, 在世界范围内恶性肿瘤发病率中排第13位, 病死率排第8位[1]. 胰腺癌的早期诊断较为困难, 且病程进展较快, 其死亡率和发病率比例接近1:1, 5年生存率不足5%, 是预后最差的肿瘤之一[2]. 如何提高晚期胰腺癌疗效, 改善预后是临床亟须解决的问题. 吉西他滨(Gemcitabine, GEM)是一种抗代谢类的抗肿瘤药物, 可抑制肿瘤细胞的增殖和促进其凋亡. 在临床上, GEM已被列为晚期胰腺癌一线化疗的首选药物, 但其单一应用时的临床疗效仍较有限[3]. 树突状细胞(dendritic cells, DCs)是体内已知的功能最强大的肿瘤抗原专职递呈细胞, 负载肿瘤抗原的DCs是目前最具临床应用潜能的生物免疫治疗细胞. 我们用GEM联合胰腺癌BxPC-3细胞冻融物致敏DCs诱导的活化T淋巴细胞, 体外作用于BxPC-3细胞, 观察对胰腺癌细胞生长的影响, 为临床探索有效的胰腺癌综合治疗方案提供实验依据和思路.
人胰腺癌细胞株BxPC-3由西京医院肝胆外科实验室李霄博士惠赠; 重组人粒细胞巨噬细胞集落刺激因子(rhGM-CSF)、重组人白介素-4(rhIL-4)和重组人肿瘤坏死因子-α (rhTNF-α)购自Peprotech公司; IL-2、IFN-γ、TNF-α、IL-10和TGF-β的ELISA检测试剂盒均购自Biosource公司; Annexin V-FITC细胞凋亡检测试剂盒购自上海Beyotime公司; RPMI 1640细胞培养基和T淋巴细胞尼龙毛柱为Gibco公司产品; 胎牛血清购自杭州四季青公司、人淋巴细胞分离液购自天津TBD公司; GEM为Lilly公司产品; 抗凝新鲜全血由本院附属医院输血科提供.
1.2.1 细胞培养: BxPC-3培养于含100 mL/L胎牛血清的RMPI 1640培养基内. 置于37 ℃、饱和湿度、50 mL/L CO2孵育箱中常规培养. 取指数生长期细胞进行细胞实验.
1.2.2 肿瘤抗原制备: 取指数生长期的BxPC-3, 制成1×109/L细胞悬液, PBS离心洗涤3次, 弃上清, 重悬, -80 ℃-37 ℃反复冻融5次, 以3 000 r/min的速度离心30 min, 上清过滤于无菌的EP管内, 紫外分光光度仪测蛋白浓度, 按500 μg/管分装于无菌EP管内, -80 ℃保存备用.
1.2.3 DCs的培养及形态鉴定: 将新鲜健康人外周静脉抗凝血, 以密度梯度离心法分离出单个核细胞, 以含200 mL/L胎牛血清的RMPI 1640完全培养基重悬细胞, 在50 mL/L CO2、37 ℃的环境中培养4 h, 吸出未贴壁细胞, 再补充含30 μg/L rhIL-4和100 μg/L rhGM-CSF的RPMI 1640完全培养基, 继续培养于37 ℃、50 mL/L CO2的培养箱中培养, 隔日半量补充rhIL-4和rhGM-CSF. 培养至第6天, 收集疏松黏附细胞和半悬浮细胞即为未致敏DCs. 取部分细胞, PBS离心洗涤2次, 4 g/L戊二醛固定后行透射电镜检查. 再取部分细胞, 以PBS调整浓度为1×109/L, 取9滴细胞悬液, 加入1滴4 g/L台盼蓝溶液, 混匀, 充入Neu-baure 细胞计数板中, 于3 min内计数活细胞和死细胞数, 计算活细胞率(%).
1.2.4 致敏DCs及抗原活化的T淋巴细胞制备: DCs培养至第6天, 在培养基中加入上述制备的BxPC-3裂解物(120 mg/L)培养24 h, 为致敏DCs; 同时设立只加入PBS缓冲液的实验分组, 记为未致敏DCs. 再更换含20 mg/L rhTNF-α的完全培养基继续培养24 h. 培养结束后加入丝裂霉素25 mg/L, 37 ℃孵育30 min, 收获的细胞即为致敏DCs和未致敏DCs. 将前面以密度梯度离心法分离出的单个核细胞按操作说明用T淋巴细胞纯化尼龙毛柱进行分离, 得到T淋巴细胞. 重悬致敏DCs、未致敏DCs及T淋巴细胞, 使其密度均为1×109/L, 按DCs:T = 1:20的比例, 将细胞混合接种于含200 mL/L 胎牛血清的RMPI 1640完全培养基中, 置于37 ℃、50 mL/L CO2培养箱中培养96 h.
1.2.5 ELISA检测T淋巴细胞培养上清中细胞因子含量: 按T淋巴细胞培养环境的不同, 将T淋巴细胞分为4组: (1)阴性对照组; (2)裂解物组: 添加120 mg/L 的BxPC-3裂解物; (3)未致敏DCs组: 与未致敏DCs混合培养; (4)致敏DCs组: 与致敏DCs混合培养. ELISA检测各组T淋巴细胞培养上清中IL-2、IFN-γ、TNF-α、IL-10和TGF-β的含量. 具体操作方法参照试剂盒说明书. 过程简述如下: 在微孔反应板中分别加入不同浓度标准品和待测样本各100 μL, 再加生物素化抗体工作液50 μL, 振荡混匀后置室温反应120 min; 将孔内液体吸干, 充分洗涤5次后干燥; 加入酶结合物工作液100 μL, 振荡混匀, 置室温中反应30 min; 将孔内液体吸干, 充分洗涤5次后干燥; 每孔加入显色剂A、B各50 μL, 振荡混匀, 37 ℃下避光显色10 min; 加入终止液50 μL, 振荡混匀; 以酶标仪(490 nm)测定各孔吸光度, 以标准曲线法算出各细胞因子含量.
1.2.6 MTT检测T淋巴细胞和GEM对BxPC-3的杀伤率: 取指数生长期的BxPC-3为靶细胞, 离心洗涤2次后调整细胞浓度为1×107/L. 按不同的处理因素进行分组: (1)空白对照组: 只含空白培养液; (2)阴性对照组: 只含BxPC-3细胞; (3)未活化T淋巴细胞组: 将未经致敏DCs刺激的T 细胞与靶细胞按20:1的比例接种; (4)活化T淋巴细胞组: 将经致敏DCs刺激后的活化T淋巴细胞与靶细胞按20:1的比例接种; (5)GEM组: 靶细胞培养基中添加终浓度为25 mg/L GEM; (6)GEM+未活化T淋巴细胞组; (7)GEM+活化T淋巴细胞组. 每个处理均设5个复孔. 培养24 h后, 洗去各孔中的不贴壁细胞, 补充完全培养基200 μL, 再加入5 g/L MTT 20 μL, 37 ℃、50 mL/L CO2培养箱中孵育4 h后弃上清, 每孔加二甲基亚砜150 μL, 充分溶解后, 放入酶标仪中, 以空白对照孔调0, 于波长490 nm处测定吸光度(A)值, 并计算各实验组对BxPC-3的杀伤率. 杀伤率 = (1-实验组A值/阴性对照组A值)×100%. 实验重复3次, 取均值做为最终结果.
1.2.7 细胞集落形成实验: 取对数生长期的细胞, 经2.5 g/L胰酶消化, 制备单细胞悬液, 接种于35 mm塑料平皿中, 300个细胞/皿. 将平皿在37 ℃ 孵箱中培养24 h后, 进行上一步骤中的实验处理. 2 wk后待培养皿中出现肉眼可见的细胞集落即终止培养, 以PBS漂洗2次, 2 g/L结晶紫染色15 min, 缓慢漂洗培养皿后置于室温中干燥. 显微镜下计数细胞数>50个的集落数. 以阴性对照组的集落形成率为100%, 计算出各实验组的集落形成率. 实验重复3次, 取均值做为最终结果.
1.2.8 流式检测BxPC-3凋亡率: 取指数生长期的BxPC-3, 按MTT的实验分组加入相应的细胞及药物, 继续培养24 h. 培养结束后按照凋亡检测试剂盒的说明处理各组样品, 而后进行流式细胞术分析, 检测凋亡率. 实验重复3次, 取均值做为最终结果.
统计学处理 测定结果用SPSS11.0统计软件分析, 数据均用mean±SD表示, 多样本均数比较采用完全随机设计方差分析, 两组间均数比较采用SNK-q检验. 取P<0.05为有统计学意义.
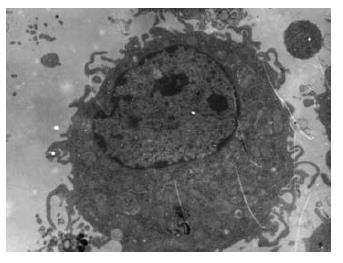
培养至第6天时, 光镜下可见细胞生长良好, 培养基无污染; 细胞体积较大, 呈半悬浮生长; 大部分细胞形状不规则, 表面呈毛刺样, 胞核清晰; 部分细胞有典型树枝样突起. 透射电镜下可见细胞体积较大, 胞体周围呈不规则树突状胞质突起和褶皱, 突起粗细不等, 形似树枝; 胞质丰富, 内含较多的胞饮小泡, 溶酶体罕见; 胞核较大, 呈圆形或卵圆形, 多偏向一侧. 所培养的细胞具有典型的DCs形态特征(图1). 台盼蓝排斥试验结果: 低倍光镜下计数100个细胞, 其中蓝染细胞均仅为1-2个, 活细胞率大于98%.
ELISA检测结果显示: 阴性对照组T淋巴细胞的培养上清中各细胞因子分泌量极少, 基本为0. 致敏DCs组的T淋巴细胞分泌IL-2、IFN-γ和TNF-α的能力显著提高, 与其余各组相比差异有统计学意义(P<0.01); 而IL-10和TGF-β的分泌量在三个实验组之间无显著差异(P>0.05, 表1).
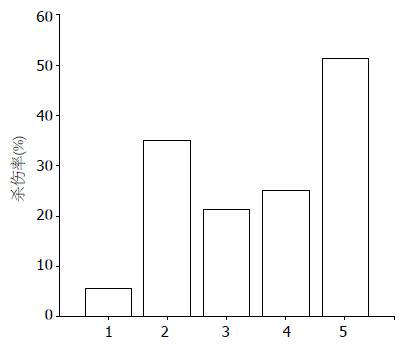
以MTT法检测各实验组对BxPC-3 的杀伤率. 统计分析显示: 未活化T淋巴细胞对BxPC-3的杀伤率最低, 为5.54%±1.61%; 经致敏DCs活化的T淋巴细胞, 其杀伤率提高至35.24%±3.25%, 两者相比差异有统计学意义(P<0.01). GEM单独应用时的杀伤率为21.34%±2.55%; 分别联合未活化和活化T淋巴细胞后, 其杀伤率为24.89%±2.98%、51.41%±3.64%; 与其他各组相比, 活化的T淋巴细胞联合GEM的杀伤率最高, 差异有统计学意义(P<0.01, 图2).
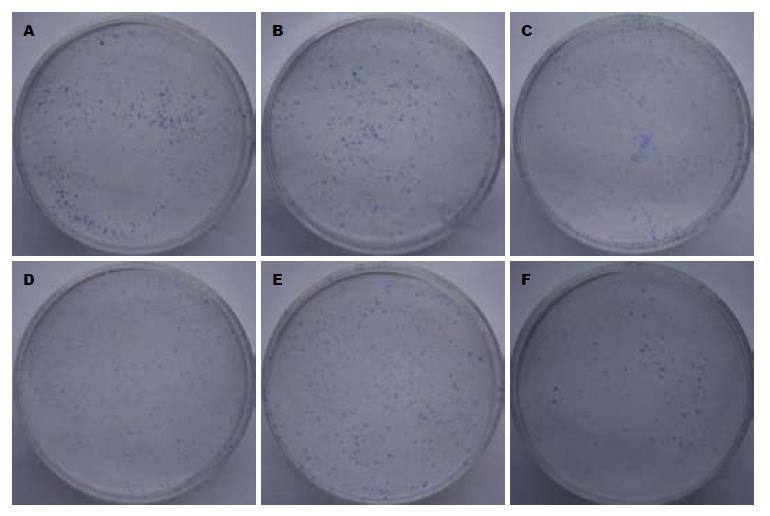
加入未活化T淋巴细胞, BxPC-3集落形成率为93.4%, 而加入活化T淋巴细胞, BxPC-3集落形成率为61.9%, 两组相比差异有统计学意义(P<0.01). GEM单独应用时的集落形成率为70.5%; 分别联合未活化和活化T淋巴细胞后, 形成率为67.9%和51.7%; 与其他各组相比, GEM联合活化T淋巴细胞的集落形成率最低, 差异有统计学意义(P<0.01, 图3).
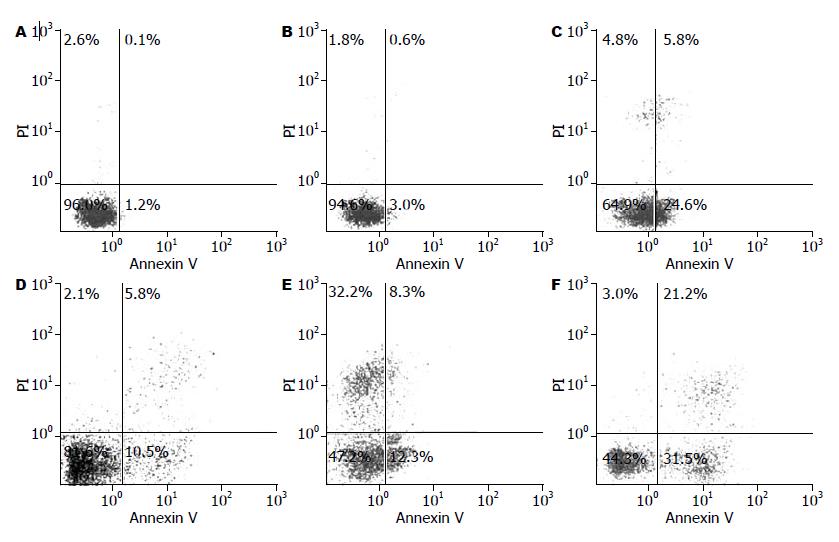
流式细胞仪检测各组BxPC-3 凋亡率显示: BxPC-3自发凋亡率很低, 为1.17%±0.25%, 加入未活化T淋巴细胞, 凋亡率为3.03%±0.65%, 两者相比差异无统计学意义(P>0.05); 而加入活化T淋巴细胞后, BxPC-3的凋亡率升高至24.33%±1.91%, 与阴性对照组和未活化T淋巴细胞组相比, 差异均有统计学意义(P<0.01). GEM单独应用时的凋亡率为10.60%±2.05%; 分别联合未活化和活化T淋巴细胞后, 凋亡率为12.41%±1.45%、32.22%±1.76%; 与其他各组相比, 活化T淋巴细胞联合GEM致BxPC-3的凋亡率最高, 差异有统计学意义(P<0.01, 图4).
胰腺癌的治疗首选胰十二指肠切除术[4], 但因胰腺癌的早期诊断较为困难, 因此临床手术切除率仅为15%左右[5]; 同时手术并不能完全清除癌灶周围的微小病变, 对血液中可能存在的癌细胞更无能为力[6], 因此必须联合其他非手术措施如化疗[7]、放疗[8,9]、生物治疗[10]等进行综合治疗, 才有可能避免或防止术后肿瘤复发与转移, 提高胰腺癌患者的长期生存率.
化学药物治疗胰腺癌已有多年历史, 目前临床使用的一线化疗药物是GEM[11]. GEM是一种抗代谢类抗癌药物, 其化学结构为盐酸双氟脱氧胞苷, 为细胞周期特异性药物, 主要作用于DNA合成期的肿瘤细胞, 即S期细胞. 在一定的条件下, 其被细胞摄入后在细胞内产生活性代谢产物-GEM的二磷酸盐和三磷酸盐[8]. 这些代谢物通过竞争嵌入DNA双链, 引起DNA双链错误识别, 将细胞有丝分裂阻止在G1期, 进而DNA双链断裂, 导致细胞死亡[12]. 尽管GEM是胰腺癌的标准治疗药物, 但接受治疗的患者其中位生存期仅为5.4-5.6 mo, 1年生存率仅为16%-19%[13]. 为了进一步提高疗效, 临床医师将许多药物与吉西他滨联合应用, 包括5-氟尿嘧啶[14]、顺铂[15,16]、奥沙利铂[17,18]、卡培他滨[19-21]、多西紫杉醇[22,23]等. 虽然这些治疗方案都能在一定程度上改善胰腺癌患者的生存质量, 但大规模的临床随机对照研究均未能显示出更长的生存时间. 如何突破胰腺癌临床治疗瓶颈, 寻找更为有效的治疗方案, 是目前胰腺癌研究的重点问题.
DCs是体内已知的最重要的专职抗原呈递细胞, 广泛分布于体内各组织中. DCs摄取抗原后将其加工提呈给T淋巴细胞[24]; 同时DCs表面高表达MHC-Ⅱ类分子和协同刺激分子, 可刺激T淋巴细胞增殖分化, 产生针对抗原的特异性细胞免疫应答反应以清除抗原[25]. 因此, 利用DCs摄取、加工和递呈肿瘤抗原给淋巴细胞, 由此激发体内的抗肿瘤免疫功能, 是当前肿瘤生物免疫治疗研究的主要策略之一[26-28]. 在本研究中, 我们用负载BxPC-3细胞抗原的DCs疫苗刺激T淋巴细胞, 发现T淋巴细胞可显著分泌IL-2、TNF-α和IFN-γ等Th1型细胞因子, 而Th2型细胞因子的IL-10和TGF-β则无显著变化; 这表明胰腺癌的DCs疫苗能够有效地将肿瘤抗原呈递给T淋巴细胞并刺激其增殖和活化, 产生抗肿瘤的细胞免疫应答. 但目前也有资料显示, DCs所诱导的抗胰腺癌细胞毒性T淋巴细胞活性有限, 在体内实验中对已形成的肿瘤治疗效果欠佳[29]. 因此, 联合GEM等化疗药物可能是提高胰腺癌生物疗效的可行策略.
综合胰腺癌化疗和生物治疗的优缺点, 本研究首次将负载胰腺癌细胞BxPC-3抗原的DCs疫苗和GEM联合应用于BxPC-3的体外培养. 通过细胞杀伤实验、克隆形成实验和凋亡细胞检测发现, 经DCs疫苗刺激的T淋巴细胞联合GEM作用于BxPC-3, 可显著杀伤胰腺癌细胞、抑制其增殖并诱导凋亡; 联合应用的各项检测结果均优于T淋巴细胞和GEM单独应用. 总之, DCs疫苗联合GEM对BxPC-3细胞的生长具有高效的抑制作用, 其机制可能是两者之间存在互相促进的协同作用. 我们将在后续的动物实验中验证体外实验的结果, 希望为临床胰腺癌的治疗提供新思路和新选择.
胰腺癌是消化系统恶性程度最高的肿瘤之一, 吉西他滨已被列为晚期胰腺癌一线化疗的首选药物, 但其单一应用时的临床疗效仍较有限, 联合生物治疗可能是提高胰腺癌疗效的可行策略.
郭晓钟, 教授, 中国人民解放军沈阳军区总医院消化内科
树突状细胞摄取、加工和递呈肿瘤抗原给淋巴细胞, 由此激发体内的抗肿瘤免疫功能, 是当前肿瘤生物免疫治疗研究的主要策略之一. 将化学药物和生物治疗联合应用, 是目前肿瘤治疗的研究热点.
近年来, 许多临床研究报道吉西他滨与其他化疗药物联合应用能在一定程度上改善胰腺癌患者的生存质量, 但大规模的临床随机对照研究均未能显示出更长的生存时间. 也有资料显示, 树突状细胞所诱导的抗胰腺癌细胞毒性T淋巴细胞活性有限, 在体内实验中对已形成的肿瘤治疗效果欠佳. 因此, 两者联合应用可能是提高胰腺癌生物疗效的可行策略.
本研究首次将负载胰腺癌细胞BxPC-3抗原的DCs疫苗和GEM联合应用于BxPC-3的体外培养. 通过细胞杀伤实验、克隆形成实验和凋亡细胞检测发现, 经DCs 疫苗刺激的T淋巴细胞联合GEM作用于BxPC-3, 可显著杀伤胰腺癌细胞、抑制其增殖并诱导凋亡.
本研究发现DCs 疫苗联合GEM对BxPC-3细胞的生长具有高效的抑制作用, 其机制可能是两者之间存在互相促进的协同作用.
本文设计科学、合理, 所得结果可信, 为今后进一步研究打下了基础, 同时预示化疗联合生物免疫治疗可以提高胰腺癌的疗效.
编辑: 李军亮 电编:何基才
| 1. | Jemal A, Siegel R, Ward E, Hao Y, Xu J, Thun MJ. Cancer statistics, 2009. CA Cancer J Clin. 2009;59:225-249. [PubMed] [DOI] |
| 2. | Rozen P, Liphshitz I, Rosner G, Barchana M, Lachter J, Pel S, Shohat T, Santo E. Pancreatic cancer in Israel: the epidemiology, possibilities of prevention, early detection and screening. Isr Med Assoc J. 2009;11:710-713. [PubMed] |
| 3. | Mackenzie RP, McCollum AD. Novel agents for the treatment of adenocarcinoma of the pancreas. Expert Rev Anticancer Ther. 2009;9:1473-1485. [PubMed] [DOI] |
| 6. | Stan SD, Singh SV, Brand RE. Chemoprevention strategies for pancreatic cancer. Nat Rev Gastroenterol Hepatol. 2010;7:347-356. [PubMed] |
| 8. | Kennedy EP, Yeo CJ. The case for routine use of adjuvant therapy in pancreatic cancer. J Surg Oncol. 2007;95:597-603. [PubMed] [DOI] |
| 9. | Landry J, Catalano PJ, Staley C, Harris W, Hoffman J, Talamonti M, Xu N, Cooper H, Benson AB 3rd. Randomized phase II study of gemcitabine plus radiotherapy versus gemcitabine, 5-fluorouracil, and cisplatin followed by radiotherapy and 5-fluorouracil for patients with locally advanced, potentially resectable pancreatic adenocarcinoma. J Surg Oncol. 2010;101:587-592. [PubMed] [DOI] |
| 11. | Squadroni M, Fazio N. Chemotherapy in pancreatic adenocarcinoma. Eur Rev Med Pharmacol Sci. 2010;14:386-394. [PubMed] |
| 12. | Wong A, Soo RA, Yong WP, Innocenti F. Clinical pharmacology and pharmacogenetics of gemcitabine. Drug Metab Rev. 2009;41:77-88. [PubMed] [DOI] |
| 14. | Mehta SP. Palliative chemotherapy for pancreatic malignancies. Surg Clin North Am. 2010;90:365-375. [PubMed] [DOI] |
| 15. | Palmer DH, Stocken DD, Hewitt H, Markham CE, Hassan AB, Johnson PJ, Buckels JA, Bramhall SR. A randomized phase 2 trial of neoadjuvant chemotherapy in resectable pancreatic cancer: gemcitabine alone versus gemcitabine combined with cisplatin. Ann Surg Oncol. 2007;14:2088-2096. [PubMed] [DOI] |
| 16. | Heinrich S, Pestalozzi BC, Schäfer M, Weber A, Bauerfeind P, Knuth A, Clavien PA. Prospective phase II trial of neoadjuvant chemotherapy with gemcitabine and cisplatin for resectable adenocarcinoma of the pancreatic head. J Clin Oncol. 2008;26:2526-2531. [PubMed] [DOI] |
| 17. | Banerjee S, Kaseb AO, Wang Z, Kong D, Mohammad M, Padhye S, Sarkar FH, Mohammad RM. Antitumor activity of gemcitabine and oxaliplatin is augmented by thymoquinone in pancreatic cancer. Cancer Res. 2009;69:5575-5583. [PubMed] [DOI] |
| 18. | Poplin E, Feng Y, Berlin J, Rothenberg ML, Hochster H, Mitchell E, Alberts S, O'Dwyer P, Haller D, Catalano P. Phase III, randomized study of gemcitabine and oxaliplatin versus gemcitabine (fixed-dose rate infusion) compared with gemcitabine (30-minute infusion) in patients with pancreatic carcinoma E6201: a trial of the Eastern Cooperative Oncology Group. J Clin Oncol. 2009;27:3778-3785. [PubMed] [DOI] |
| 19. | 谢 德荣, 梁 汉霖, 杨 琼, 郭 双双, 江 志敏, 陈 邓林. 吉西他滨联合卡培他滨一线治疗晚期胰腺癌的Meta分析. 世界华人消化杂志. 2007;15:1868-1871. [DOI] |
| 20. | Cunningham D, Chau I, Stocken DD, Valle JW, Smith D, Steward W, Harper PG, Dunn J, Tudur-Smith C, West J. Phase III randomized comparison of gemcitabine versus gemcitabine plus capecitabine in patients with advanced pancreatic cancer. J Clin Oncol. 2009;27:5513-5518. [PubMed] [DOI] |
| 21. | Desai S, Ben-Josef E, Griffith KA, Simeone D, Greenson JK, Francis IR, Hampton J, Colletti L, Chang AE, Lawrence TS. Gemcitabine-based combination chemotherapy followed by radiation with capecitabine as adjuvant therapy for resected pancreas cancer. Int J Radiat Oncol Biol Phys. 2009;75:1450-1455. [PubMed] [DOI] |
| 22. | Fine RL, Fogelman DR, Schreibman SM, Desai M, Sherman W, Strauss J, Guba S, Andrade R, Chabot J. The gemcitabine, docetaxel, and capecitabine (GTX) regimen for metastatic pancreatic cancer: a retrospective analysis. Cancer Chemother Pharmacol. 2008;61:167-175. [PubMed] [DOI] |
| 23. | Kulke MH, Tempero MA, Niedzwiecki D, Hollis DR, Kindler HL, Cusnir M, Enzinger PC, Gorsch SM, Goldberg RM, Mayer RJ. Randomized phase II study of gemcitabine administered at a fixed dose rate or in combination with cisplatin, docetaxel, or irinotecan in patients with metastatic pancreatic cancer: CALGB 89904. J Clin Oncol. 2009;27:5506-5512. [PubMed] [DOI] |
| 25. | Tucci M, Quatraro C, Dammacco F, Silvestris F. Increased IL-18 production by dendritic cells in active inflammatory myopathies. Ann N Y Acad Sci. 2007;1107:184-192. [PubMed] [DOI] |
| 26. | Seya T, Shime H, Ebihara T, Oshiumi H, Matsumoto M. Pattern recognition receptors of innate immunity and their application to tumor immunotherapy. Cancer Sci. 2010;101:313-320. [PubMed] [DOI] |
| 27. | Babatz J, Röllig C, Löbel B, Folprecht G, Haack M, Günther H, Köhne CH, Ehninger G, Schmitz M, Bornhäuser M. Induction of cellular immune responses against carcinoembryonic antigen in patients with metastatic tumors after vaccination with altered peptide ligand-loaded dendritic cells. Cancer Immunol Immunother. 2006;55:268-276. [PubMed] [DOI] |
| 29. | Bontkes HJ, Kramer D, Ruizendaal JJ, Meijer CJ, Hooijberg E. Tumor associated antigen and interleukin-12 mRNA transfected dendritic cells enhance effector function of natural killer cells and antigen specific T-cells. Clin Immunol. 2008;127:375-384. [PubMed] [DOI] |