修回日期: 2010-06-04
接受日期: 2010-06-07
在线出版日期: 2010-07-18
目的: 研究肝癌细胞SMMC-7721中SUMO-1基因对突变型p53基因表达的影响, 及SUMO-1基因对肝癌细胞增殖的作用.
方法: 通过将有效的人工合成的SUMO-1 siRNA转染肝癌细胞SMMC-7721后沉默SUMO-1基因的表达. 通过RT-PCR及Western blot实验来观察SUMO-1基因表达下调后对SMMC-7721中突变型p53基因表达的影响. 通过MTT实验来检测SUMO-1 siRNA转染SMMC-7721后在24、48及72 h对细胞增殖的影响.
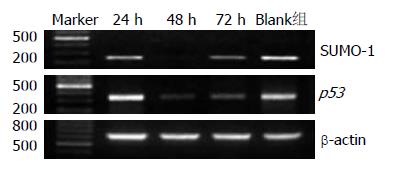
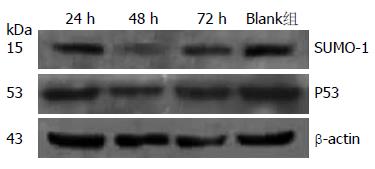
结果: 在SMMC-7721中, SUMO-1和突变型p53基因均高表达. SUMO-1基因表达下调后, SMMC-7721中突变型p53基因在mRNA及蛋白水平同步表达下调, 24、48及72 h表达下调率分别为5.73%±0.61%、69.43%±1.22%及57.71%±0.94%. 细胞增殖明显受到抑制, 24、48及72 h SMMC7721增殖抑制率分别为70.96%、71.57%及81.56%.
结论: 在转录水平, SUMO-1基因控制突变型p53基因的表达, 并和突变型p53基因共同控制SMMC-7721细胞的增殖.
引文著录: 郭武华, 袁丽华, 肖志华, 罗良平, 余婷, 张吉翔. SUMO-1 siRNA对肝癌细胞SMMC-7721 p53基因表达的影响. 世界华人消化杂志 2010; 18(20): 2090-2094
Revised: June 4, 2010
Accepted: June 7, 2010
Published online: July 18, 2010
AIM: To determine whether the SUMO-1 gene controls the expression of mutant p53 in hepatocellular carcinoma cell line SMMC-7721, and whether siRNA-mediated SUMO-1 knockdown inhibits the proliferation of SMMC-7721 cells.
METHODS: Synthetic SUMO-1 siRNA was transfected into SMMC-7721 cells to silence the expression of the SUMO-1 gene. The expression level of mutant p53 in SMMC-7721 cells was detected by RT-PCR and Western blot experiments after SUMO-1 down-regulation. SMMC-7721 cell proliferation was examined by MTT assay at 24, 48 and 72 h after siRNA transfection.
RESULTS: Both SUMO-1 and mutant p53 were highly expressed in SMMC-7721 cells. The expression of mutant p53 was down-regulated coincidentally with SUMO-1 silencing in SMMC-7721 cells. The expression of mutant p53 in SMMC-7721 cells at 24, 48 and 72 h after siRNA transfection decreased by 5.73% ± 0.61%, 69.43% ± 1.22% and 57.71% ± 0.94%, respectively. SUMO-1 knockdown inhibits the proliferation of SMMC-7721 cells. The reduced rates of cell proliferation at 24, 48 and 72 h after siRNA transfection were 70.96%, 71.57% and 81.56%, respectively.
CONCLUSION: SUMO-1 controls SMMC-772 cell proliferation possibly by regulating the expression of mutant p53 at the transcriptional level.
- Citation: Guo WH, Yuan LH, Xiao ZH, Luo LP, Yu T, Zhang JX. siRNA-mediated knockdown of the SUMO-1 gene down-regulates mutant p53 expression in hepatocellular carcinoma cell line SMMC-7721. Shijie Huaren Xiaohua Zazhi 2010; 18(20): 2090-2094
- URL: https://www.wjgnet.com/1009-3079/full/v18/i20/2090.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i20.2090
SUMO-1是SUMO(small ubiquitin-like modifier)家族成员之一, 主要作用为参与蛋白翻译后功能的修饰, 在转录、DNA修复、核质物质转运及染色体分离等方面发挥重要的调节作用[1,2]. SUMO-1基因与许多癌症发生发展相关因素关系密切, 增殖细胞核抗原、雌激素受体、p53、NF-κB信号调节、端粒酶长度的维持都受到SUMO-1蛋白的调节. 抑癌基因p53在细胞的发生、分化、凋亡等方面发挥重要的作用, 如果p53基因活性被抑制, 细胞就容易发生癌变. p53基因缺失或突变可引起多种癌症的发生, 但如失活的p53基因重新被激活, 就可能使肿瘤的生长受到抑制甚至消亡. SUMO-1修饰可抑制p53基因的活性[3,4], 促进癌症的发生发展. 研究发现, 在肝癌传代细胞株SMMC-7721中p53基因明显的高表达, 由于野生型P53蛋白的半衰期极短(仅约6 min), 而突变型P53蛋白相对稳定, 因此在SMMC-7721中的是突变型p53基因的表达[5-7]. 我们前期研究发现在肝癌细胞SMMC-7721中SUMO-1基因明显高表达[8], 本研究旨在探讨在SMMC-7721细胞中SUMO-1基因和p53基因表达的关系.
肝癌细胞株SMMC-7721购自中国典型培养物保藏中心. 培养条件: SMMC-7721培养在含100 mL/L胎牛血清(PAA)、100 kU/L青霉素和100 mg/L链霉素的RPMI 1640(Invitrogen)培养液中, 培养箱条件为37 ℃, 饱和湿度, 50 mL/L CO2. PCR热循环仪(GeneAmp® PCR System 9600), Western blot仪器(Bio-Rad), GeneGenius Match(syngene)全自动凝胶成像分析系统, 酶标仪(DENLEY MK-2). RNA提取试剂TRIzol(Invitrogen); RT-PCR试剂: Oligo(dT)(Promega), M-MLV RT 5×Buffer(Promega), dNTP(Generay Biotech), Rnase抑制剂(Promega), M-MLV逆转录酶(Promega), Master Mix(2×Taq PCR)(Tiangen), DNA ladder(Tiangen); Western blot试剂: 总蛋白提取试剂(applygen), SUMO-1一抗(兔多克隆抗体, ABZOOM), β-actin一抗(兔多克隆抗体, Santa Cruz), P53一抗(兔多克隆抗体, Santa Cruz), 二抗(羊抗兔, ZSGB-B10); LipofectamineTM 2000 Transfection Reagent(Invitrogen), MTT(Sigma). 从网址http://www.ncbi.nlm.nih.gov的GenBank中获得人SUMO-1、p53和β-actin基因序列, 应用Primer Primier 5.0软件设计引物, 由Generay Biotech公司合成, 各引物序列见表1. 设计三对针对SUMO-1 mRNA序列的siRNA, 靶序列编码分别为001: 5'-CAAGAAACTCAAAGAATCA-3', 002: 5'-GGAAGAAGATGTGATTGAA-3', 003: 5'-CAATGAATTCACTCAGGTT-3', 由广州锐博生物(ribobio)合成. 荧光标记的siRNA(FAM-siRNA)及阴性对照siRNA(NControl)购自广州锐博生物.
| 基因 | 引物序列 | 产物长度(bp) |
| SUMO-1 | 正义 5'-AGGAGGCAAAACCTTCAACT-3' | 245 |
| 反义 5'-TTCTTCCTCCATTCCCAGTT-3' | ||
| p53 | 正义 5'-TTGAGGTGCGTGTTTGTG-3' | 335 |
| 反义 5'-TTTATGGCGGGAGGTAGA-3' | ||
| β-actin | 正义 5'-ACACTGTGCCCATCTACGAGG-3' | 621 |
| 反义 5'-AGGGGCCGGACTCGTCATACT-3' |
1.2.1 肝癌细胞SMMC-7721 siRNA转染效率检测实验: FAM-siRNA分3个终浓度, 分别是30、50和100 nmol/L并设空白对照组. 按操作说明用不含血清的RPMI 1640稀释适当量的LipofectamineTM 2000和FAM-siRNA, 混合形成FAM-siRNA转染试剂混合液, 加入肝癌细胞SMMC-7721密度为30%-40%的12孔板中, 轻轻摇晃混合. 在37 ℃的CO2培养箱中培养6-8 h即可在荧光显微镜下观察转染效率. 经重复实验确定在终浓度100 nmol/L荧光强度最强, 几乎所有细胞都有荧光.
1.2.2 有效SUMO-1基因siRNA片段筛查实验: 实验分6组, 分别为待筛查的3对siRNA和阴性对照(NControl)组、脂质体(Lipofectamine)组及空白对照组(Blank组). 转染终浓度为100 nmol/L, 按操作说明进行转染, 在转染后24、48、72 h分别提取RNA及总蛋白, 采用RT-PCR及Western blot检测SUMO-1基因的表达.
1.2.3 SUMO-1基因沉默后p53基因的表达: 在SUMO-1 siRNA转染后24、48、72 h时分别提取RNA及总蛋白, 采用RT-PCR及Western blot检测p53基因的表达, 以正常细胞作为对照. 采用TRIzol提取各组SMMC-7721总RNA, 逆转录合成cDNA. PCR扩增每组p53基因的表达, 以β-actin作为内参照. p53 PCR第1阶段通过94 ℃ 5 min预变性, 然后94 ℃ 35 s、56 ℃ 35 s、72 ℃ 35 s 30个循环, 第3阶段72 ℃延迟延伸7 min. 将各组SMMC-7721裂解, 提取总蛋白. SDS-PAGE聚丙烯酰胺凝胶电泳, 蛋白通过电转移至硝酸纤维素膜上. 用50 g/L脱脂奶粉封闭2 h, 用P53一抗孵育过夜, 二抗孵育2 h, 电化学发光试剂显色, 经曝光、显影、定影后通过GeneGenius Match全自动凝胶成像分析系统测条带的灰度值, 以各自β-actin值为参照, 计算P53蛋白的表达量.
1.2.4 四甲基偶氮唑盐(MTT)实验: siRNA组: 有效的SUMO-1基因siRNA组; NControl组: 阴性对照组; Lipofectamine组: 单用LipofectamineTM 2000组; Blank组: 空白对照组. 在96孔板接种SMMC-7721, 在转染时细胞比例为30%-40%, 每组3个孔. 按操作说明转染24、48及72 h后去掉培养基, 加入用无血清1640配制的5 g/L的MTT溶液100 μL/孔, 在37 ℃的CO2培养箱中温育4 h后去掉上清液, 每孔加入二甲亚枫溶液200 μL, 在平板摇床上摇20 min, 使用酶标仪测定吸光度值(A), 检测波长450 nm. 本实验重复3次.
统计学处理 数据以mean±SD表示, 应用SPSS12.0统计软件进行数据处理, 采用两样本比较的t检验进行统计分析, 以P<0.05判定差异有统计学意义.
针对靶序列5'-CAAGAAACTCAAAGAATCA-3'的001 siRNA SUMO-1沉默效果最好, 24 h RT-PCR测得沉默效果最高为9.80%, 48 h沉默效果最高为73.43%, 72 h沉默效果最高为46.56%, 达到实验的要求(图1). Western blot检测SUMO-1蛋白的表达变化和RT-PCR的变化规律一致(图2). p53基因在siRNA导致SUMO-1基因沉默后这些基因的表达也明显下调, 24、48及72 h表达下调率分别为5.73%±0.61%、69.43%±1.22%及57.71%±0.94%, 变化规律和SUMO-1表达水平一致(图1, 2).
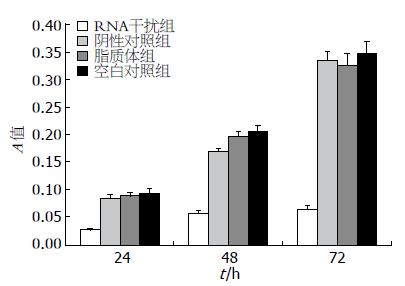
s iRNA组和其他组A值在24、48及72 h均差别明显, 24、48及72 h SMMC-7721增殖抑制率分别为70.96%、71.57%及81.56%(P<0.001, 图3, 表2).
| RNA干扰组 | 阴性对照组 | 脂质体组 | 空白对照组 | |
| 24 h | 0.027±0.0023 | 0.084±0.0078 | 0.088±0.0071 | 0.093±0.008 |
| 48 h | 0.058±0.0036 | 0.169±0.0046 | 0.197±0.0086 | 0.204±0.012 |
| 72 h | 0.064±0.0069 | 0.335±0.0145 | 0.325±0.0021 | 0.347±0.022 |
SUMO蛋白是Ublp(ubiquitin-like protein)蛋白家族中的一员, 主要参与蛋白翻译后功能的修饰(SUMOylation). SUMO在进化中高度保守, 目前在脊椎动物中至少发现4种SUMO家族蛋白, 分别是SUMO-1、SUMO-2、SUMO-3和SUMO-4. SUMO-2和SUMO-3结构有96%相同, 而SUMO-2/3和SUMO-1仅有46%的结构相同[1]. SUMO和泛素竞争结合同一底物的同一个作用点[9], 因此被SUMO修饰的蛋白不能再和泛素结合. 和其他泛素样蛋白功能不同, SUMO结合到靶蛋白后不是引起靶蛋白降解, 而是通过和靶蛋白共价结合后调节靶蛋白的功能. SUMO-1广泛参与人类癌症相关基因功能的调节, 促进癌症的发生与发展[3,10-13]. 因此, SUMO-1和癌症的发生、发展关系密切, 是癌症发生、发展的一个重要的调节因子.
p53基因是一种重要的抑癌基因, 是一种控制细胞周期的重要的启动因子, 在细胞的发生、分化及凋亡中发挥重要的作用. p53功能缺陷、抑制或突变的细胞容易发生癌变, 在人类50%以上的肿瘤组织中均发现了p53基因的突变, 这是肿瘤中最常见的遗传学改变, 说明该基因的改变很可能是人类肿瘤产生的主要发病因素. p53基因突变后, 由于其空间构象发生改变, 失去了对细胞生长、凋亡和DNA修复的调控作用, p53基因由抑癌基因转变为癌基因, 转而促进癌症的发生发展. 野生型P53蛋白在细胞内代谢的时间很短, P53蛋白的代谢和MDM2(murine double minute-2)基因关系密切. MDM2一种具有环状结构的E3连接酶, 具有结合P53蛋白的作用, 并促进P53蛋白的泛素化及降解[3], 因此, MDM2是p53基因的负调节因子. MDM2也是泛素的一个结合底物, MDM2和泛素结合后导致MDM2的降解[14], 细胞内P53蛋白的浓度增加. 但MDM2蛋白发生SUMO-1修饰后, SUMO-1使MDM2分子不能再和泛素结合, 因此在细胞内有更多的MDM2和P53蛋白结合, 再经泛素化而导致P53蛋白浓度下降[15]. 因此, SUMO-1基因是p53基因的负调节因子.
在SMMC-7721中, 文献报道及我们的研究证实p53基因都明显高表达[5-7], 根据野生型P53蛋白代谢规律及其功能, 推测这种P53蛋白是一种突变的类型, 并具有促进SMMC-7721增殖的作用[16,17]. 前期的研究证实在肝癌细胞及临床肝癌中SUMO-1基因明显高表达, SUMO-1可能是肝癌潜在的一个诊断和治疗的靶点[8]. 本研究进一步证实在肝癌细胞SMMC-7721中同时存在SUMO-1和p53基因(突变型)的表达, 说明SUMO-1蛋白并不促进突变型P53蛋白的降解, 在促进SMMC-7721的发生发展上可能具有协同的作用. 通过RNAi的方法, 抑制SMMC-7721中SUMO-1基因的表达, 可导致肝癌细胞p53基因表达明显下调及细胞生长明显的受到抑制, SMMC-7721的生长明显和SUMO-1及突变型p53基因表达有关. 由于突变型p53基因在mRNA及蛋白的表达存在明显的同步性, 因此可以推测SUMO-1基因对突变型p53基因表达的控制主要作用在转录水平, SUMO-1基因在转录水平促进突变型p53基因的表达. 进一步研究SUMO-1基因如何控制突变型p53基因的表达可进一步揭示肿瘤发生发展的规律, 并为肿瘤的治疗找到新的靶点.
SUMO修饰调节许多和癌症发生发展相关蛋白质的功能, 在癌症的发生发展中发挥重要的作用. 前期研究发现, 在肝癌细胞株及临床肝癌标本中SUMO-1基因均显著高表达, 而在癌旁肝组织中SUMO-1基因表达明显较低. 因此推测SUMO-1基因在肝癌的发生发展中具有重要的作用.
范学工, 教授, 中南大学湘雅医院感染病科
在肝癌细胞株SMMC-7721中, 突变型p53显著高表达. 由于SUMO-1修饰具有抑制细胞内p53水平的作用, 促进癌症的发生与发展, 研究SUMO-1基因表达与突变型p53基因表达之间的关系具有重要的意义.
研究显示, SUMO基因参与许多蛋白质翻译后功能的调节, 许多和癌症发生发展相关的蛋白质存在SUMO修饰. 在肝癌及其传代细胞中, SUMO-1基因显著地高表达, 抑制SUMO-1基因的表达可显著地抑制肝癌的生长.
通过RNAi方法抑制肝癌细胞SMMC-7721中SUMO-1基因的表达, 来抑制突变型p53基因的表达, 对以突变型p53基因为治疗靶点来抑制肿瘤的发展具有一定的应用价值.
本研究设计合理, 结果可靠, 对进一步研究肝癌的发生机制, 及潜在的治疗靶点有一定的参考价值.
编辑: 曹丽鸥 电编:何基才
| 1. | Di Bacco A, Ouyang J, Lee HY, Catic A, Ploegh H, Gill G. The SUMO-specific protease SENP5 is required for cell division. Mol Cell Biol. 2006;26:4489-4498. [PubMed] [DOI] |
| 2. | Martin S, Nishimune A, Mellor JR, Henley JM. SUMOylation regulates kainate-receptor-mediated synaptic transmission. Nature. 2007;447:321-325. [PubMed] [DOI] |
| 3. | Carter S, Bischof O, Dejean A, Vousden KH. C-terminal modifications regulate MDM2 dissociation and nuclear export of p53. Nat Cell Biol. 2007;9:428-435. [PubMed] [DOI] |
| 4. | Kim KI, Baek SH. SUMOylation code in cancer development and metastasis. Mol Cells. 2006;22:247-253. [PubMed] |
| 5. | 李 祺福, 唐 剑, 刘 庆榕, 石 松林, 陈 祥峰, 宋 建晔. HMBA诱导人肝癌SMMC-7721细胞分化过程中Nucleophosmin的表达 与定位变化. 中国生物化学与分子生物学报. 2008;24:172-179. |
| 6. | Xu DH, Tang J, Li QF, Shi SL, Chen XF, Liang Y. Positional and expressive alteration of prohibitin during the induced differentiation of human hepatocarcinoma SMMC-7721 cells. World J Gastroenterol. 2008;14:5008-5014. [PubMed] [DOI] |
| 9. | Ulrich HD. Mutual interactions between the SUMO and ubiquitin systems: a plea of no contest. Trends Cell Biol. 2005;15:525-532. [PubMed] [DOI] |
| 10. | Buschmann T, Fuchs SY, Lee CG, Pan ZQ, Ronai Z. SUMO-1 modification of Mdm2 prevents its self-ubiquitination and increases Mdm2 ability to ubiquitinate p53. Cell. 2000;101:753-762. [PubMed] |
| 11. | Pfander B, Moldovan GL, Sacher M, Hoege C, Jentsch S. SUMO-modified PCNA recruits Srs2 to prevent recombination during S phase. Nature. 2005;436:428-433. [PubMed] |
| 12. | Karamouzis MV, Konstantinopoulos PA, Badra FA, Papavassiliou AG. SUMO and estrogen receptors in breast cancer. Breast Cancer Res Treat. 2008;107:195-210. [PubMed] [DOI] |
| 13. | Xhemalce B, Riising EM, Baumann P, Dejean A, Arcangioli B, Seeler JS. Role of SUMO in the dynamics of telomere maintenance in fission yeast. Proc Natl Acad Sci U S A. 2007;104:893-898. [PubMed] [DOI] |
| 14. | Song MS, Song SJ, Kim SY, Oh HJ, Lim DS. The tumour suppressor RASSF1A promotes MDM2 self-ubiquitination by disrupting the MDM2-DAXX-HAUSP complex. EMBO J. 2008;27:1863-1874. [PubMed] [DOI] |
| 15. | Lee MH, Lee SW, Lee EJ, Choi SJ, Chung SS, Lee JI, Cho JM, Seol JH, Baek SH, Kim KI. SUMO-specific protease SUSP4 positively regulates p53 by promoting Mdm2 self-ubiquitination. Nat Cell Biol. 2006;8:1424-1431. [PubMed] [DOI] |
| 17. | Oren M, Rotter V. Mutant p53 gain-of-function in cancer. Cold Spring Harb Perspect Biol. 2010;2:a001107. [PubMed] [DOI] |