修回日期: 2010-06-03
接受日期: 2010-06-22
在线出版日期: 2010-07-18
目的: 研究荔枝核总黄酮(total flavone from Litchi chinensis Sonn, TFL)抗胆管阻塞性(bile duct occlusion, BDO)大鼠肝纤维化的作用及机制.
方法: 采用胆总管结扎(common bile duct ligation, CBDL)制备肝纤维化大鼠模型. 以水飞蓟素(SL)为对照, TFL[200, 100 mg/(kg•d)]灌胃给药, 4 wk后用酶联免疫吸附法(ELISA)检测大鼠血清中肿瘤坏死因子相关凋亡诱导配体(TRAIL)的水平; 放射免疫法(RIA)检测大鼠血清中透明质酸(HA)、层粘连蛋白(LN)及Ⅲ型前胶原(PCⅢ)的水平; 采用HE染色和Masson胶原染色观察大鼠肝纤维化程度; 采用免疫组织化学法(SABC法)检测肝组织TRAIL的表达.
结果: TFL大剂量给药组、假手术组和SL组血清TRAIL均明显低于模型组, 具有显著性差异(7.11 ng/L±0.99 ng/L, 5.83 ng/L±2.42 ng/L, 7.02 ng/L±1.09 ng/L vs 42.99 ng/L±14.39 ng/L, 均P<0.05), TFL大剂量给药组、假手术组和SL组血清肝纤维化指标HA、LN、PCⅢ均明显低于模型组, 具有显著性差异(103.03 μg/L±2.33 μg/L, 105.76 μg/L±3.16 μg/L, 109.64 μg/L±6.50 μg/L vs 788.7 μg/L±83.98 μg/L; 12.43 μg/L±1.45 μg/L, 7.31 μg/L±0.79 μg/L, 8.68 μg/L±1.05 μg/L vs 26.66 μg/L±2.41 μg/L; 31.07 μg/L±3.04 μg/L, 31.78 μg/L±2.33 μg/L, 33.06 μg/L±3.23 μg/L vs 74.32 μg/L±2.43 μg/L, 均P<0.05), TFL小剂量给药组血清TFL、HA、LN、PCⅢ与模型组比较无显著性差异(P>0.05). 血清TRAIL水平与肝组织中TRAIL表达一致; 血清TRAIL水平与血清HA、LN、PCⅢ呈正相关. TFL大剂量给药组和SL给药组的肝组织均显示肝纤维化程度明显改善.
结论: TFL[200 mg/(kg•d)]能抑制肝纤维化大鼠TRAIL、HA、LN、PCⅢ的表达, 并改善CBDL大鼠肝组织纤维化程度.
引文著录: 赵永忠, 漆志平, 徐庆, 肖绪华, 郭芳, 侯巧燕, 韦京辰. 荔枝核总黄酮抗胆管结扎大鼠肝纤维化的作用及机制. 世界华人消化杂志 2010; 18(20): 2084-2089
Revised: June 3, 2010
Accepted: June 22, 2010
Published online: July 18, 2010
AIM: To determine whether total flavone from Litchi chinensis Sonn (TFL) has anti-hepatic fibrosis effects in a rat model of bile duct occlusion (BDO) and to explore potential mechanisms involved.
METHODS: Hepatic fibrosis was induced in rats by common bile duct ligation. TFL was orally given to fibrotic rats at a dose of 200 or 100 mg/(kg•d). Silymarin was used as a positive control. Four weeks later, serum level of tumor necrosis factor-related apoptosis-inducing ligand (TRAIL) was determined by enzyme-linked immunosorbent assay (ELISA); serum levels of hyaluronic acid (HA), laminin (LN) and procollagen type III (PC III) were measured by radioimmunoassay (RIA); the degree of liver fibrosis was evaluated by HE staining and Masson collagen staining; and the expression of TRAIL in liver tissue was detected by immunohistochemistry using the streptavidin-biotin enzyme complex (SABC) method.
RESULTS: Serum levels of TRAIL, HA, LN and PC III were significantly lower in the high-dose TFL group, sham-operation group and silymarin group than in the model group (all P < 0.05) though that was no significant difference between the low-dose TFL group and model group (P > 0.05). Serum TRAIL level is correlated with hepatic TRAIL expression level. Serum TRAIL level also has a positive correlation with serum levels of HA, LN and PC III. The degree of liver fibrosis was significantly improved in the high-dose TFL group and silymarin group.
CONCLUSION: TFL at a dose of 200 mg/(kg•d) can inhibit the expression of TRAIL, HA, LN and PC III and improve the degree of liver fibrosis in rats with hepatic fibrosis.
- Citation: Zhao YZ, Qi ZP, Xu Q, Xiao XH, Guo F, Hou QY, Wei JC. Anti-hepatic fibrosis effect of total flavone from Litchi chinensis Sonn in rats with bile duct occlusion. Shijie Huaren Xiaohua Zazhi 2010; 18(20): 2084-2089
- URL: https://www.wjgnet.com/1009-3079/full/v18/i20/2084.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i20.2084
荔枝核又名荔仁或荔核, 是无患子科常绿乔木植物荔枝(Litchi chinensis Sonn)的干燥成熟种子, 主产于广东、广西等地. 其味甘、微苦, 归肝、肾经, 具有行气散结、祛寒止痛之功效. 文献报道荔枝核提取物有抗肿瘤、抗病毒、保肝和降糖调脂等作用[1-4]. 荔枝核黄酮类化合物对乙型肝炎病毒、呼吸道合胞病毒、流感病毒和单纯疱疹病毒有明显的抑制作用[5-8]. 对于荔枝核在保肝的基础上是否具有延缓、阻止、甚至逆转肝纤维化进展的作用未见报道. 本实验通过建立肝纤维化大鼠模型, 观察荔枝核总黄酮(total flavone from Litchi chinensis Sonn, TFL)对肝纤维化大鼠血清及肝组织学肿瘤坏死因子相关凋亡诱导配体(tumor necrosis factor related apoptosis-inducing ligand, TRAIL)变化, 旨在探讨TFL的抗肝纤维化作用及可能的作用机制.
清洁级SD大鼠100只, ♂, 体质量250 g±20 g, 购自桂林医学院实验动物中心. 大鼠TRAIL ELISA试剂盒购自上海西唐生物有限公司. 美国Santa Cruz公司的大鼠TRAIL单克隆抗体. 免疫组织化学检测试盒购自福州迈新生物技术开发有限公司. 大鼠肝纤维化诊断试剂盒, 包括透明质酸(hyaluronic acid, HA)、层粘连蛋白(laminin, LN)以及Ⅲ型前胶原(type Ⅲ procollagen, PCⅢ)放射免疫分析测定盒, 均购自上海海研医学生物技术有限公司. 荔枝核总黄酮: 由桂林医学院药理实验室提取分离, 将荔枝核干粉用500 mL/L乙醇回流提取, 得到总提取物浸膏, 用水将其溶解后, 水溶部分过D-101大孔树脂, 用800 mL/L乙醇洗脱, 洗脱物减压旋干后, 再用无水乙醇回流、过滤、减压旋干得到E部分, 取E部分经干燥制成粉末, E部分经定性试验和盐酸-镁粉检测为黄酮类化合物, 经分光光度计法检测, 总黄酮含量达853 g/kg[5], 用蒸馏水稀释为40 g/L和20 g/L两种溶液; 水飞蓟素(利加隆)胶囊: 购自德国马博士大药厂(批号H20060041), 每颗胶囊含水飞蓟素(Silymarin, SL)140 mg. 将胶囊内粉末状药品用蒸馏水稀释为10 g/L[9].
1.2.1 造模及分组: 参见文献[10]制备胆管阻塞性肝纤维化大鼠模型, 100只大鼠随机分为5组, 每组20只. 肝纤维化模型组: 大鼠腹部皮肤常规消毒, 沿腹正中线切开, 游离胆总管并双重结扎后于节间切断, 而后关腹, 制备模型后第2天用生理盐水灌胃, 每日1次, 每次5 mL/kg, 4 wk后抽取下腔静脉血, 取大鼠肝脏组织, 置于甲醛液中固定制备石蜡标本. 假手术对照组: 打开腹腔并游离胆总管, 不结扎不切断胆总管. 术后第2天用生理盐水灌胃, 每日1次, 每次5 mL/kg, 4 wk后同上处理. SL给药组: 制备模型后第2天起用SL灌胃[50 mg/(kg•d)][11], 每日1次, 4 wk后同上处理. TFL大剂量给药组: 制备模型后第2天起用TFL灌胃[200 mg/(kg•d)], 每日1次, 4 wk后同上处理. TFL小剂量给药组: 制备模型后第2天起用TFL灌胃[100 mg/(kg•d)], 每日1次, 4 wk后同上处理.
1.2.2 观察指标: (1)肝病理学检查: 肝组织HE染色和Masson胶原染色, 并按照国际上通用的Ishak评分标准[12]对肝组织纤维化程度进行评分. Ishak评分标准分为7级, 正常肝组织无纤维化, 计为0分; 有些汇管区纤维化, 有或无短纤维隔, 计为1分; 汇管区纤维化, 纤维隔形成, 计为2分; 多数汇管区纤维化, 偶有汇管-汇管桥接纤维化, 计为3分; 汇管区纤维化伴明显汇管-汇管桥接纤维化和汇管-中央桥接纤维化, 计为4分; 明显汇管-汇管桥接纤维化/汇管-中央桥接纤维化, 偶有结节, 计为5分; 可能或肯定肝硬化, 计为6分. (2)ELISA法检测血清TRAIL水平; RIA法检测血清HA、LN、PCⅢ. (3)采用免疫组织化学法(SABC法)检测肝组织TRAIL表达情况. 严格按照产品说明书规范进行操作. 结果判断: 光镜下高倍视野(40×10)观察, 细胞膜或胞质棕黄色着染者为阳性, 细胞着染数量<25%为阴性(-), 25%-50%为弱阳性(+), >50%为强阳性(++).
统计学处理 采用SPSS11.5统计软件进行数据的统计分析, 血清TRAIL、HA、LN、PCⅢ含量结果以mean±SD表示, 先进行数据的正态性检验及方差齐性检验, 符合上述条件的行单因素方差分析, 组间比较应用Student-Newman-Keuls检验, 各指标间相关分析采用Pearson相关检验, P<0.05认为差异有显著性意义.
实验过程中共有12只大鼠死亡, 死亡的大鼠当即解剖尸检并且行病理切片检查, 11只大鼠均于术后第2天死于急性肝衰竭, 1只大鼠于术后第7天死于腹部切口感染, 所有死亡动物均不进入数据统计.
TFL大剂量给药组、假手术组和水飞蓟素组血清TRAIL均明显低于模型组, 具有显著性差异(P<0.05), TFL大剂量给药组、假手术组和水飞蓟素组血清肝纤维化指标HA、LN、PCⅢ均明显低于模型组, 具有显著性差异(P<0.05), TFL小剂量给药组血清TFL、HA、LN、PCⅢ与模型组比较无显著性差异(P>0.05, 表1).
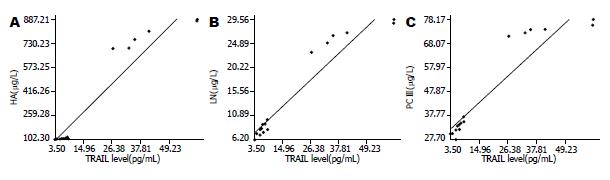
血清TRAIL水平与HA、LN、PCⅢ均呈正相关(r = 0.96、0.96、0.93, 均P<0.01, 图1). 相关方程分别是: TRAIL与HA: Y = 35.7827+16.3082X; TRAIL与LN: Y = 6.1008+0.447X; TRAIL与PCⅢ: Y = 28.6514+0.9741X.
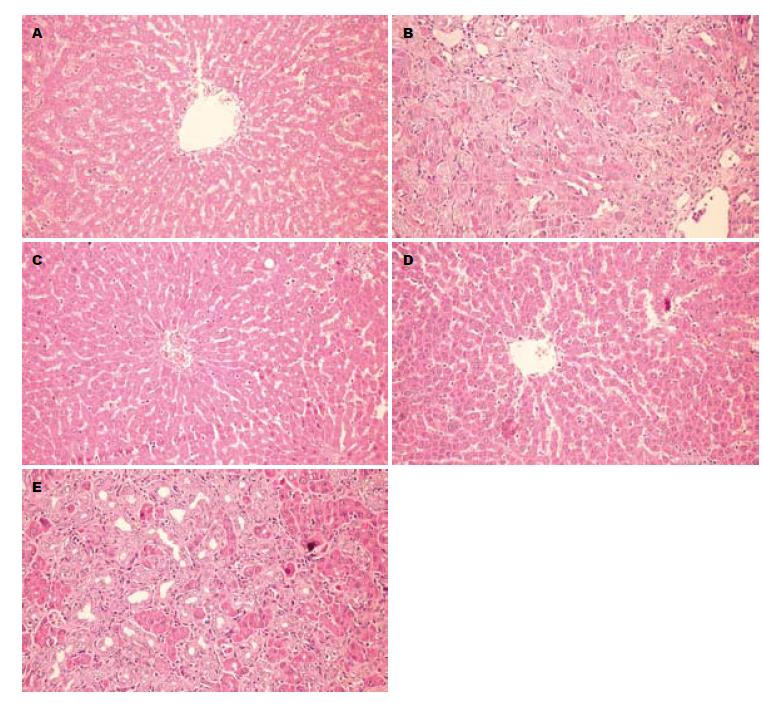
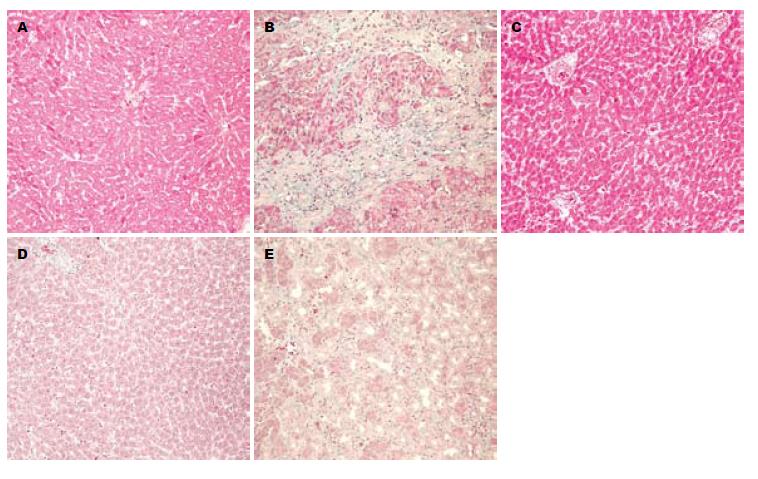
HE染色: 与假手术组比较, 模型组可见汇管区、汇管区之间、汇管区与中央静脉之间胆小管弥漫性增生, 正常肝小叶结构少见; TFL大剂量给药组和水飞蓟素组均可见汇管区、汇管区之间、汇管区与中央静脉之间胆小管少量增生, 汇管区增生较模型组明显缩小; TFL小剂量给药组可见汇管区、汇管区之间、汇管区与中央静脉之间胆小管弥漫性增生, 坏死肝细胞较模型组少, 而较TFL大剂量给药组和水飞蓟素组多; Masson染色: 模型组可见大量胶原沉积于胆管周围, 在汇管区之间、汇管区之间、汇管区与中央静脉之间形成完整的纤维间隔, 肝实质内有程度不等的胶原沉积, 仅在中央静脉周围存留肝细胞, 肝细胞与增生的胆小管相比明显减少. TFL大剂量给药组和水飞蓟素组可见有少量胶原沉积于胆管周围, 在汇管区之间、汇管区之间、汇管区与中央静脉之间纤维间隔多不完整, 肝实质内有少量胶原沉积. TFL小剂量给药组可见大量胶原沉积于胆管周围, 但汇管区之间、汇管区之间、汇管区与中央静脉之间未形成完整的纤维间隔, 分布较凌乱. Ishak评分模型组为4分, 假手术组为0分, TFL大剂量给药组和水飞蓟素组Ishak评分为均1分, TFL小剂量给药组Ishak评分为3分(图2, 3).
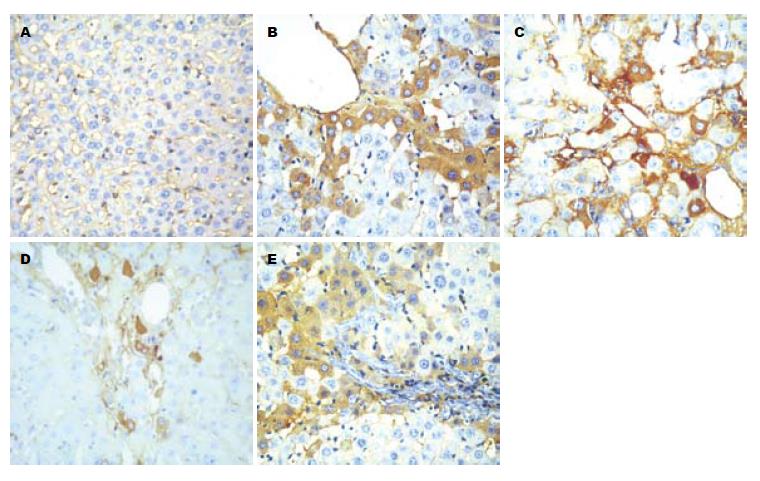
光镜下高倍视野(SABC×400)观察, TRAIL在肝组织中表达的阳性反应产物呈棕黄色, 肝细胞细胞膜和胞质均有分布. 假手术组(-): 肝内TRAIL几乎无表达; TFL小剂量给药组和模型组(++): 肝内TRAIL表达明显增强, 阳性细胞数目明显增多, 主要见于肝实质细胞、炎性细胞以及间质细胞, 阳性物质主要集中在胞质内,胞膜上也有少量表达. TFL大剂量给药组和水飞蓟素给药组(+): 肝内TRAIL表达量减少, 接近正常肝组织水平, 阳性表达集中在汇管区、间质细胞和炎性细胞胞质内, 阳性程度弱于模型组(图4).
肝纤维化是各种慢性肝病发展为肝硬化的共同病理基础, 肝实质细胞损伤坏死和肝间质细胞增生[主要是肝星状细胞(hepatic stellate cell, HSC)]是其发生的主要机制. Yamashita等[13]报道在肝纤维化硬化过程中TRAIL作为一种病理性因子出现, 其作用是诱导肝实质细胞凋亡, 促进肝纤维化肝硬化的发展. 梁艳等[14]研究发现, 原发性胆汁性肝硬化患者及乙型肝炎肝硬化患者外周血单个核细胞中TRAIL基因表达水平明显升高, TRAIL在自身免疫性肝病及肝脏病毒损伤中均具有重要作用, 不同病因导致的肝硬化均有TRAIL的基因表达增加, 认为TRAIL与慢性肝病的发病有关. 本实验结果显示, 模型组血清TRAIL显著高于假手术对照组, 血清TRAIL水平与血清HA、LN、PCⅢ呈正相关, 血清TRAIL水平与肝组织中TRAIL表达一致, 提示TRAIL可能在肝纤维化发生发展过程中起促进作用.
当各种致病因子作用于肝脏, 受损肝细胞通过产生并释放氧自由基、脂质过氧化物、蛋白酶、细胞因子和生长因子等, 直接或间接地损害邻近的肝脏细胞, 并引起肝库普弗细胞、肝窦内皮细胞、血小板、和肝细胞分泌更多种细胞因子, 从而导致恶性循环, 当阻断其中的环节, 可以有效地缓解肝纤维化进程. 氧自由基、过氧化物等在不同肝脏疾病的发生、发展过程中起着重要的作用, 因而抗氧化损伤是治疗肝纤维化的一个重要环节.
水飞蓟素是一种生物类黄酮, 具有强力抗氧化性[15,16], 主要是通过对抗氧化应激和脂质过氧化下调多种因素对HSC的激活, 在BDO肝纤维化模型中则通过抑制细胞因子的表达, 抑制HSC的激活, 减少肝胶原含量[17]、下调转化生长因子β(transforming growth factor-β, TGFβ)、前胶原α1(procollagen α1)和基质金属蛋白酶组织抑制因子1(tissue inhibitor of metalloproteinase-1, TIMP-1)的mRNA水平[17], 促进细胞外基质的降解, 所以本实验将水飞蓟素给药组作为阳性对照组.
肖柳英等[18]的实验研究结果发现荔枝核高、低剂量组均能明显降低CCl4急性肝损伤模型小鼠血清丙二醛(maleic dialdehyde, MDA)含量的明显降低; MDA为脂质过氧化的产物, 其含量高低可反映体内脂质过氧化的程度; 血清的超氧化物歧化酶(superoxide dismutase, SOD)的活性均升高, 提示荔枝核对急性肝损伤有保护作用. 徐庆等[5]研究提示TFL具有明显的抗炎、保肝作用.
本实验结果, TFL大剂量给药组、假手术对照组和水飞蓟素组血清TRAIL、HA、LN、PCⅢ均显著低于模型组, 肝组织病学理检查显示肝纤维化程度得到明显改善. 表明一定药物浓度的TFL可抑制或延缓肝纤维化的发展, 并推测TFL改善肝纤维化可能与TRAIL的表达有关. TFL抗肝纤维化的有效成分、作用机制、体内过程等还需要进一步的研究.
肝纤维化是各种慢性肝病发展为肝硬化的共同病理基础, 肝实质细胞损伤坏死和肝间质细胞增生(主要是肝星状细胞)是其发生的主要机制. 如何延缓, 甚至阻止慢性肝病向肝纤维化进展, 成为目前防治肝硬化的研究热点.
李康, 副教授, 广东药学院药科学院药物分析教研室
文献报道荔枝核提取物有抗肿瘤、抗病毒、保肝和降糖调脂等作用, 且荔枝核黄酮类化合物(TFL)对乙型肝炎病毒等多种病毒有明显的抑制作用. 对于荔枝核在保肝的基础上是否具有延缓、阻止、甚至逆转肝纤维化进展的作用未见报道.
Yamashita等报道在肝纤维化硬化过程中肿瘤坏死因子相关凋亡诱导配体(TRAIL)作为一种病理性因子出现, 其作用是诱导肝实质细胞凋亡, 促进肝纤维化肝硬化的发展. 梁艳等研究发现, 原发性胆汁性肝硬化患者及乙型肝炎肝硬化患者外周血单个核细胞中TRAIL基因表达水平明显升高, TRAIL在自身免疫性肝病及肝脏病毒损伤中均具有重要作用, 不同病因导致的肝硬化均有TRAIL的基因表达增加, 认为TRAIL与慢性肝病的发病有关.
对于荔枝核在保肝的基础上是否具有延缓、阻止、甚至逆转肝纤维化进展的作用未见报道. 本实验通过建立肝纤维化大鼠模型, 观察荔枝核总黄酮对肝纤维化大鼠血清及肝组织TRAIL变化, 结果表明, 荔枝核总黄酮[200 mg/(kg•d)]能抑制肝纤维化大鼠TRAIL 、HA、LN、PCⅢ的表达, 并改善胆总管结扎大鼠肝组织纤维化程度.
本实验旨在探讨荔枝核总黄酮(TFL)的抗肝纤维化作用及可能的作用机制, 结果表明, TFL可抑制或延缓肝纤维化的发展, 并推测TFL改善肝纤维化可能与TRAIL的表达有关. TFL抗肝纤维化的有效成分、作用机制、体内过程等还需要进一步的研究.
本研究为新药开发, 选题新颖, 有一定的临床参考价值.
编辑: 曹丽鸥 电编:何基才
| 4. | 张 永明, 袁 红, 田 菊霞, 沈 礼, 余 海泳, 尹 洪萍, 范 超明. 荔枝核皂甙提取物对小鼠糖异生作用和血脂代谢的影响. 杭州师范学院学报(自然科学版). 2005;4:435-436. |
| 8. | 魏 金亮, 许 珍, 王 璐, 谢 超胜, 赵 颖岚, 刘 伟, 侯 炜, 汪 晖. 荔枝核黄酮体外抗单纯疱疹病毒的作用. 武汉大学学报(医学版). 2009;30:89-92. |
| 9. | 王 宇, 贾 继东, 马 雪梅, 杨 寄华, 马 红, 王 宝恩. 水飞蓟素、己酮可可碱对大鼠胆管阻塞性肝纤维化的疗效及机制. 胃肠病学和肝病学杂志. 2007;16:51-56. |
| 10. | Raetsch C, Jia JD, Boigk G, Bauer M, Hahn EG, Riecken EO, Schuppan D. Pentoxifylline downregulates profibrogenic cytokines and procollagen I expression in rat secondary biliary fibrosis. Gut. 2002;50:241-247. [PubMed] |
| 11. | Jia JD, Bauer M, Cho JJ, Ruehl M, Milani S, Boigk G, Riecken EO, Schuppan D. Antifibrotic effect of silymarin in rat secondary biliary fibrosis is mediated by downregulation of procollagen alpha1(I) and TIMP-1. J Hepatol. 2001;35:392-398. [PubMed] [DOI] |
| 12. | Ishak K, Baptista A, Bianchi L, Callea F, De Groote J, Gudat F, Denk H, Desmet V, Korb G, MacSween RN. Histological grading and staging of chronic hepatitis. J Hepatol. 1995;22:696-699. [PubMed] [DOI] |
| 13. | Yamashita Y, Shimada M, Tanaka S, Okamamoto M, Miyazaki J, Sugimachi K. Electroporation-mediated tumor necrosis factor-related apoptosis-inducing ligand (TRAIL)/Apo2L gene therapy for hepatocellular carcinoma. Hum Gene Ther. 2002;13:275-286. [PubMed] [DOI] |
| 14. | 梁 艳, 杨 再兴, 王 燕, 李 畅, 曹 伟娟, 仲 人前. 原发性胆汁性肝硬化患者血浆可溶型肿瘤坏死因子相关凋亡诱导配体的 表达及临床意义. 第二军医大学学报. 2007;28:151-153. |
| 15. | Schuppan D, Hahn EG. Clinical studies with silymarin: fibrosis progression is the end point. Hepatology. 2001;33:483-484. [PubMed] [DOI] |
| 16. | Saller R, Meier R, Brignoli R. The use of silymarin in the treatment of liver diseases. Drugs. 2001;61:2035-2063. [PubMed] [DOI] |
| 17. | Boigk G, Stroedter L, Herbst H, Waldschmidt J, Riecken EO, Schuppan D. Silymarin retards collagen accumulation in early and advanced biliary fibrosis secondary to complete bile duct obliteration in rats. Hepatology. 1997;26:643-649. [PubMed] [DOI] |