修回日期: 2009-11-15
接受日期: 2009-11-23
在线出版日期: 2010-01-18
目的: 观察血小板衍化内皮细胞生长因子(PD-ECGF)在胰腺癌组织中的表达, 探讨其临床意义.
方法: 利用Elivison免疫组织化学法检测36例手术切除的胰腺癌及21例癌旁正常胰腺组织, 以及胃癌、食管癌、肝癌、结肠癌、肺癌及乳腺癌组织各10例中PD-ECGF的表达. 分析PD-ECGF与胰腺癌大小、分化程度及淋巴结转移的相关性.
结果: PD-ECGF在胰腺癌组织中的表达阳性率显著高于在癌旁正常胰腺组织(88.9% vs 28.6%, P<0.01). PD-ECGF在结肠癌、肝癌、乳腺癌、食管癌、胃癌及肺癌组织中的表达阳性率为60%、70%、80%、90%、90%及80%. Ⅱ-Ⅳ期胰腺癌组织中PD-ECGF的表达阳性率显著高于Ⅰ期胰腺癌组织(100% vs 75%, P<0.05).
结论: PD-ECGF为一种非特异性的肿瘤相关因子, 其可能与胰腺癌的病程进展有关.
引文著录: 唐光华, 倪润洲, 肖明兵, 江枫, 陈健华, 黄华. 血小板衍化内皮细胞生长因子在胰腺癌组织中的表达及其临床意义. 世界华人消化杂志 2010; 18(2): 143-148
Revised: November 15, 2009
Accepted: November 23, 2009
Published online: January 18, 2010
AIM: To investigate the expression of platelet-derived endothelial cell growth factor (PD-ECGF) in human pancreatic carcinoma and evaluate its clinical significance.
METHODS: Immunohistochemistry was used to detect the expression of PD-ECGF in 36 paraffin-embedded pancreatic carcinoma specimens, 21 tumor-adjacent normal tissue specimens, and 60 cancerous specimens derived from other tissues (stomach, colon, esophagus, liver, lung and breast; 10 specimens each). The expression of PD-ECGF in different tissues was compared. The correlation between PD-ECGF expression and clinical parameters in pancreatic carcinoma was analyzed.
RESULTS: The positive rate of PD-ECGF in pancreatic carcinoma was higher than that in tumor-adjacent normal tissue (88.9% vs 28.6%, P < 0.01). The positive rates of PD-ECGF in cancerous colon, liver, breast, esophagus, stomach and lung tissues were 60%, 70%, 80%, 90%, 90% and 80%, respectively. The positive rate of PD-ECGF in pancreatic carcinoma at stage II-IV was higher than that at stage I (100% vs 75%, P < 0.05).
CONCLUSION: PD-ECGF is an organ-unspecific tumor-associated protein that may be associated with the progression of pancreatic carcinoma.
- Citation: Tang GH, Ni RZ, Xiao MB, Jiang F, Chen JH, Huang H. Clinical significance of PD-ECGF expression in human pancreatic carcinoma. Shijie Huaren Xiaohua Zazhi 2010; 18(2): 143-148
- URL: https://www.wjgnet.com/1009-3079/full/v18/i2/143.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i2.143
胰腺癌是一种发病隐匿, 恶性度极高的消化系肿瘤. 其预后极差, 中位生存时间为3-5 mo, 超过12 mo仅占10%, 5年生存率不足5%[1]. 胰腺癌的治疗以手术治疗为主. 但胰腺癌早期诊断困难, 85%的患者出现症状时已发生淋巴结或远处转移, 失去了根治性切除的机会. 因此, 提高胰腺癌的早期诊断率, 对提高其手术切除率, 延长患者生存时间, 降低复发率具有重要意义. 然而, CT和B-US等影像手段对早期胰腺肿瘤的确诊仍有一定困难, 而CEA和CA19-9等传统血清标志物由于特异性和敏感性较低, 其临床使用价值也有限. 因此, 找到新的肿瘤标志物以提高其特异性和敏感性极为重要. 最近, 我们利用蛋白质组技术对胰腺癌组织及癌旁正常胰腺组织中差异表达蛋白质进行了研究, 采用双向电泳分离蛋白质, 快速银染, 以MALDI-TOF MS加以鉴定, 在胰腺癌组织中筛选得到12个上调蛋白[2]. 本文以其中在胰腺癌组织中上调明显的PD-ECGF蛋白作为研究对象, 利用免疫组织化学方法进一步研究他们在胰腺癌组织与正常胰腺组织中的表达差异, 并与其他常见恶性肿瘤(胃癌、食管癌、肝癌、结肠癌、肺癌和乳腺癌)相对照, 探讨PD-ECGF在胰腺癌组织中表达的特异性及与临床病理参数之间的关系.
2001-2007年南通大学附属医院住院手术的胰腺癌患者36例, 男18例, 女18例, 男:女 = 1:1, 年龄38-78(平均61.72±8.32)岁. 其中胰腺导管腺癌30例, 黏液腺癌3例, 肉瘤样癌1例, 腺泡细胞癌1例, 腺鳞癌1例. 分化程度: 高分化2例, 中分化23例, 低分化及未分化11例. 胰腺周围淋巴结转移8例, 未转移28例. 肿瘤部位: 胰头20例, 胰体尾16例; 肿瘤大小: ≤3 cm 12例, >3 cm 24例. TNM分期:Ⅰ期16例, Ⅱ期7例, Ⅲ期1例, Ⅳ期12例. 胃癌、食管癌、肝癌、结肠癌、肺癌和乳腺癌各10例. 所有病例均经手术及病理确诊, 均有完整的手术记录及病理诊断资料. 所有标本均经10%甲醛溶液固定, 常规石蜡包埋, 制作4 μm病理切片. 由两位高年资病理医生阅片确定诊断. 鼠抗人PD-ECGF单克隆抗体购自美国Santa Cruz Biotechnology, Inc.; 免疫组织化学染色试剂盒PV9000购自北京中杉金桥公司.
1.2.1 免疫组织化学检查过程: 采用Elivison二步法检测PD-ECGF在胰腺癌及癌旁组织、胃癌、食管癌、肝癌、结肠癌、肺癌、乳腺癌组织中的表达. 所有的标本用甲醛溶液固定, 石蜡包埋. 每份标本切成4 μm的薄片, 常规技术脱蜡, 水化, PBS液洗涤. 将切片放置在0.01 mmol/L柠檬酸组织抗原修复液(pH6.0)中, 中档微波处理10 min进行抗原修复, 取出自然冷却至室温. PBS冲洗3次, 每次5 min, 3% H2O2阻断内源性过氧化物酶10 min, 再次用PBS冲洗3次, 每次5 min. 除去PBS液, 每张切片加1滴1:50稀释PD-ECGF鼠抗人单克隆抗体, 在室温条件下孵育1 h. PBS冲洗3次, 每次5 min. 除去PBS, 每张切片滴加PV9000试剂1, 室温下孵育20 min. PBS冲洗3次, 每次2 min. 除去PBS液, 每张切片滴加PV9000试剂2, 室温下孵育30 min, PBS冲洗3次, 每次2 min. 除去PBS液, DAB显色, 水洗, 复染, 封固, 镜检. 阴性对照采用PBS替代第一抗体.
1.2.2 免疫组织化学检查结果的判断标准: PD-ECGF表达主要位于细胞质及细胞核内. 以出现淡黄色至棕褐色颗粒且染色强度高于背景非特异性着色者为阳性细胞. 光镜下半定量结果判断参照许良忠的方法[3], 综合考虑染色强度和阳性细胞数. 染色强度分数标准: 棕褐色3分; 棕黄色2分; 淡黄色1分; 无着色0分. 同样物镜下计数阳性细胞数: 一个视野内着色细胞>75% 4分; 51%-75% 3分; 11%-50% 2分; ≤10% 1分; 阴性0分. 两项得分相乘: 0-3分为阴性表达"-"; 满3分为"+"; 4分为"++"; 5分以上为"+++". "+~+++"为阳性表达.
统计学处理 用Stata10.0统计软件进行四格表χ2检验及确切概率法检验, 结果P<0.05认为有显著性差异.
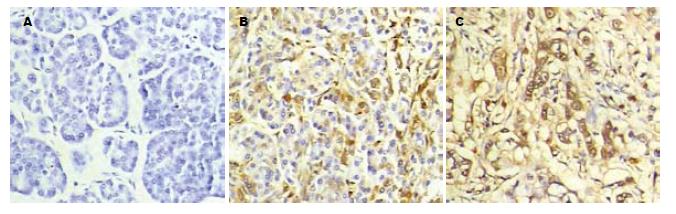
36例胰腺癌中有32例PD-ECGF表达呈阳性, 表达阳性率为88.9%(32/36), 表达强阳性率为36.1%(13/36). PD-ECGF表达主要位于细胞质及细胞核, 随表达强度不同被染色为淡黄、棕黄至棕褐色, 小片状或弥漫性分布. 在癌旁正常胰腺组织中, PD-ECGF的表达阳性率是28.6%(6/21), 且均为弱阳性表达(图1A). 高分化腺癌中PD-ECGF表达强度较低, 染色较淡(图1B). 低分化腺癌中PD-ECGF表达呈弥漫分布、染色强阳性(图1C). 胰腺癌组织PD-ECGF的表达阳性率和表达强度均高于癌旁正常胰腺组织, 两者之间有显著统计学差异(P<0.05). PD-ECGF在胃癌、食管癌、肝癌、结肠癌、肺癌、乳腺癌中的表达阳性率分别为90%(9/10)、90%(9/10)、70%(7/10)、60%(6/10)80%(8/10)、80%(8/10). PD-ECGF在胰腺癌中的表达阳性率与在胃癌、食管癌、肝癌、结肠癌、肺癌、乳腺癌中的表达阳性率相比较无显著统计学差异(P>0.05, 表1, 图1).
| 分组 | n | 阳性表达 n(%) | 表达强度 n(%) | |||
| - | + | ++ | +++ | |||
| 胰腺癌 | 36 | 32(88.9) | 4(11.1) | 8(22.2) | 11(30.6) | 13(36.1) |
| 癌旁组织 | 21 | 6(28.6)b | 15(71.4) | 6(28.6) | 0(0.0) | 0(0.0) |
| 胃癌 | 10 | 9(90.0) | 1(10.0) | 1(10.0) | 6(60.0) | 2(20.0) |
| 食管癌 | 10 | 9(90.0) | 1(10.0) | 4(40.0) | 4(40.0) | 1(10.0) |
| 肝癌 | 10 | 7(70.0) | 3(30.0) | 5(50.0) | 1(10.0) | 1(10.0) |
| 结肠癌 | 10 | 6(60.0) | 4(40.0) | 4(40.0) | 1(10.0) | 1(10.0) |
| 肺癌 | 10 | 8(80.0) | 2(20.0) | 5(50.0) | 2(20.0) | 1(10.0) |
| 乳腺癌 | 10 | 8(80.0) | 2(20.0) | 2(20.0) | 1(10.0) | 5(50.0) |
胰腺癌组织中PD-ECGF的表达情况与患者的性别、年龄、肿瘤部位、肿瘤分化程度、有无淋巴转移、肿瘤直径等临床病理参数之间没有明显的相关性(P>0.05). Ⅰ期胰腺癌中PD-ECGF的表达阳性率为75%, Ⅱ-Ⅳ期胰腺癌中PD-ECGF的表达阳性率为100%. Ⅱ-Ⅳ期胰腺癌中PD-ECGF的表达阳性率高于Ⅰ期胰腺癌中PD-ECGF的表达阳性率, 两者之间有明显统计学差异(P<0.05, 表2).
| 临床病理参数 | n | 阳性表达 n(%) | PD-ECGF的表达强度 | P值 | |||
| - | + | ++ | +++ | ||||
| 性别 | |||||||
| 男 | 18 | 16(88.8) | 2 | 4 | 4 | 8 | 1.000 |
| 女 | 18 | 16(88.8) | 2 | 4 | 7 | 5 | |
| 年龄(岁) | |||||||
| <60 | 12 | 11(91.6) | 1 | 4 | 2 | 5 | 1.000 |
| ≥60 | 24 | 21(87.5) | 3 | 4 | 9 | 8 | |
| 肿瘤部位 | |||||||
| 胰头 | 20 | 19(95.0) | 1 | 6 | 4 | 9 | 0.303 |
| 胰体尾 | 16 | 13(81.3) | 3 | 2 | 7 | 4 | |
| 分化程度 | |||||||
| 高+中 | 25 | 23(92.0) | 2 | 6 | 9 | 8 | 0.570 |
| 低 | 11 | 9(81.8) | 2 | 2 | 2 | 5 | |
| 淋巴转移 | |||||||
| 有 | 8 | 8(100.0) | 0 | 2 | 4 | 2 | 0.555 |
| 无 | 28 | 24(85.7) | 4 | 6 | 7 | 11 | |
| 肿瘤直径(cm) | |||||||
| ≤3 | 12 | 12(100.0) | 0 | 1 | 5 | 6 | 0.278 |
| >3 | 24 | 20(83.3) | 4 | 7 | 6 | 7 | |
| TNM分期 | |||||||
| Ⅰ期 | 16 | 12(75.0) | 4 | 3 | 3 | 6 | 0.031 |
| Ⅱ期+Ⅲ期+Ⅳ期 | 20 | 20(100.0) | 0 | 5 | 8 | 7 | |
新生血管形成在肿瘤尤其是实体瘤的发生、发展与转移中起重要作用. 在肿瘤侵袭前期, 肿瘤细胞的生长主要依靠扩散取得营养; 当肿瘤直径超过一定程度时, 必须依靠所诱发的血管生成来维持其继续生长. 血管生成可使肿瘤获得足够的营养物质, 是促成上述转变的关键环节, 如果没有血管生成, 原发肿瘤的生长不会超过1-2 mm3[4]. 目前已发现很多影响血管生成的因子, 如酸性成纤维细胞生长因子、碱性成纤维细胞生长因子、血管内皮细胞生长因子、血管生成素和PD-ECGF等. 其中, PD-ECGF是血管生成研究领域相对新的一个血管生长因子, 其在实体瘤[5]中表达增高, 且可催化5-FU及其前体物质, 参与抗肿瘤反应[6]. 因此, 与肿瘤的血管生成及化疗[7-10]密切相关. PD-ECGF基因定位于22号染色体的q13带. PD-ECGF是由两个的同源二聚体组成的阴离子蛋白质, 他可使胸苷去磷酸化为胸腺嘧啶和2-脱氧核糖-1-磷酸. 胸苷酶解产物胸腺嘧啶和2-脱氧核糖-1-磷酸有促进血管生成的作用[11]. PD-ECGF可能通过降低抑制内皮细胞的胸苷水平促进血管生成. 1994年, Haraguchi等[12]发现2-脱氧核糖-1-磷酸去磷酸化后的产物2-脱氧-D-核糖同样具有血管生成和趋化细胞活性. 体内PD-ECGF大量来源于血小板提示PD-ECGF对维持血管的稳定、促进内皮细胞的修复起重要作用. 有研究发现PD-ECGF在人类肿瘤组织中水平升高, 如卵巢癌[13,14]、胃癌[15,16]、乳腺癌[5]、肺癌[17]、宫颈癌[18,19]、肾癌[9,20]、肝癌[21]、大肠癌[22]、子宫内膜癌[23]、膀胱癌[24,25]等, 故认为PD-ECGF可能在癌性增生过程中起着重要作用. PD-ECGF与胃癌[26]、结肠癌[27]中微血管密度(microvessel density, MVD)密切相关, 说明其是肿瘤血管形成和维持的重要因子之一. 陈哲京等[28]研究了20例胰腺癌病例, 有14例PD-ECGF表达阳性, 其PD-ECGF表达阳性率(70%)明显高于慢性胰腺炎和正常胰腺组织; 胰腺癌PD-ECGF阳性组的MVD明显高于阴性组. 另外, 通过血管面积的比较发现PD-ECGF阳性组总血管面积(total vessel area, TVA)也明显高于阴性组, 说明胰腺癌的PD-ECGF表达影响肿瘤MVD和TVA, 与血管生成密切相关. 本研究发现胰腺癌组织PD-ECGF的阳性表达率和表达强度均高于癌旁正常胰腺组织, 这和陈哲京等的研究结果一致. Ⅰ期胰腺癌中PD-ECGF的阳性表达率为75%, Ⅱ期-Ⅳ期胰腺癌中PD-ECGF的阳性表达率为100%. Ⅱ期-Ⅳ期胰腺癌中PD-ECGF的阳性表达率高于Ⅰ期胰腺癌中PD-ECGF的阳性表达率. 提示PD-ECGF表达水平与胰腺癌的发展及分期可能有关. PD-ECGF在胃癌、食管癌、肝癌、结肠癌、肺癌、乳腺癌中的阳性表达率均大于60%, 与其在胰腺癌组织中的阳性表达率无明显统计学差异. 这显示PD-ECGF为一种非特异性的肿瘤相关因子, 而非胰腺癌特异性表达的蛋白.
胰腺癌是一种发病隐匿, 恶性度极高的消化系肿瘤, 早期诊断困难. CEA和CA19-9等传统血清标志物由于特异性和敏感性较低, 其临床使用价值也有限. 因此, 找到新的肿瘤标志物以提高其特异性和敏感性极为重要.
戴朝六, 教授, 中国医科大学第二临床学院(盛京医院)肝胆外科; 刘海林, 主任医师, 上海交通大学医学院附属第九人民医院消化科; 李淑德, 主任医师, 中国人民解放军第二军医大学长海医院消化内科
陈哲京等研究了20例胰腺癌病例, 有14例PD-ECGF表达阳性, 其PD-ECGF表达阳性率(70%)明显高于慢性胰腺炎和正常胰腺组织; 胰腺癌PD-ECGF阳性组的MVD明显高于阴性组. 另外, 通过血管面积的比较发现PD-ECGF阳性组总血管面积(TVA)也明显高于阴性组.
本文以在胰腺癌组织中上调明显的PD-ECGF蛋白作为研究对象, 利用免疫组织化学方法进一步研究他们在胰腺癌组织与正常胰腺组织中的表达差异, 并与其他常见恶性肿瘤(胃癌、食管癌、肝癌、结肠癌、肺癌和乳腺癌)相对照, 探讨了PD-ECGF在胰腺癌组织中表达的特异性及与临床病理参数之间的关系.
本文提示, PD-ECGF为一种非特异性的肿瘤相关因子, 其可能与胰腺癌的病程进展有关. 这可能为PD-ECGF是否可作为胰腺癌的早期诊断标志物提供新的依据.
本文探讨血小板衍生内皮生长因子在胰腺癌组织中表达, 有重要临床指导意义, 如能进行病例的随访则意义更大.
编辑: 李军亮 电编:何基才
| 1. | Spinelli GP, Zullo A, Romiti A, Di Seri M, Tomao F, Miele E, Spalletta B, Eramo A, Hassan C, Tomao S. Long-term survival in metastatic pancreatic cancer. A case report and review of the literature. JOP. 2006;7:486-491. [PubMed] |
| 2. | Chen JH, Ni RZ, Xiao MB, Guo JG, Zhou JW. Comparative proteomic analysis of differentially expressed proteins in human pancreatic cancer tissue. Hepatobiliary Pancreat Dis Int. 2009;8:193-200. [PubMed] |
| 4. | Hanahan D, Folkman J. Patterns and emerging mechanisms of the angiogenic switch during tumorigenesis. Cell. 1996;86:353-364. [PubMed] [DOI] |
| 5. | Ioachim E. Thymidine phoshorylase expression in breast cancer: the prognostic significance and its association with other angiogenesis related proteins and extracellular matrix components. Histol Histopathol. 2008;23:187-196. [PubMed] |
| 6. | Yamashita T, Toida M, Kato K, Long NK, Miyazaki Y, Asaka Y, Hatakeyama D, Yonemoto K, Makita H, Kato Y. The effect of neoadjuvant therapy on the 5-fluorouracil metabolic and relative enzymes of oral squamous cell carcinoma. Oncol Rep. 2009;22:501-507. [PubMed] [DOI] |
| 7. | Andreetta C, Puppin C, Minisini A, Valent F, Pegolo E, Damante G, Di Loreto C, Pizzolitto S, Pandolfi M, Fasola G. Thymidine phosphorylase expression and benefit from capecitabine in patients with advanced breast cancer. Ann Oncol. 2009;20:265-271. [PubMed] [DOI] |
| 8. | Hua D, Huang ZH, Mao Y, Deng JZ. Thymidylate synthase and thymidine phosphorylase gene expression as predictive parameters for the efficacy of 5-fluorouracil-based adjuvant chemotherapy for gastric cancer. World J Gastroenterol. 2007;13:5030-5034. [PubMed] |
| 9. | Kamoshida S, Shiogama K, Shimomura R, Inada K, Sakurai Y, Ochiai M, Matuoka H, Maeda K, Tsutsumi Y. Immunohistochemical demonstration of fluoropyrimidine-metabolizing enzymes in various types of cancer. Oncol Rep. 2005;14:1223-1230. [PubMed] |
| 10. | Loo WT, Chow LW, Suzuki T, Ono K, Ishida T, Hirakawa H, Ohuchi N, Sasano H. Expression of thymidine phosphorylase and dihydropyrimidine dehydrogenase in human breast carcinoma cells and tissues. Anticancer Res. 2009;29:2525-2530. [PubMed] |
| 11. | Stevenson DP, Milligan SR, Collins WP. Effects of platelet-derived endothelial cell growth factor/thymidine phosphorylase, substrate, and products in a three-dimensional model of angiogenesis. Am J Pathol. 1998;152:1641-1646. [PubMed] |
| 12. | Haraguchi M, Miyadera K, Uemura K, Sumizawa T, Furukawa T, Yamada K, Akiyama S, Yamada Y. Angiogenic activity of enzymes. Nature. 1994;368:198. [PubMed] [DOI] |
| 13. | Watanabe Y, Nakai H, Ueda H, Nozaki K, Hoshiai H, Noda K. Platelet-derived endothelial cell growth factor predicts of progression and recurrence in primary epithelial ovarian cancer. Cancer Lett. 2003;200:173-176. [PubMed] [DOI] |
| 14. | Morimoto Y, Hasegawa K, Sawai T, Kishimoto Y, Akimoto T. [Significance of tissue thymidine phosphorylase and dihydropyrimidine dehydrogenase activities in ovarian cancer]. Gan To Kagaku Ryoho. 2004;31:2195-2198. [PubMed] |
| 15. | Yu EJ, Lee Y, Rha SY, Kim TS, Chung HC, Oh BK, Yang WI, Noh SH, Jeung HC. Angiogenic factor thymidine phosphorylase increases cancer cell invasion activity in patients with gastric adenocarcinoma. Mol Cancer Res. 2008;6:1554-1566. [PubMed] [DOI] |
| 16. | Kandil MA, El-Wahed MM, El-Tahmody M. Predictive value of thymidine phosphorylase in gastric carcinoma. J Egypt Natl Canc Inst. 2004;16:159-167. [PubMed] |
| 17. | Sato J, Sata M, Nakamura H, Inoue S, Wada T, Takabatake N, Otake K, Tomoike H, Kubota I. Role of thymidine phosphorylase on invasiveness and metastasis in lung adenocarcinoma. Int J Cancer. 2003;106:863-870. [PubMed] [DOI] |
| 18. | Kobayashi Y, Wada Y, Ohara T, Okuda Y, Suzuki N, Hasegawa K, Kiguchi K, Ishizuka B. Enzymatic activities of uridine and thymidine phosphorylase in normal and cancerous uterine cervical tissues. Hum Cell. 2007;20:107-110. [PubMed] [DOI] |
| 19. | Nakashima M, Nakano T, Ametani Y, Funamoto H, Uchiyama A, Miwa A, Miyata S, Shoji M, Kondo T, Satake S. Expression of thymidine phosphorylase as an effect prediction factor for uterine cervical squamous cell carcinoma after radiotherapy: an immunohistochemical study. Int J Gynecol Cancer. 2006;16:1309-1313. [PubMed] [DOI] |
| 20. | Takayama T, Mugiya S, Sugiyama T, Aoki T, Furuse H, Liu H, Hirano Y, Kai F, Ushiyama T, Ozono S. High levels of thymidine phosphorylase as an independent prognostic factor in renal cell carcinoma. Jpn J Clin Oncol. 2006;36:564-569. [PubMed] [DOI] |
| 21. | Hu J, Xu Y, Shen ZZ, Wang Z, Lu Q, Yang GH, Ding ZB, Fan J, Zhou J. High expressions of vascular endothelial growth factor and platelet-derived endothelial cell growth factor predict poor prognosis in alpha-fetoprotein-negative hepatocellular carcinoma patients after curative resection. J Cancer Res Clin Oncol. 2009;135:1359-1367. [PubMed] [DOI] |
| 22. | Okita A, Tsukuda K, Murakami M, Ota T, Doihara H, Suda M, Nakano T, Matsuoka K, Suzuki E, Naito M. Thymidine phosphorylase and dihydropyrimidine dehydrogenase expression levels in tumor and normal tissue specimens of T3 human colorectal carcinoma. Surg Today. 2006;36:348-353. [PubMed] [DOI] |
| 23. | Kubiak R, Miszczak-Zaborska E, Smolarek M, Wójcik-Krowiranda K, Bartkowiak J. [The thymidine phosphorylase as the platelet-derived endothelial cell growth factor of endometrial cancer]. Ginekol Pol. 2009;80:596-601. [PubMed] |
| 24. | Nonomura N, Nakai Y, Nakayama M, Inoue H, Nishimura K, Hatanaka E, Arima R, Kishimoto T, Miki T, Kuroda H. The expression of thymidine phosphorylase is a prognostic predictor for the intravesical recurrence of superficial bladder cancer. Int J Clin Oncol. 2006;11:297-302. [PubMed] [DOI] |
| 25. | Stavropoulos NE, Bouropoulos C, Ioachim E, Michael M, Hastazeris K, Tsimaris I, Kalogeras D, Liamis Z, Kafarakis V, Stefanaki S. Prognostic significance of thymidine phosphorylase in superficial bladder carcinoma. Int Urol Nephrol. 2005;37:55-60. [PubMed] [DOI] |