修回日期: 2009-11-30
接受日期: 2009-12-07
在线出版日期: 2010-01-18
目的: 探讨真核翻译起始因子-5A2(eukaryotic initiation factor 5A2, EIF-5A2)在肝癌内的表达及其与VEGF表达、血管密度和临床病理指标的关系.
方法: 用免疫组织化学方法检测49例HCC组织及6例正常肝组织中EIF-5A2、VEGF和CD34的表达, 计数微血管密度(MVD), 并结合临床病理特征进行比较分析.
结果: 49例HCC组织中EIF-5A2、VEGF、CD34阳性表达率分别为87.7%、89.7%及100.0%, 正常肝组织EIF-5A2、CD34表达呈阴性, VEGF表达为阴性或弱阳性. 肝癌组织中EIF-5A2蛋白表达与VEGF表达及MVD间均呈正相关(r = 0.416, 0.321, 均P<0.05); 不同肿瘤灶数量的HCC组织EIF-5A2、VEGF蛋白表达及MVD差别无显著性, 不同直径HCC的EIF-5A2、VEGF蛋白表达差别亦无显著性, 而不同直径的HCC的MVD差别有显著性(P<0.05). 有癌栓形成组与无癌栓组相比EIF-5A2、VEGF蛋白表达及MVD差别均有显著性(均P<0.05). 肿瘤包膜完整组与无胞膜/包膜不完整组两组间EIF-5A2 、VEGF蛋白表达及MVD差别均有显著性(均P<0.05).
结论: 肝癌组织中有较高的EIF-5A2阳性表达; EIF-5A2表达与VEGF表达及MVD呈正相关, 与HCC组织血管侵犯和转移倾向有关.
引文著录: 赖旭东, 陈晓辉, 许贺标, 刘玉荣, 马宁芳. EIF-5A2在肝细胞癌中的表达及其与VEGF、MVD的关系. 世界华人消化杂志 2010; 18(2): 137-142
Revised: November 30, 2009
Accepted: December 7, 2009
Published online: January 18, 2010
AIM: To investigate the correlations of eukaryotic initiation factor-5A2 (EIF-5A2) expression with vascular endothelial growth factor (VEGF) expression, microvessel density (MVD) and clinicopathological parameters in hepatocellular carcinoma (HCC).
METHODS: Immunohistochemistry was used to determine the expression of EIF-5A2, VEGF and CD34 in 49 HCC tissues and 6 normal liver tissues. The MVD was calculated by counting CD34-labeled vessels. The correlations of EIF-5A2 expression with VEGF expression, MVD and clinicopathological parameters in HCC were then analyzed.
RESULTS: The positive rates of EIF-5A2, VEGF and CD34 expression in 49 HCC tissues were 87.7%, 89.7% and 100%, respectively. In contrast, EIF-5A2 and CD34 expression was not detected and VEGF was weakly detected in normal liver tissues. EIF-5A2 expression was positively correlated with VEGF expression and MVD (r = 0.416 and 0.321, respectively; both P < 0.05) in HCC. There were no significant differences in EIF-5A2 expression, VEGF expression and MVD between HCC tissues containing a single tumor focus and multiple tumor foci. No differences were found in the expression of EIF-5A2 and VEGF among HCCs of different diameters though a significant difference was noted in MVD. The levels of EIF-5A2 and VEGF expression and MVD were significantly higher in HCC patients with portal vein tumor thrombosis than in those without portal vein tumor thrombosis (all P < 0.05). Significant differences were also noted in EIF-5A2 and VEGF expression and MVD between HCC with an integral capsule and that without an integral capsule (all P < 0.05).
CONCLUSION: EIF-5A2 is highly expressed in HCC tissues. EIF-5A2 expression is positively correlated with VEGF expression and MVD in HCC. The overexpression of EIF-5A2 may play an important role in portal vein encroachment and metastasis of HCC.
- Citation: Lai XD, Chen XH, Xu HB, Liu YR, Ma NF. Correlations of EIF-5A2 protein expression with VEGF expression and microvessel density in hepatocellular carcinoma. Shijie Huaren Xiaohua Zazhi 2010; 18(2): 137-142
- URL: https://www.wjgnet.com/1009-3079/full/v18/i2/137.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i2.137
真核翻译起始因子-5A2(eukaryotic initiation factor-5A2, EIF-5A2)是在人卵巢癌UACC-1598细胞内发现的新癌基因[1], 为真核生物翻译起始因子-5A(eukaryotic initiation factor 5A, EIF-5A)家族中的一员, 其表达产物与EIF-5A有82%同源性. EIF-5A蛋白在生物合成后, 其分子上的赖氨酸即被N'-赖氨酸合酶(deoxyhypusine synthase, DHPS)催化修饰形成8-羧基2, 7, 10-三氨基癸酸(hypusine), 进而使EIF-5A活化以维持细胞的正常增殖, 抑制DHPS活性将延缓正常细胞或各种肿瘤细胞的细胞周期[2,3]. EIF-5A mRNA及蛋白广泛表达于人体正常组织或肿瘤细胞, 而同样受DHPS作用的EIF-5A2仅在正常睾丸和脑细胞中有弱表达, 但某些肿瘤细胞内如卵巢癌和结肠癌等, EIF-5A2却有很强的表达, 且与临床分期密切相关[4,5], 提示EIF-5A2极可能为一个转移相关基因. 原发性肝细胞癌(hepatocellular carcinoma, HCC)是一种强的血管依赖性肿瘤, 具有生长快、转移早和高死亡率的特点, 血管生成是其恶性化的第一步, 因此以血管生成信号传导通路为靶向的抗血管治疗是颇具潜力的、抗HCC浸润、转移和术后复发的治疗方法[6], 但在血管生成过程中, 许多信号分子调控机制目前还不清楚. 有研究报道抑制EIF-5A2的激活因子DHPS将影响血管内皮细胞的增殖及血管发生, 提示EIF-5A2表达可能与血管生成有关[7]. 本研究采用免疫组织化学的方法检测肝癌组织内EIF-5A2、血管内皮生长因子(vascular endothelial growth factor, VEGF)等表达并计数HCC的微血管密度(microvascular density, MVD), 旨在探讨EIF-5A2表达与VEGF表达、MVD及HCC主要临床病理特征的关系.
选取广州附属肿瘤医院病理科2008年HCC切除标本49例, 男43例, 女6例, 年龄28- 74(平均48.6)岁. 所有标本病理诊断均为HCC, 肝癌病理分级按Edmondson方法分级Ⅰ-Ⅱ级38例, Ⅲ级11例. 49例肝癌标本中, 肿瘤直径<5 cm有17例, 肿瘤直径>5 cm者32例, 36例有门脉血管转移. 另取6例正常肝移植供体活检肝组织切片作正常对照. 鼠抗人EIF-5A2单克隆抗体由香港大学临床肿瘤学系关新元教授惠赠, 兔抗人VEGF多克隆抗体、鼠抗人CD34单克隆抗体及兔/鼠两步法检测试剂盒(UltraVision Detection System, HRP/DAB)均为NeoMarkers产品.
1.2.1 切片制备: 所有标本组织均经过常规100 g/L的甲醛溶液固定, 石蜡包埋. 载玻片经泡酸、高温灭菌、多聚赖氨酸涂片处理. 连续切片, 片厚4 μm, 分别行HE染色作复诊、组织病理学分级以及EIF-5A2、VEGF及CD34免疫组织化学染色.
1.2.2 EIF-5A2和VEGF结果判定标准: 采用双盲评分法. 在排除非特异性染色的前提下, 以黄色、棕黄色、棕褐色为阳性, 计分方法A: 按切片中细胞染色的深浅评分, 0分-无着色; 1分-细胞染色呈浅黄色; 2分-细胞染色呈棕黄色; 3分-细胞染色呈棕褐色. B: 按切片中的阳性细胞比例评分, 每例随机观察5个视野, 每个视野100个细胞, 计数500个细胞中染色阳性的细胞数, 0分-显色细胞数≤5%; 1分-显色细胞数占5%-25%; 2分-显色细胞数占25%-50%; 3分-显色细胞数占50%-75%; 4分-75%以上的细胞显色. 每例标本染色积分 = A×B, 若乘积≤1为阴性, >1为阳性.
1.2.3 CD34结果及MVD判定标准: 根据Weidner[8]计数方法, 每一染成棕黄色的、可与周围肿瘤细胞或组织区分开来的内皮细胞或内皮细胞簇, 均作为1个单一的微血管. 管腔面积大于8个红细胞直径或带有较厚肌层的微血管均不计数. 肿瘤内细胞稀少区域的微血管不进行计数. 结果判定在双盲法下进行. 于低倍镜(×40和×100)下选取5个微血管最多的视野即热点区(Hotspot), 再于高倍(×400)视野下计数微血管的数目, 求得5个视野的均值作为MVD. 硬化、炎症及坏死区的微血管不计入计数结果. 若管腔大且长的特殊类型血管, 采用Taniganwa等报道的改良法计算[9], 即每40 μm长度的此类血管计数为一个MVD值.
统计学处理 所有数据均经统计软件SPSS12.0进行统计分析, EIF-5A2表达与VEGF的表达及MVD相关性采用单因素Spearman相关分析, EIF-5A2、VEGF表达和MVD与肝癌临床病理因素的分析采用t检验. 以α = 0.05作为检验水准. EIF-5A2、VEGF表达分值、MVD值以mean±SD表示.
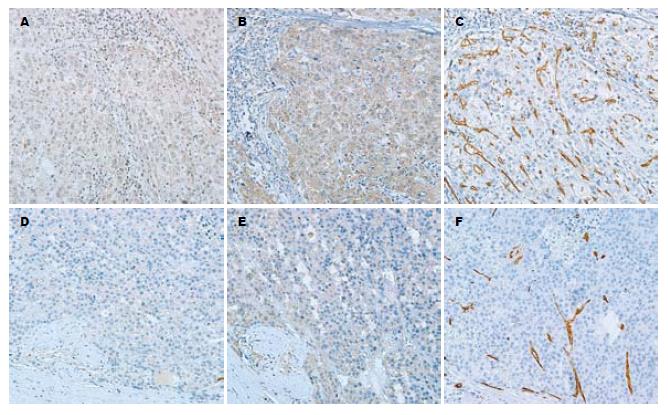
49例肝癌组织中EIF-5A2表达阳性43例(87.7%, 表1), 阳性表达呈浅黄色或棕黄色, 定位于肝癌细胞胞质, 癌体周边细胞EIF-5A2的表达明显强于癌体中央细胞(图1A, D), 并可见其浸润穿越周围的结缔组织, 呈侵袭性生长; VEGF阳性表达44例(89.7%, 表1), 阳性表达呈棕黄色或棕褐色, 定位于细胞质(图1B, E), 与EIF-5A2表达有相同趋势; 49例组肝癌组织均有CD34表达(100%, 表1), 阳性表达呈棕褐色, 定位于肿瘤区内皮细胞胞质, 可见散在CD34阳性内皮细胞或内皮细胞簇, 部分微血管有管腔, 形态不规则, 低分化肝癌组织内的微血管密度大于分化程度高的肝癌组织(图1C, F). 正常对照肝组织EIF-5A2呈阴性表达, VEGF呈阴性或弱阳性表达. Spearman相关分析显示EIF-5A2与VEGF、EIF-5A2与MVD及VEGF与MVD间均存在正相关(表2).
| 组织类型 | n | 阳性率(%) | ||
| EIF-5A2 | VEGF | CD34 | ||
| 肝癌组织 | 49 | 87.7 | 89.7 | 100.0 |
| 正常肝组织 | 6 | 0.0 | 0.0 | 0.0 |
| EIF-5A2 | VEGF | MVD | |
| EIF-5A2 | |||
| r值 | 1.000 | 0.416 | 0.321 |
| P值 | - | <0.05 | <0.05 |
| VEGF | |||
| r值 | 0.416 | 1.000 | 0.385 |
| P值 | <0.05 | - | <0.05 |
| MVD | |||
| r值 | 0.321 | 0.385 | 1.000 |
| P值 | <0.05 | <0.05 | - |
不同肿瘤数量的HCC组织EIF-5A2、VEGF蛋白表达及MVD差别无显著性(P>0.05), 不同直径HCC的EIF-5A2、VEGF蛋白表达差别无显著性(P>0.05), 而不同直径HCC的MVD差别有显著性(P<0.05). 有癌栓形成组与无癌栓组相比EIF-5A2、VEGF蛋白表达及MVD差别均有显著性(P<0.05). 49例HCC中, 肿瘤包膜完整组与无胞膜/包膜不完整组两组间EIF-5A2、VEGF蛋白表达及MVD差别均有显著性(P<0.05). 根据Edmonds病理分级, 49例HCC中, Ⅰ-Ⅱ级与Ⅲ级两组间EIF-5A2、VEGF蛋白表达及MVD差别均无显著性(P>0.05). AFP值≤50 μg/L与>50 μg/L两组间EIF-5A2、VEGF蛋白表达及MVD差别均无显著性(P>0.05, 表3).
| 病理参数 | n | EIF-5A2表达 | VEGF表达 | MVD |
| 肿瘤数量 | ||||
| 单个 | 27 | 7.66±1.30 | 8.15±1.16 | 52.04±3.54 |
| 多个 | 22 | 7.32±2.45 | 7.96±1.05 | 54.25±4.12 |
| 肿瘤大小(cm) | ||||
| ≤5 | 17 | 7.25±2.12 | 7.89±1.05 | 46.56±4.22 |
| >5 | 32 | 6.94±1.22 | 7.94±1.66 | 53.18±3.24a |
| 癌栓 | ||||
| 有 | 36 | 7.24±1.25a | 8.45±0.84a | 56.45±3.81a |
| 无 | 13 | 6.15±2.01 | 7.50±1.20 | 48.50±3.63 |
| 包膜 | ||||
| 有 | 35 | 6.82±1.64 | 7.48±1.45 | 49.64±3.87 |
| 无/不完整 | 14 | 7.79±1.85a | 8.39±1.13a | 59.50±4.06a |
| 病理分级 | ||||
| Ⅰ-Ⅱ | 38 | 7.55±1.60 | 7.85±1.26 | 52.26±2.89 |
| Ⅲ-Ⅳ | 11 | 7.84±1.94 | 8.02±0.95 | 54.67±3.36 |
| AFP (μg/L) | ||||
| ≤50 | 14 | 7.28±2.10 | 8.05±0.85 | 51.67±3.46 |
| >50 | 35 | 7.45±1.78 | 8.23±1.85 | 52.14±4.22 |
本研究结果显示人正常肝组织无EIF-5A2表达, 而HCC组织中有EIF-5A2表达, 癌周缘EIF-5A2表达明显强于癌体中央, 提示肿瘤侵袭的前沿细胞中EIF-5A2合成较多. 统计学分析结果显示门脉癌栓形成、包膜不完整的HCC组织EIF-5A2表达明显高于无门脉癌栓形成及有包膜的HCC组织, 表明EIF-5A2表达与HCC的发展及转移有关. 血管生成在肿瘤生长及转移过程中起关键作用, 其提供丰富的营养, 为肿瘤的浸润及转移创造条件. 肿瘤细胞释放的促血管生成因子可作用于内皮细胞, 促进新血管的生成, 其中VEGF是目前公认的直接参与新血管生成的因子, 能刺激血管内皮细胞增殖、降解血管外基质, 导致内皮细胞分裂、迁移, 形成大量新生血管, 满足肿瘤不断生长的需要[10]. HCC是富血管肿瘤, 其特点为易侵犯门脉系统、早期发生播散和转移[11,12]. 鉴于EIF-5A2在HCC中的表达特点, 本研究进一步探讨了HCC中血管生成因子VEGF表达及MVD与EIF-5A2表达的关系. 大量研究证实VEGF与HCC生长、转移和新生血管形成关系密切[13,14]. 正常情况下, VEGF广泛分布于人体许多组织中以维持正常血管密度和营养物质的供应, 但其表达水平低, 普通方法难以测出, 与之相比多数恶性肿瘤存在VEGF高表达[15], 这与本实验观察到的VEGF在HCC组织及正常肝组织中的表达情况一致. 本实验中HCC组织VEGF表达定位及强度趋势与EIF-5A2非常接近, 多数EIF-5A2高表达的HCC组织尤其是肿瘤周边的EIF-5A2高表达细胞其VEGF也同样高表达, 而EIF-5A2阴性或弱表达组织其VEGF表达也弱, 二者之间呈正相关, 提示EIF-5A2可能与VEGF调控有关. MVD是反映恶性肿瘤侵袭和转移等生物学行为的一个重要指标[9,10], 通常以抗CD34抗体标记肝癌新生血微血管内皮细胞来计算MVD[16]. 许多研究显示肝癌组织中的MVD与肿瘤的转移及复发相关[9]. 本研究采用CD34免疫组织化学染色计数肝癌的MVD, 结果显示高分化及低分化的HCC组织中MVD差异显著, 即分化越差, MVD计数越高, 说明HCC微血管生成与其本身生物学特征有关. 统计学分析结果显示MVD计数与EIF-5A2表达程度正相关, 即EIF-5A2高表达的瘤组织MVD计数高, 提示EIF-5A2表达与微血管形成密切相关. EIF是细胞蛋白合成过程中的一个上游调控因子, 细胞快速增长及分裂的启动有赖于蛋白合成酶系统活性的上调. 细胞内大量生长相关基因的mRNA表达受严格的翻译后调控, 任何翻译因子表达水平的微小变化都会打破平衡, 使各种蛋白表达量发生改变而引起细胞生物学行为的变化[17]. 作为EIF-5A家族成员, EIF-5A2蛋白表达上调可能会引起其他肿瘤相关因子如VEGF的表达增强, 继而产生相应的细胞生物学改变如癌细胞无限增殖、血管形成等. 此外本研究显示MVD计数与HCC包膜完整性及癌栓的生成有关, 此结果与以往的研究报道一致, 进一步说明EIF-5A2、VEGF及MVD之间的关系密切. 目前阻断肿瘤血管形成已成为临床肿瘤治疗研究的热点, 如何选择有效的治疗靶点阻断肿瘤新生血管形成是亟待解决的问题. 本研究结果显示EIF-5A2作为蛋白EIF, 在肝癌有特异性表达, 且与VEGF表达及MVD密切相关, 有望成为阻断HCC血管形成的有效靶点.
真核生物翻译起始因子-5A2(EIF-5A2)为人卵巢癌UACC-1598细胞3q26.2高扩增区段内新发现的癌基因, 属EIF-5A家族, 其在大部分正常组织内无表达, 而在肿瘤组织内特异性表达, 研究发现其高表达与卵巢癌的临床分期密切相关.
刘平, 教授, 南京医科大学第一附属医院肿瘤科
HCC生长快、转移早、死亡率高. 血管生成是HCC恶性化的第一步, 目前阻断HCC血管生成已成为临床治疗的热点, 因此以血管生成信号传导通路为靶向的抗血管治疗是颇具潜力的、抗HCC浸润、转移和术后复发的治疗方法.
有研究对多种腺癌的原发灶、转移灶差异表达基因进行比较, 发现有17种差异表达基因与转移有关, 其中包括在EIF-5A及EIF-5A2的赖氨酸修饰中起关键作用的DHPS.
本研究用免疫组织化学方法观察EIF-5A2在HCC的表达, 探讨了EIF-5A2表达与HCC内VEGF表达、MVD及其临床病理特征之间的关系. 为研究EIF-5A2在HCC中的作用机制提供了一定理论基础.
本研究证实, EIF-5A2表达与VEGF表达及MVD呈正相关, 与HCC组织血管侵犯和转移倾向有关. 为更深入研究EIF-5A2的作用机制, 寻找新的肿瘤预后诊断标记、设计有效的肿瘤治疗靶点提供理论依据.
本文研究了EIF-5A2在肝细胞癌中的表达及其与VEGF、MVD的关系, 方法较为单一, 有一定的科学性和可读性.
编辑: 李军亮 电编:何基才
| 1. | Guan XY, Sham JS, Tang TC, Fang Y, Huo KK, Yang JM. Isolation of a novel candidate oncogene within a frequently amplified region at 3q26 in ovarian cancer. Cancer Res. 2001;61:3806-3809. [PubMed] |
| 2. | Jansson BP, Malandrin L, Johansson HE. Cell cycle arrest in archaea by the hypusination inhibitor N(1)-guanyl-1,7- diaminoheptane. J Bacteriol. 2000;182:1158-1161. [PubMed] [DOI] |
| 3. | Lee Y, Kim HK, Park HE, Park MH, Joe YA. Effect of N1-guanyl-1,7-diaminoheptane, an inhibitor of deoxyhypusine synthase, on endothelial cell growth, differentiation and apoptosis. Mol Cell Biochem. 2002;237:69-76. [PubMed] [DOI] |
| 4. | Guan XY, Fung JM, Ma NF, Lau SH, Tai LS, Xie D, Zhang Y, Hu L, Wu QL, Fang Y. Oncogenic role of eIF-5A2 in the development of ovarian cancer. Cancer Res. 2004;64:4197-4200. [PubMed] [DOI] |
| 5. | Xie D, Ma NF, Pan ZZ, Wu HX, Liu YD, Wu GQ, Kung HF, Guan XY. Overexpression of EIF-5A2 is associated with metastasis of human colorectal carcinoma. Hum Pathol. 2008;39:80-86. [PubMed] [DOI] |
| 6. | Wood JM, Bold G, Buchdunger E, Cozens R, Ferrari S, Frei J, Hofmann F, Mestan J, Mett H, O'Reilly T. PTK787/ZK 222584, a novel and potent inhibitor of vascular endothelial growth factor receptor tyrosine kinases, impairs vascular endothelial growth factor-induced responses and tumor growth after oral administration. Cancer Res. 2000;60:2178-2189. [PubMed] |
| 7. | Clement PM, Hanauske-Abel HM, Wolff EC, Kleinman HK, Park MH. The antifungal drug ciclopirox inhibits deoxyhypusine and proline hydroxylation, endothelial cell growth and angiogenesis in vitro. Int J Cancer. 2002;100:491-498. [PubMed] [DOI] |
| 8. | Weidner N. Current pathologic methods for measuring intratumoral microvessel density within breast carcinoma and other solid tumors. Breast Cancer Res Treat. 1995;36:169-180. [PubMed] [DOI] |
| 9. | Tanigawa N, Lu C, Mitsui T, Miura S. Quantitation of sinusoid-like vessels in hepatocellular carcinoma: its clinical and prognostic significance. Hepatology. 1997;26:1216-1223. [PubMed] |
| 10. | Kraft A, Weindel K, Ochs A, Marth C, Zmija J, Schumacher P, Unger C, Marmé D, Gastl G. Vascular endothelial growth factor in the sera and effusions of patients with malignant and nonmalignant disease. Cancer. 1999;85:178-187. [PubMed] [DOI] |
| 12. | Rampone B, Schiavone B, Martino A, Viviano C, Confuorto G. Current management strategy of hepatocellular carcinoma. World J Gastroenterol. 2009;15:3210-3216. [PubMed] [DOI] |
| 13. | Jinno K, Tanimizu M, Hyodo I, Nishikawa Y, Hosokawa Y, Doi T, Endo H, Yamashita T, Okada Y. Circulating vascular endothelial growth factor (VEGF) is a possible tumor marker for metastasis in human hepatocellular carcinoma. J Gastroenterol. 1998;33:376-382. [PubMed] [DOI] |
| 14. | El-Assal ON, Yamanoi A, Soda Y, Yamaguchi M, Igarashi M, Yamamoto A, Nabika T, Nagasue N. Clinical significance of microvessel density and vascular endothelial growth factor expression in hepatocellular carcinoma and surrounding liver: possible involvement of vascular endothelial growth factor in the angiogenesis of cirrhotic liver. Hepatology. 1998;27:1554-1562. [PubMed] [DOI] |
| 15. | Yoshiji H, Kuriyama S, Yoshii J, Yamazaki M, Kikukawa M, Tsujinoue H, Nakatani T, Fukui H. Vascular endothelial growth factor tightly regulates in vivo development of murine hepatocellular carcinoma cells. Hepatology. 1998;28:1489-1496. [PubMed] [DOI] |
| 17. | Hershey JWB, Miyamoto S. Translational control and cancer. Translational Control of Gene Expression. New York: Cold Spring, Harbor Laboratory Press 2000; 637-654. |