修回日期: 2009-11-25
接受日期: 2009-11-30
在线出版日期: 2010-01-18
目的: 探讨ABCG2拮抗剂-尼卡地平在体外安全剂量下能否逆转耐药, 为临床应用提供实验基础.
方法: 采用噻唑蓝法(MTT)测定尼卡地平对Patu8988亲本和耐药细胞的安全使用浓度, 测定单用培美曲塞和联合安全剂量的尼卡地平分别对两株细胞的IC50变化; 分别采用DAPI核染色和细胞流式分析在耐药细胞中单用培美曲塞组和联合尼卡地平组凋亡差异.
结果: MTT结果显示尼卡地平在浓度<4.85 μmol/L(2.5 mg/L)时对细胞基本无不良反应. 单用培美曲塞和联合安全剂量的尼卡地平对Patu8988亲本株细胞IC50无明显差异, 而对耐药株细胞IC50有差异(P<0.05). 流式细胞分析在耐药细胞中联合尼卡地平组凋亡比例高于单用培美曲塞组(32.27%±2.8% vs 50.5%±4.2%, P<0.05).
结论: 安全剂量下尼卡地平能提高胰腺癌Patu8988耐药细胞株对培美曲塞的敏感性, 而对其亲本株无作用.
引文著录: 杨军, 石欣, 严伟, 林士波, 顾海涛, 钱程佳. 尼卡地平对胰腺癌Patu8988株培美曲塞耐药的逆转作用. 世界华人消化杂志 2010; 18(2): 132-136
Revised: November 25, 2009
Accepted: November 30, 2009
Published online: January 18, 2010
AIM: To investigate whether safe doses of nicardipine, an antagonist of ATP-binding cassette subfamily G member 2 (ABCG2), can reverse the resistance of human pancreatic carcinoma Patu8988 cell line to pemetrexed.
METHODS: The maximal safe dose of nicardipine for pemetrexed-resistant Patu8988 strain and its parent strain was determined by methyl thiazoly tetrazolium (MTT) assay. The half maximal inhibitory concentrations (IC50) of pemetrexed alone and in combination with nicardipine for the growth of the two cell strains were measured also by MTT assay. The apoptosis rates of the two cell strains were examined using DAPI nuclear staining and flow cytometry.
RESULTS: MTT analysis showed that the maximal safe dose of nicardipine for Patu8988 strains was 4.85 μmol/L (2.5 mg/L). Although there was no significant difference in the IC50 value in parental Patu8988 cell strain between pemetrexed alone and pemetrexed in combination with safe doses of nicardipine, a significant difference was noted in the IC50 value in drug-resistant Patu8988 strain (P < 0.05). Flow cytometry analysis showed that the apoptosis rate of drug-resistant cells treated with pemetrexed in combination with nicardipine was higher than that of cells treated with pemetrexed alone (32.27% ± 2.8% vs 50.5% ± 4.2%, P < 0.05).
CONCLUSION: Nicardipine at safe doses can increase the sensitivity of drug-resistant Patu8988 cell strain to pemetrexed, but has no significant effect in parental Patu8988 strain.
- Citation: Yang J, Shi X, Yan W, Lin SB, Gu HT, Qian CJ. Nicardipine reverses the resistance of human pancreatic carcinoma Patu8988 cell line to pemetrexed. Shijie Huaren Xiaohua Zazhi 2010; 18(2): 132-136
- URL: https://www.wjgnet.com/1009-3079/full/v18/i2/132.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i2.132
胰腺癌发生多药耐药是导致胰腺癌化疗效果差的一个重要原因, 而多药耐药发生的原因至今是国内外学者研究的一个热点, 其中已被证明ABC多药转运家族在其中发挥了巨大的作用[1], 而针对该家族中的某些基因采取拮抗剂治疗的相关研究尚处于起步状态. 本实验室前期通过体外5次大剂量冲击诱导法经过约5 mo成功诱导出对培美曲塞耐药的胰腺癌Patu8988细胞株[2](IC50 = 2.9倍), 通过Affymetrix基因芯片比对分析发现2000余与耐药相关基因的变化, 经过筛选发现ABC家族中ABCG2、ABCC2、MDR1等基因均有不同程度的提高, 进一步采取RT-PCR及Wersten blot检测发现耐药株中ABCG2的表达提高最为明显, 是其亲本株的2.5倍. 本研究旨在针对变化最明显的耐药基因ABCG2采取拮抗剂进行逆转实验, 为临床应用提供实验基础.
人胰腺癌Patu8988株及其经培美曲塞诱导产生的耐药细胞株细胞, 由东南大学医学院中心实验室所保存提供. 高糖DMEM培养基、胎牛血清、胰酶等购于Gibco公司. 培美曲塞为法国礼来公司(Lilly)产品(批号: A512938H). 盐酸尼卡地平注射液(佩尔): 日本山之内制药株式会社(批号: Y001Y01). MTT、DMSO: 美国Sigma公司产品. Annexin V-FITC/PI凋亡检测试剂盒及DAPI试剂盒: 南京凯基生物科技发展有限公司. 美国伯乐公司BIO-RAD550酶联免疫检测仪. 美国BD公司FACSCalibur流式细胞仪. 日本Olympus公司MF51倒置荧光显微镜.
1.2.1 人胰腺癌细胞体外培养: 人胰腺癌细胞Patu8988株及耐药细胞株培养于含100 mL/L胎牛血清的高糖DMEM培养液, 常规培养于37 ℃、50 mL/L CO2的培养箱中, 细胞单层贴壁生长, 至70%-80%融合时胰蛋白酶消化传代.
1.2.2 MTT法测定尼卡地平对胰腺癌Patu8988亲本株及耐药株细胞的不良反应: 将细胞按5×103个/孔分别接种于96孔板, 设6副孔, 8 h后每孔分别加入0-194 μmol/L(0-100 mg/L)的尼卡地平, 继续培养48 h后, 每孔加入MTT溶液20 μL, 37 ℃继续孵育4 h, 吸弃孔内培养上清液, 每孔加入150 μL DMSO, 振荡10 min, 在BIO-RAD550酶联免疫检测仪上测定各孔570 nm波长处吸光度(A)值, 再用SPSS15.0统计软件包计算出IC50. 实验重复3次. 公式: 抑制率 = 1-加药组A值/对照组A值.
1.2.3 MTT法测定单用培美曲塞及联合安全剂量的尼卡地平对胰腺癌Patu8988亲本株及耐药株细胞IC50的变化: 方法同1.2.2. 8 h后每孔分别加入0-5 000 μmol/L(0-3 000 mg/L)的培美曲塞, 联合用药组另加入4.85 μmol/L(2.5 mg/L)的尼卡地平(阴性对照孔除外). 实验重复3次.
1.2.4 DAPI法观察耐药株细胞组别内凋亡细胞形态并计数: 24孔板内每孔加入500 μL培养液, 内含2×104个对培美曲塞耐药Patu8988株细胞, 设4组, 每组3副孔. 8 h后待细胞贴壁后分别加入总量20 μL的生理盐水、尼卡地平(终浓度4.85 μmol/L)、培美曲塞(终浓度300 μmol/L)、培美曲塞+尼卡地平(终浓度同前), 继续抚育生长48 h; PBS洗涤后滴加DAPI, 室温下暗处10 min; PBS漂洗3 min×3次; 荧光显微镜下(×200倍)每孔随机计3个视野细胞, 观察、成像; 统计每视野凋亡细胞平均数(包括早、中、晚3期).
1.2.5 流式细胞分析耐药株细胞各组凋亡细胞比例: 对培美曲塞耐药Patu8988株细胞平均传代至4个25 mL培养瓶, 每瓶含培养液2 mL, 细胞数约1×105个. 8 h后分别加入80 μL生理盐水、尼卡地平、培美曲塞、培美曲塞+尼卡地平(终浓度同上). 48 h后用不含EDTA的胰酶消化离心, 倒去上清液, 用500 μL Binding Buffer悬浮细胞; 转入EP管内; 加入5 μL Annexin V-FITC及Propidium Iodide, 室温避光反应10 min; 荧光显微镜下检测. 实验重复3次.
统计学处理 数据以mean±SD表示, 采用SPSS15.0统计软件进行数据分析, 配对资料采用t检验, P<0.05表示有显著性差异.
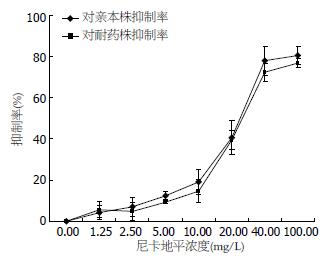
尼卡地平在低浓度(<2.5 mg/L)对此细胞无明显抑制作用, 随着浓度的增高对细胞的不良反应渐提升(图1).
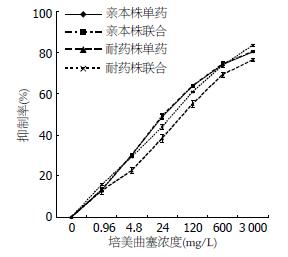
胰腺癌Patu8988株细胞在单加培美曲塞及联合尼卡地平时IC50分别为72.96 mg/L±4.67 mg/L、72.36 mg/L±5.42 mg/L(P>0.05); 而在对培美曲塞耐药株细胞组分别为158.36 mg/L±34.29 mg/L、77.72 mg/L±3.64 mg/L(P<0.05, 图2).
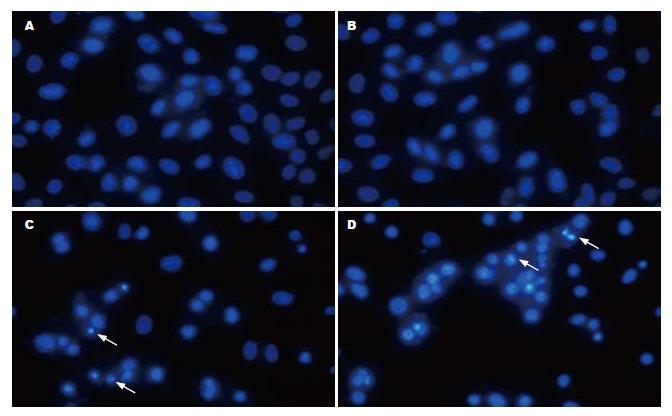
耐药株细胞在对照组及单加尼卡地平组中细胞核形态规则, 未见明显凋亡核形态; 在单加培美曲塞组及联合尼卡地平组均可见部分细胞核呈波纹状、染色质高度凝聚, 少数细胞核裂解为碎块, 产生凋亡小体(图3). 计数凋亡细胞平均数, 4组分别为0.89±0.60、1.00±0.71、11.44±3.28、22.67±4.27, 联合尼卡地平可增加耐药株细胞对培美曲塞的敏感性, 增加凋亡.
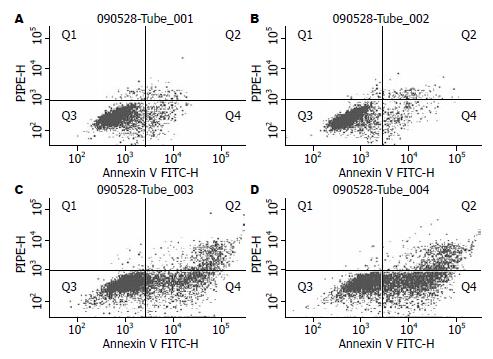
耐药株细胞在对照组、单加尼卡地平组、单加培美曲塞、联合尼卡地平组中细胞凋亡比例分别为4.83%±2.14%、6.43%±2.53%、32.27%±2.8%、50.5%±4.2%, 其中在对照组、单加尼卡地平组凋亡比例无明显差异(P>0.05), 单加培美曲塞、联合尼卡地平组中凋亡比例有差异(P<0.05, 表1). 联合尼卡地平能部分逆转耐药细胞株对培美曲塞的抵抗能力, 实验结果见图3, 4.
| 分组 | 凋亡比例(%) | P值 | ||
| 第1次 | 第2次 | 第3次 | ||
| 对照组 | 2.4 | 5.7 | 6.4 | >0.05 |
| 2.5 mg/L尼卡地平组 | 3.7 | 8.7 | 6.9 | |
| 180 mg/L培美曲塞组 | 30.0 | 31.4 | 35.4 | <0.05 |
| 2.5 mg/L尼卡地平+ | 50.7 | 46.2 | 54.6 | |
| 180 mg/L培美曲塞组 | ||||
胰腺癌是人类最致命的恶性肿瘤之一, 预后极差, 5年生存率约0.4%-5%. 手术能提高5年生存率至20%左右, 然而只有10%-20%患者有手术机会[3]. 化疗是胰腺癌术后重要的辅助治疗手段. 培美曲塞(pemetrexed)是2004年美国食品与药品管理局批准应用于临床一种多靶点抗叶酸合成的药物, 基础研究显示, 培美曲塞能抑制胰腺癌细胞的增殖, 与吉西他滨联合对抑制胰腺癌细胞生长具协同作用[4]. Ⅱ期的临床研究表明, 培美曲塞对晚期胰腺癌疗效突出, 且不良反应小[5]. 用培美曲塞作为二线化疗药物, 能显著提高患者的生存时间, 改善预后[6]. 然而, 虽然新的化疗药物不断被开发出来, 多药耐药(multidrug resistance, MDR)却始终是引起化疗效果下降肿瘤治疗失败的首要原因. 前期本实验室成功诱导出对培美曲塞耐药的胰腺癌Patu8988细胞株[2], 通过Affymetrix基因芯片初筛比对分析发现其中多药转运蛋白家族(ATP binding cassette蛋白超家族, ABC蛋白超家族)表达变化显著. 经过进一步的鉴定发现其中ABCG2的提高最为明显. ABCG2介导多种物质转运, 是多种化疗药物的转运媒介, 他的变化与化疗效果密切相关[7-9]. 目前临床上用来克服耐药的方法一般有2个: 一是选择患者敏感的药物、加大化疗药物的剂量; 二是联合应用多药耐药逆转剂. 通常因为条件限制, 医生很难通过体外实验选取最敏感药物, 而采取经典或经验用药, 有时化疗效果不理想可能需加大用药或联合几种化疗药物, 这可能提高患者出现各种严重的并发症的几率, 所以联合使用逆转剂已成为肿瘤耐药逆转研究的发展趋势. 尼卡地平是临床上常用、不良反应很小的钙离子拮抗剂, 被运用于高血压的治疗, 研究发现他对于ABCG2也有拮抗作用. Shukla等[10]利用光亲和标记的方法发现尼卡地平作用于ABCG2底物结合位点, 作为反应底物起竞争性抑制其转运功能. 其逆转机制可能为阻断化疗药物通过ABCG2转运蛋白泵出细胞, 提高细胞内化疗药物浓度. Zhou等[11]利用尼卡地平等(1, 4-二氢吡啶类钙离子阻滞剂)与米托蒽醌体外联合作用于高表达ABCG2的对米托蒽醌耐药的乳腺癌MCF-7/MX100细胞株和非小细胞性肺癌H460/MX20后发现细胞内的米托蒽醌积累是单用米托蒽醌的4.5倍, 之后小鼠实验也得出相似的结果. 姚进等[12]分别通过体内和体外两个实验联合尼卡地平和尼莫司汀作用于高表达ABCG2耐药基因的神经胶质瘤结果显示联合用药提高了对胶质瘤细胞的杀伤、促进凋亡和延长荷瘤鼠生存期. 基于上述考虑: 尼卡地平可能是临床上潜在的化疗耐药逆转剂. 本实验研究尼卡地平逆转对培美曲塞耐药胰腺癌Patu8988株耐药的结果证实其作用. 作为逆转剂, 药物应具有逆转作用而本身又无细胞毒性作用. MTT实验结果显示, 尼卡地平<4.85 μmol/L(2.5 mg/L)时对细胞基本无毒性作用, 在这浓度下不能增强培美曲塞对Patu8988亲本细胞株的杀伤作用, 但能明显增强培美曲塞对高表达ABCG2的Patu8988耐药细胞株的杀伤作用. DAPI染色实验及流式细胞学结果显示, 联合用药组细胞凋亡比例明显高于单药组(P<0.05). 这可能为临床联合应用耐药逆转剂提供了一种实验基础. 总之, 化疗药物与耐药逆转剂的联合应用, 既可避免增加化疗药物剂量后造成的不良反应, 又增强了耐药肿瘤细胞的敏感性, 他具有临床应用广阔的前景.
多药耐药严重影响胰腺癌的化疗效果, 目前对胰腺癌耐药机制的研究是一大热点, 其中ABC多药转运蛋白家族正越来越被重视, 该家族成员主要作用之一是载运各种化疗药物排出细胞, 肿瘤细胞高表达该家族成员往往预示着化疗药物在该细胞内的浓度不易积聚, 即不易达到作用浓度而导致耐药发生. 二氢吡啶类钙离子阻滞剂(尼卡地平等)作用于底物结合位点, 与化疗药物起竞争性作用, 这就为逆转耐药提供了可能的方法.
唐文富, 副主任医师, 四川大学华西医院中西医结合科
Zhou等利用尼卡地平等(1, 4-二氢吡啶类钙离子阻滞剂)与米托蒽醌体外联合作用于高表达ABCG2的对米托蒽醌耐药的乳腺癌MCF-7/MX100细胞株和非小细胞性肺癌H460/MX20后发现细胞内的米托蒽醌积累是单用米托蒽醌的4.5倍, 之后小鼠实验也得出相似的结果. 姚进等分别通过体内和体外2个实验联合尼卡地平和尼莫司汀作用于高表达ABCG2 耐药基因的神经胶质瘤结果显示联合用药提高了对胶质瘤细胞的杀伤、促进凋亡和延长荷瘤鼠生存期.
本研究从凋亡角度应用MTT、凋亡核染色及流式细胞分析验证安全剂量下的尼卡地平能成功提高胰腺癌Patu8988耐药株细胞对培美曲塞的敏感性.
本研究发现尼卡地平能提高Patu8988耐药细胞株对培美曲塞的敏感性, 可能为临床应用提供了实验基础.
本文对尼卡地平对胰腺癌Patu8988株培美曲塞耐药的逆转作用进行研究, 结论可靠, 学术价值较好, 但实验尚需进一步研究.
编辑: 李军亮 电编:何基才
| 1. | Sharom FJ. ABC multidrug transporters: structure, function and role in chemoresistance. Pharmacogenomics. 2008;9:105-127. [PubMed] [DOI] |
| 3. | Budiharto T, Haustermans K, Van Cutsem E, Van Steenbergen W, Topal B, Aerts R, Ectors N, Bielen D, Vanbeckevoort D, Goethals L. A phase I radiation dose-escalation study to determine the maximal dose of radiotherapy in combination with weekly gemcitabine in patients with locally advanced pancreatic adenocarcinoma. Radiat Oncol. 2008;3:30. [PubMed] [DOI] |
| 4. | Giovannetti E, Mey V, Danesi R, Mosca I, Del Tacca M. Synergistic cytotoxicity and pharmacogenetics of gemcitabine and pemetrexed combination in pancreatic cancer cell lines. Clin Cancer Res. 2004;10:2936-2943. [PubMed] [DOI] |
| 5. | Miller KD, Picus J, Blanke C, John W, Clark J, Shulman LN, Thornton D, Rowinsky E, Loehrer PJ Sr. Phase II study of the multitargeted antifolate LY231514 (ALIMTA, MTA, pemetrexed disodium) in patients with advanced pancreatic cancer. Ann Oncol. 2000;11:101-103. [PubMed] [DOI] |
| 6. | Boeck S, Weigang-Köhler K, Fuchs M, Kettner E, Quietzsch D, Trojan J, Stötzer O, Zeuzem S, Lordick F, Köhne CH. Second-line chemotherapy with pemetrexed after gemcitabine failure in patients with advanced pancreatic cancer: a multicenter phase II trial. Ann Oncol. 2007;18:745-751. [PubMed] [DOI] |
| 7. | Ishikawa T, Nakagawa H. Human ABC transporter ABCG2 in cancer chemotherapy and pharmacogenomics. J Exp Ther Oncol. 2009;8:5-24. [PubMed] |
| 8. | Hegedus C, Szakács G, Homolya L, Orbán TI, Telbisz A, Jani M, Sarkadi B. Ins and outs of the ABCG2 multidrug transporter: an update on in vitro functional assays. Adv Drug Deliv Rev. 2009;61:47-56. [PubMed] [DOI] |
| 9. | Polgar O, Robey RW, Bates SE. ABCG2: structure, function and role in drug response. Expert Opin Drug Metab Toxicol. 2008;4:1-15. [PubMed] [DOI] |
| 10. | Shukla S, Robey RW, Bates SE, Ambudkar SV. The calcium channel blockers, 1,4-dihydropyridines, are substrates of the multidrug resistance-linked ABC drug transporter, ABCG2. Biochemistry. 2006;45:8940-8951. [PubMed] [DOI] |
| 11. | Zhou XF, Yang X, Wang Q, Coburn RA, Morris ME. Effects of dihydropyridines and pyridines on multidrug resistance mediated by breast cancer resistance protein: in vitro and in vivo studies. Drug Metab Dispos. 2005;33:1220-1228. [PubMed] [DOI] |