修回日期: 2009-11-20
接受日期: 2009-11-30
在线出版日期: 2010-01-18
目的: 探讨QHF复方联合小剂量化疗药物顺铂(DDP)对小鼠H22肝癌血管生成的影响, 观察其抑瘤效果和不良反应.
方法: 48只BALB/c小鼠右腋皮下注射小鼠H22肝癌细胞建立荷瘤模型, 随机分设为QHF复方组、小剂量DDP、联合用药组(QHF+DDP)及生理盐水组(NS). 以抑瘤率为指标, 观察各药物对荷瘤小鼠肿瘤生长的抑制作用; 以小鼠的一般状况及脾指数为指标, 观察各药物对荷瘤小鼠的不良反应; 光镜观察肿瘤组织形态; 免疫组织化学方法检测各药物对小鼠肝癌组织中的微血管密度(MVD).
结果: QHF组、DDP组和联合用药组的瘤质量均较NS对照组明显降低(0.63 g±0.16 g, 0.45 g±0.23 g, 0.33 g±0.15 g vs 1.22 g±0.22 g, 均P<0.01), 联合用药组较QHF组显著降低(P<0.01). 抑瘤率分别为47.45%、63.11%和72.95%. QHF组、DDP组和联合用药组小鼠移植瘤组织内的MVD数量较NS对照组明显降低(11.00±1.56, 10.33±1.49, 6.87±0.97 vs 19.93±1.02, 均P<0.01); 联合用药组与各单药组相比明显降低(均P<0.01). QHF与DDP联合应用组的不良反应较单用DDP组轻, 生存质量较好.
结论: QHF复方与小剂量DDP均具有抗肝癌血管生成的作用; QHF复方与小剂量DDP联合应用具有协同抗肝癌血管生成的作用, 同时QHF复方具有提高生存质量和降低化疗药物不良反应的作用.
引文著录: 陈涛, 付亚玲, 巩仔鹏, 邓李蓉, 胡月琴. QHF复方联合小剂量顺铂对小鼠H22肝癌血管生成的抑制作用. 世界华人消化杂志 2010; 18(2): 113-118
Revised: November 20, 2009
Accepted: November 30, 2009
Published online: January 18, 2010
AIM: To investigate the effects of QHF formula in combination with low-dose cisplatin (DDP) on tumor angiogenesis and growth in H22 hepatocellular carcinoma in mice and observe their toxic reactions.
METHODS: Forty-eight BALB/c mice were inoculated with mouse hepatocellular carcinoma H22 cells in the right axillary skin to establish a mouse model of H22 hepatocellular carcinoma. The model mice were randomly divided into four groups: QHF group, DDP group, QHF plus DDP group and normal saline (NS) group. The inhibitory effects of these drugs on tumor growth were evaluated by calculating the reduced rate of tumor growth. The toxicity of these drugs was examined by observing the general condition of mice and the spleen index. The morphological changes of tumor cells were observed under an optical microscope. The microvessel density (MVD) in tumor tissue was evaluated by immunohistochemistry.
RESULTS: The tumor weight was significantly lower in the QHF group, DDP group, and QHF plus DDP group than in the NS group (0.63 g ± 0.16 g, 0.45 g ± 0.23 g and 0.33 g ± 0.15 g vs 1.22 g ± 0.22 g, respectively; all P < 0.01), while the tumor weight was significantly higher in the QHF group than in the QHF plus DDP group (P < 0.01). The reduced rates of tumor growth in the QHF group, DDP group and QHF plus DDP group were 47.45%, 63.11% and 72.95%, respectively. The MVD in tumor tissue was significantly lower in the QHF group, DDP group, and QHF plus DDP group than in the NS group (11.00 ± 1.56, 10.33 ± 1.49 and 6.87 ± 0.97 vs 19.93 ± 1.02, respectively; all P < 0.01). Compared with the QHF group and DDP group, the MVD was significantly lower in the QHF plus DDP group (both P < 0.01). Furthermore, a lower incidence of toxic reactions and a better quality of survival were observed in the QHF plus DDP group than in the DDP group.
CONCLUSION: Both of QHF and small-dose DDP have anti-angiogenic effects in H22 hepatocellular carcinoma in mice. QHF in combination with small-dose DDP has synergistic anti-angiogenic effects and can improve the quality of survival and reduce the incidence of toxic reactions in mice bearing H22 hepatocellular carcinoma.
- Citation: Chen T, Fu YL, Gong ZP, Deng LR, Hu YQ. QHF formula in combination with low-dose cisplatin inhibits angiogenesis in H22 hepatocellular carcinoma in mice. Shijie Huaren Xiaohua Zazhi 2010; 18(2): 113-118
- URL: https://www.wjgnet.com/1009-3079/full/v18/i2/113.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i2.113
肝细胞癌(hepatocellular carcinoma, HCC)是临床常见的恶性肿瘤之一, 术后复发和转移率极高, 目前尚缺乏有效的治疗药物. 肝癌作为一种多血管肿瘤, 肿瘤新生血管在其发生、侵袭和转移复发过程中发挥重要作用. 因此抑制血管形成在抗肝肿瘤的研究中意义重大. 目前, 已有研究表明, 持续低剂量化疗给药, 可以靶向作用于肿瘤微血管, 达到抑制肿瘤血管生成的作用, 并具有不良反应小和不易产生耐药的优点[1], 而在合用另一种抗血管生成药物时抑制肿瘤血管生成的作用则更为明显[2]. QHF复方(华蟾素800 mg/kg、人参皂甙Rg3 14 mg/kg、三七总皂甙5.5 mg/kg、香菇多糖100 mg/kg)是我们根据肝癌"瘀"、"毒"、"虚"的病机特点, 通过动物实验, 采用均匀设计法筛选得到的组方. 研究表明QHF复方具有良好的抗肝癌作用, 与化疗药物合用具有显著的减毒、增效作用[3]. 据文献报道[4-7], QHF复方中的人参皂甙Rg3、华蟾素及香菇多糖均有抑制肿瘤血管生成的作用. 据此我们推测QHF复方也可以通过抑制肿瘤血管生成而发挥抗肿瘤作用. 顺铂为广谱抗癌药, 国内外有许多用其对肿瘤小剂量节律化疗的报道[8,9], 效果较好. 本文以H22荷瘤小鼠为动物模型, 观察QHF复方联合小剂量顺铂对小鼠H22肝癌血管生成的影响及抑瘤效果和不良反应, 初步探讨其对肝癌的治疗价值.
BALB/c纯系小鼠, 清洁级, ♂, 周龄4-6 wk, 体质量20 g±2 g, 共48只, 由湖北省实验动物中心提供. 小鼠肝癌H22细胞由本校免疫教研室保存, 以腹水型传代保种, 第3代用于实验. 注射用顺铂(冻干型), 购自锦州九泰药业有限责任公司. 华蟾素片, 购自安徽金蟾生化股份有限公司. 参一胶囊(人参皂甙Rg3), 购自吉林亚泰制药有限公司. 血塞通片(三七总皂苷), 购自云南省玉溪市维和制药有限公司. 香菇多糖片, 购自浙江金华埃森药业有限公司. 以上各药物使用前均用灭菌生理盐水稀释至一定浓度. 兔抗鼠CD34 mAb、即用型免疫组织化学试剂盒(SABC试剂盒)及DAB显色剂均购自武汉博士德生物工程有限公司. 电子分析天平(MP200A型), 上海良平仪器厂生产. 光学显微镜, 日本Olympus公司生产. 石蜡包埋机(EG1150型), 德国Leica公司生产. 石蜡切片机: (ULTRACUT-R型), 德国Leica公司生产. 多功能显微镜及测量系统: (DM-R型), 德国Leica公司生产. 电热恒温鼓风干燥箱(GZX-9070MBE型), 上海博迅实业有限公司生产.
1.2.1 造模: 肝癌H22细胞株BALB/c小鼠体内连续传代3代后, 抽取接种7 d左右种鼠腹水, 呈乳白色, D-Hanks液洗涤离心(800 r/min, 5 min)2次, 调整细胞浓度至5.0×106个/mL, 台盼蓝拒染法检测存活率≥95%, 将细胞悬液注射至健康BALB/c小鼠右腋皮下, 每只0.2 mL, 建立实体瘤模型. 全程严格无菌操作, 1 h内完成.
1.2.2 分组及给药: 小鼠造模后第3天, 随机分为4组, 每组12只. NS组: 每只小鼠予生理盐水0.4 mL灌胃, 同时予生理盐水0.2 mL腹腔注射; QHF复方组予以下4种药物[华蟾素800 mg/kg, 人参皂甙Rg3 14 mg/kg, 三七总皂甙5.5 mg/kg, 香菇多糖100 mg/kg(配比1)]各0.1 mL总共0.4 mL灌胃, 同时予0.2 mL生理盐水腹腔注射, 每日1次, 连续给药10 d; 小剂量DDP组: 予生理盐水0.4 mL灌胃, 同时予DDP 0.2 mL(剂量2 mg/kg)腹腔注射; DDP+QHF组: 给予QHF 0.4 mL灌胃, 同时予DDP 0.2 mL腹腔注射. 以上给药均为每日1次, 连续10 d.
1.2.3 一般状况观察: 给药期间每日密切观察小鼠的外观毛色、精神状态、活动及饮食等情况.
1.2.4 脾指数: 末次给药24 h后, 颈椎脱臼法处死小鼠, 完整剥离脾组织, 电子天平上称质量, 按下列公式计算脾指数: 脾指数 = 脾质量(mg)/小鼠体质量(g).
1.2.5 瘤质量及抑瘤率: 末次给药24 h后, 颈椎脱臼法处死小鼠, 完整剥离肿瘤组织, 电子天平上称质量, 按下列公式计算抑瘤率(inhibition rate, IR): 抑瘤率(IR) = [模型组瘤质量(g)-用药组瘤治疗(g)]/模型组瘤质量(g)×100%.
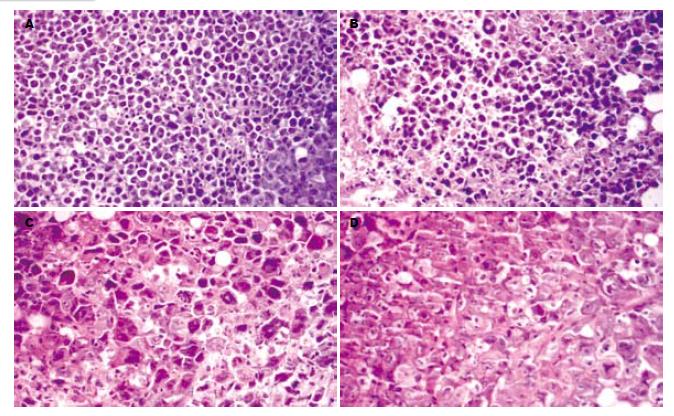
1.2.6 肿瘤大体标本及组织形态观察: 剥离荷瘤小鼠肿瘤组织时, 肉眼观察肿瘤的体积、颜色及质地, 同时观察其假膜是否完整、剥离时有无出血等. 取各组小鼠肿瘤组织, 10%甲醛固定, 常规脱水, 石蜡包埋, 切片. 行HE染色, 光镜下观察肿瘤组织及细胞的形态学变化.
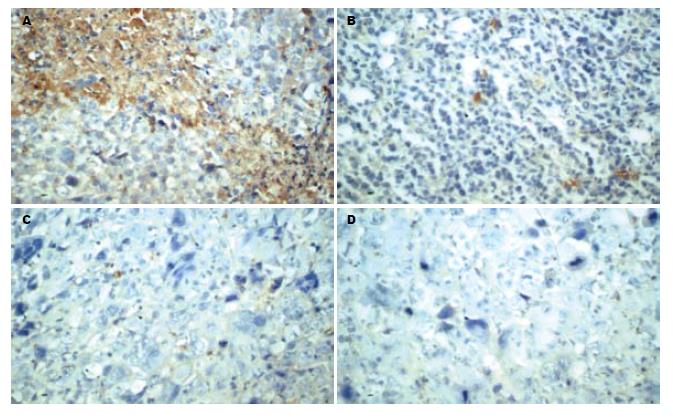
1.2.7 肿瘤微血管密度(microvessel density, MVD): 肿瘤组织经甲醛固定、石蜡包埋后切片, 采用免疫组织化学染色(SABC法), 操作步骤按试剂盒要求. 以PBS代替一抗作阴性对照, 已知阳性切片作阳性对照. MVD的计数方法: 按Weidner等[10]报道的方法, 首先在低倍视野下(×40)扫视整张石蜡切片, 每张切片找出5个微血管密集区, 然后在高倍视野下(×200)记数. 每张切片共计数5个视野, 取其平均值为该例的MVD值. 微血管的判断标准为: (1)与邻近的微血管、肿瘤细胞及其他结缔组织成分不相连的、标记清晰的内皮细胞及内皮细胞簇均可作为一个可计数的微血管. (2)可能源于同一微血管的内皮细胞, 如染色清晰且相互分离, 也可作为单独的微血管计数. (3)血管腔及腔内红细胞的存在不是确认微血管的必备条件. (4)对肿瘤区内的硬化区、肿瘤细胞稀疏区及邻近良性组织区域内的血管不进行计数. (5)对管腔直径>8个红细胞或管壁有平滑肌存在的血管不进行计数.
统计学处理 采用SPSS10.0统计分析软件处理实验结果. 计量资料的数据以mean±SD表示, 计数资料的数据以百分率(%)表示. 计量资料采用单因素方差分析; 计数资料采用卡方检验.
实验过程中, 除QHF组以外的各组小鼠均表现为皮毛无光泽, 竖毛现象明显, 活动减少, 迟缓. 但QHF+DDP联合用药组好于单纯DDP化疗组. DDP组小鼠不良反应明显, 出现厌食、腹泻、精神萎靡、消瘦及被毛脱落等症状, QHF+DDP组不良反应相对较小. 给药结束时, 除NS组以外的各组小鼠均有死亡, 所有死亡小鼠均为体质量明显下降者. 可排除由于实验操作不当致死的可能, 小鼠死亡是由于自身体质差所致. QHF组、DDP组及QHF+DDP联合用药组分别有2只、1只和2只小鼠死亡, 其死亡率分别为16.67%、8.33%和16.67%. 各组小鼠死亡率差异无统计学意义(P>0.05).
NS组、QHF组、DDP组及QHF+DDP联合用药组的脾指数分别为(9.39±3.68, 10.91±1.53, 4.40±0.99, 8.32±0.25). 除DDP组的脾指数较NS组明显下降以外(P<0.05), QHF组和QHF+DDP联合用药组与NS组相比, 差异无统计学意义(P>0.05). 用药组两两比较: 联合用药组的脾指数较DDP组明显上升, 差异有显著的统计学意义(P<0.01), 与QHF组相比, 差异无统计学意义(P>0.05); DDP组较QHF组明显下降, 差异有显著统计学意义(P<0.01).
接种5 d内, 小鼠外观无明显改变. 5 d后各组可触及右腋皮下瘤块, NS对照组小鼠肿瘤生长迅速, 局部肿胀, 压迫症状明显; 各用药组小鼠肿瘤生长相对NS对照组较缓慢. 各组小鼠的瘤质量及抑瘤率见表1. QHF组、DDP组及QHF+DDP联合用药组的抑瘤率分别为47.54%、63.11%和72.95%. 各用药组的瘤质量均明显低于NS组, 差异有显著的统计学意义(均P<0.01). 用药组两两比较: 联合用药组的瘤质量明显低于QHF组(P<0.01), 但与DDP组相比, 差异无统计学意义(P>0.05); QHF组与DDP组的差异无统计学意义(P>0.05).
肉眼观察: NS对照组肿瘤组织体积大、颜色红润、质脆, 瘤块假膜不完整, 部分浸润生长至腿部肌肉, 剥离时易出血; 各用药组肿瘤组织体积相对较小, 颜色略苍白、质韧, 瘤块假膜完整, 剥离时基本无出血. 光镜观察: NS对照组表现为肿瘤组织内小片坏死, 肿瘤细胞生长旺盛, 细胞核异型性明显, 间质血管丰富; 各用药组表现为肿瘤组织内坏死区增大, 间质血管较稀少, 有明显的纤维化形成(图1).
QHF组、DDP组及QHF+DDP联合用药组的肿瘤组织MVD数值分别为11.00±1.56、10.33±1.49及6.87±0.97, 与NS对照组(19.93±1.02)比较均明显降低, 差异有显著统计学意义(均P<0.01); 联合用药组的MVD计数明显低于两单药组, 差异有显著统计学意义(均P<0.01); QHF组与DDP组的差异无统计学意义(P>0.05, 图2).
1971年Folkman等[11]首次提出, 肿瘤的生长和转移依赖于血管生成, 为肿瘤的治疗开辟了新的领域. 肝细胞癌为血供丰富的实体肿瘤, 其生物学特性包括高度血管浸润及转移倾向, 导致该疾病的预后不良. 肿瘤血管形成理论的建立, 为研究肝细胞癌复发和转移的机制提供了新的理论依据, 同时为治疗肝细胞癌, 防止肝细胞癌的复发和转移找到了一种更为有效的治疗手段-抗血管生成治疗[12,13]. MVD是目前较为公认的评价肿瘤组织血管生成的较好指标[14]. 他能直接量化反映肿瘤血管生成的程度, 是反映恶性肿瘤生物学行为的重要参数, 与肿瘤的侵袭、转移及预后关系密切. 研究认为CD34标记的微血管是真正的新生肿瘤血管[15,16]. 大量研究表明, 恶性肿瘤组织的MVD较良性肿瘤组织及正常黏膜组织高. 因此许多学者认为MVD在反映肿瘤预后方面是一个独立而且重要的因素, 高MVD往往提示易发生转移和预后不良, 有效的抗血管生成剂可明显降低肿瘤组织的MVD. 当前, 特异性抗血管生成药物与节律性化疗药物联合应用是肿瘤治疗领域的一大热点[17,18], 研究发现抗血管联合应用可以作用于血管生长的不同环节、不同阶段, 充分发挥各自优势, 产生协同效应, 并且两者的不良反应都低. DDP是一种细胞周期非特异性抗肿瘤药物, 他通过与DNA链结合, 形成交叉连接, 抑制DNA、RNA合成和细胞有丝分裂, 从而抑制肿瘤生长. 该药已用于多种实体肿瘤的治疗, 是目前较为有效的化疗药物之一. 本研究结果显示, DDP组肿瘤的MVD表达水平较NS对照组明显下降, 表明低剂量DDP具有抗血管生成作用. 本实验结果与谭光宏、侯继院等的报道一致[19,20].
QHF复方组肿瘤组织的MVD表达水平较NS对照组明显下降, 差异有统计学意义. 表明QHF复方具有抗血管生成作用, 抗血管生成可能是QHF复方发挥抗肿瘤作用的机制之一. 本研究发现, 将低剂量DDP与抗血管生成药QHF复方联合干预移植性肝癌H22小鼠后, 肿瘤组织中MVD数量不仅较NS对照组明显下降, 而且较各自单独应用时下降更为明显, 差异有显著统计学意义. 因此, 二者具有协同抗肿瘤血管生成作用. 另外, 从荷瘤小鼠的一般状况及脾指数结果来看, QHF复方与DDP联合应用组的一般状况明显好于单用DDP组, 而且脾指数也较单用DDP为高, 差异有统计学意义. 这表明QHF复方能降低化疗药物的不良反应, 具有减毒作用.
肝癌是临床常见的恶性肿瘤之一, 术后复发和转移率极高, 目前尚缺乏有效的治疗药物. 而血管生成是肿瘤生长和转移的形态学基础, 他不仅为肿瘤提供充足的营养, 而且为转移的肿瘤细胞提供了通道. 故抑制血管生成的疗法有望成为治疗肝癌的重要方法.
范学工, 教授, 中南大学湘雅医院感染病科
当前, 特异性抗血管生成药物与节律性化疗药物联合应用是肿瘤治疗领域的一大热点. 研究发现抗血管联合应用可以作用于血管生长的不同环节、不同阶段, 充分发挥各自优势, 产生协同效应, 并且两者的不良反应都低.
Browder等报道低剂量抗血管生成化疗的抗肿瘤效果可因合用一种特异靶向内皮细胞的药物而明显提高. Zhang等报道将持续低剂量CTX和人参皂甙Rg3联合应用治疗Lewis肺癌小鼠和EMT-6乳腺癌小鼠, 二者显示出抗血管生成协同作用, 并且治疗不良反应小, 不易产生耐药, 抑瘤效果较单药组显著且持久, 动物生存期得到延长.
本研究所用的QHF复方是本项目组前期所筛选的一种疗效显著的抗肝癌组方. 本次实验发现其具有一定的抗肝癌血管生成的作用, 而且与小剂量DDP联合应用具有协同抗肝癌血管生成的作用.
本研究表明QHF复方可能通过抑制肿瘤血管生成的效应, 达到靶向抗肝肿瘤治疗的目的, 为其进一步开发应用打下了较好的基础. 而且其与化疗联合应用药效增强的实验结果对开发更为有效的抗肿瘤血管生成抑制剂具有一定的指导意义.
本研究就QHF复方联合DDP抗肝癌血管生成的作用进行了观察, 其结果对药物的进一步开发打下了较好的基础, 有一定的可读性.
编辑: 李军亮 电编:何基才
| 1. | Miller KD, Sweeney CJ, Sledge GW Jr. Redefining the target: chemotherapeutics as antiangiogenics. J Clin Oncol. 2001;19:1195-1206. [PubMed] |
| 2. | Bello L, Carrabba G, Giussani C, Lucini V, Cerutti F, Scaglione F, Landré J, Pluderi M, Tomei G, Villani R. Low-dose chemotherapy combined with an antiangiogenic drug reduces human glioma growth in vivo. Cancer Res. 2001;61:7501-7506. [PubMed] |
| 3. | Chen T, Li D, Fu YL, Hu W. Screening of QHF formula for effective ingredients from Chinese herbs and its anti-hepatic cell cancer effect in combination with chemotherapy. Chin Med J (Engl). 2008;121:363-368. [PubMed] |
| 8. | Tan WF, Lin LP, Li MH, Zhang YX, Tong YG, Xiao D, Ding J. Quercetin, a dietary-derived flavonoid, possesses antiangiogenic potential. Eur J Pharmacol. 2003;459:255-262. [PubMed] [DOI] |
| 9. | Fan PS, Gu ZL, Sheng R, Liang ZQ, Wang XX, Zhu Y. Inhibitory effect of quercetin on proliferation of human microvascular endothelial cells in vitro. Acta Pharmacol Sin. 2003;24:1231-1234. [PubMed] |
| 10. | Weidner N, Semple JP, Welch WR, Folkman J. Tumor angiogenesis and metastasis--correlation in invasive breast carcinoma. N Engl J Med. 1991;324:1-8. [PubMed] |
| 11. | Folkman J. Tumor angiogenesis: therapeutic implications. N Engl J Med. 1971;285:1182-1186. [PubMed] |
| 14. | Weidner N. Tumoural vascularity as a prognostic factor in cancer patients: the evidence continues to grow. J Pathol. 1998;184:119-122. [PubMed] [DOI] |
| 15. | Kim KW, Bae SK, Lee OH, Bae MH, Lee MJ, Park BC. Insulin-like growth factor II induced by hypoxia may contribute to angiogenesis of human hepatocellular carcinoma. Cancer Res. 1998;58:348-351. [PubMed] |
| 16. | Lin P, Buxton JA, Acheson A, Radziejewski C, Maisonpierre PC, Yancopoulos GD, Channon KM, Hale LP, Dewhirst MW, George SE. Antiangiogenic gene therapy targeting the endothelium-specific receptor tyrosine kinase Tie2. Proc Natl Acad Sci U S A. 1998;95:8829-8834. [PubMed] [DOI] |
| 17. | Browder T, Butterfield CE, Kräling BM, Shi B, Marshall B, O'Reilly MS, Folkman J. Antiangiogenic scheduling of chemotherapy improves efficacy against experimental drug-resistant cancer. Cancer Res. 2000;60:1878-1886. [PubMed] |
| 18. | Zhang Q, Kang X, Zhao W. Antiangiogenic effect of low-dose cyclophosphamide combined with ginsenoside Rg3 on Lewis lung carcinoma. Biochem Biophys Res Commun. 2006;342:824-828. [PubMed] [DOI] |