修回日期: 2010-06-17
接受日期: 2010-06-22
在线出版日期: 2010-07-08
目的: 检测人胃黏膜病损处的真菌, 及其基因多样性, 分析菌种进化分支与黏膜病理损伤的关系.
方法: 用胃镜钳取有病损的胃黏膜标本65例(慢性胃炎52例, 胃溃疡11例, 胃癌2例). 用念珠菌显色培养基(CHROM agar)进行分离培养鉴定. 对鉴定为真菌的菌株样本按照病损程度分组, 随机抽取菌株样本进行ITS序列检测, 并比对同源性, 建立进化树, 分析菌株进化分支与胃黏膜病理损伤的关系.
结果: 分离培养出真菌菌株34个(34/65, 52.3%), 真菌阳性率在慢性胃炎、胃溃疡、胃癌样本中分别为44.2%(23/52), 818%(9/11), 100%(2/2), 差异有统计学意义(χ2 = 7.023, P = 0.030). 进行ITS序列检测的18个菌株申请GenBank序列注册号为GQ280298-GQ280334, 建立系统进化树显示真菌菌株某些进化分支与胃黏膜病损有密切关系.
结论: 不同进化分支的真菌对胃黏膜炎症损伤的程度存在差异.
引文著录: 王垂杰, 郑剑玲, 宫雁冰, 傅纪婷, 齐贺, 耿薇, 李玉锋, 段薇. 胃病患者胃黏膜真菌基因的多样性. 世界华人消化杂志 2010; 18(19): 2050-2054
Revised: June 17, 2010
Accepted: June 22, 2010
Published online: July 8, 2010
AIM: To explore the relationship between fungal evolution and the severity of gastric mucosal lesions by analyzing the genetic diversity of fungi in gastric mucosa of patients with different gastric diseases.
METHODS: Sixty-five gastric mucosal specimens, including 52 chronic gastritis specimens, 11 gastric ulcer specimens, and 2 gastric carcinoma specimens, were collected by gastroscopy. CHROM agar medium was used for isolation and identification of fungal strains. The fungal strains isolated were grouped according to the severity of lesions, and 18 strains were randomly selected to sequence the internal transcribed spacer (ITS) regions for homology comparison and phylogenetic tree building. The relationship between fungal evolution and the severity of gastric mucosal lesions was then analyzed.
RESULTS: A total of 34 (34/65, 52.3%) fungal strains were isolated, of which 23 (23/52, 44.2%) from gastritis samples, 9 (9/11, 81.8%) from gastric ulcer samples, and 2 (2/2, 100%) from gastric carcinoma. There was significant difference in the fungal detection rate among different groups of patients (χ2 = 7.023, P = 0.030). The ITS sequences of all the 18 strains were deposited in GenBank (GenBank Accession Nos. GQ280298-GQ280334). The phylogenetic tree obtained suggested that some fungal strains in certain evolution branches were closely related to the severity of gastric mucosa lesions.
CONCLUSION: The severity of gastric mucosal lesions is associated with fungal evolution directions.
- Citation: Wang CJ, Zheng JL, Gong YB, Fu JT, Qi H, Geng W, Li YF, Duan W. Genetic polymorphisms of fungi in gastric mucosa of patients with different gastric diseases. Shijie Huaren Xiaohua Zazhi 2010; 18(19): 2050-2054
- URL: https://www.wjgnet.com/1009-3079/full/v18/i19/2050.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i19.2050
胃黏膜损伤严重影响患者的消化功能和生活质量, 其中胃黏膜层和固有腺体的慢性炎症性损伤诊断为慢性胃炎, 当黏膜病损超过黏膜肌层则诊断为胃溃疡, 当细胞出现异型性诊断为肿瘤. 现有研究认为导致胃黏膜炎症损伤及转化的机制与幽门螺杆菌(helicobacter pylori, H.pylori)等微生物感染有密切关系[1-3], 且有研究发现, 胃溃疡合并真菌感染者溃疡口愈合进程明显延长, 溃疡面积明显大于单纯性溃疡[4]. 在胃癌组织样本中也常可检出真菌, 且真菌产生的毒素与肿瘤发生密切相关[5]. 目前对胃黏膜真菌多样性及进化方向与病损程度的关系, 尚缺乏研究. 本实验通过检测胃黏膜白色念珠菌的ITS(internal transcribed spacer region)序列基因多样性, 分析真菌菌株进化方向与胃黏膜病损的关系, 初步探寻胃黏膜损害密切相关真菌菌株.
2008-07-07/08-25于辽宁中医药大学消化科胃镜检查的患者, 经知情同意, 自愿参加本项研究, 共65例. 其中慢性胃炎52例, 胃溃疡11例, 胃癌2例. 男43例, 女22例, 年龄18-79岁, 平均年龄为46.32岁, 近3 mo内未使用糖皮质激素等免疫抑制剂. 用胃镜钳取胃窦部黏膜组织样本, 约3 mm×2 mm×1 mm大小, 置于无菌Ep管中, -20 ℃保存. 同时记录受检者年龄、性别、学历、吸烟、饮酒习惯、病史、病理诊断、用药治疗、快速尿素酶检查H.pylori情况.
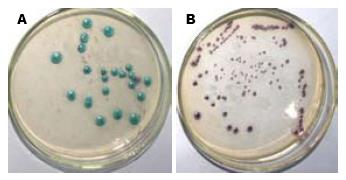
1.2.1 真菌分离培养: 胃黏膜样本加入200 μL生理盐水稀释, 吹打混匀. 取20 μL样本液, 接种于CHROM agar念珠菌显色培养基(郑州博赛生物技术股份有限公司), 37 ℃培养3 d. 参照产品说明书, 依据分离培养菌落颜色进行鉴定(白色念珠菌呈绿色, 热带念珠菌呈蓝色, 光滑念珠菌呈紫色, 克柔念珠菌呈粉色, 其余念珠菌呈白色). 用无菌牙签挑取单个菌落于Ep管中, -20 ℃保存.
1.2.2 白色念珠菌DNA提取: 按照病损分组, 选取真菌菌株样本5 μL, 接种于1 mL液体沙保罗培养基(杭州天和微生物试剂有限公司)中增菌. 菌液加入5 μL溶细胞酶(3 g/L, 以山梨醇溶液配制)(Sigma, US), 37 ℃水浴过夜, 去细胞壁. 常规酚-氯仿法提取DNA[6].
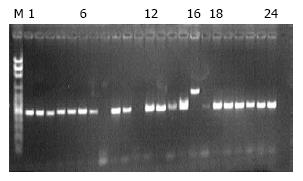
1.2.3 PCR扩增和序列检测: 用真菌ITS序列通用引物ITS1: TCCGT AGGTG AACCT GCGG; ITS4: TCCTC CGCTT ATTGA TATGC[7](上海生工生物工程技术服务有限公司)进行PCR扩增. PCR体系(50 μL): 41 μL H2O, 5.0 μL 10×Buffer, 1 μL 10 mmol/L dNTP(Roche, Switzerland), 0.5 μL 20 μmol/L前引物, 0.5 μL 20 μmol/L后引物, 0.25 μL 5 U/μL TaqE(TaKaRa, 大连宝生物工程有限公司), DNA模板2 μL. 循环条件: 95 ℃热启动5 min; 95 ℃ 30 s, 55 ℃ 30 s, 72 ℃ 30 s, 40个循环; 72 ℃ 10 min; 4 ℃保存. 20%琼脂糖1X TAE缓冲液, genefinder(Bio-V, 厦门百维信生物科技有限公司)核酸染料染色, 110 V 30 min电泳. PCR产物500-900 bp, 紫外线凝胶扫描成像(Bio-V, 厦门百维信生物科技有限公司), 并记录实验结果. 将PCR阳性产物送上海生工生物工程技术服务有限公司进行测序, 测序所获得DNA序列提交GenBank, 登记注册国际基因库接受号(genbank acceeeion No.), 进行序列比对分析.
1.2.4 序列分析及进化树建立: 对测序结果用ClustalX程序进行比对排序, 采用MEGA3.0 (molecular evolutionary genetics analysis, MEGA)软件邻接法(Neihbor-Jioning tree)建立进化树.
统计学处理 采用SPSS11.5统计软件对数据进行Pearson χ2检验, Kendall等级相关分析, 对ITS序列检测结果、病理诊断、H.pylori、年龄、性别、学历、吸烟、饮酒习惯等各观察指标进行比较分析. P<0.05为有统计学意义.
共分离培养出34个真菌菌株(34/65, 52.3%), 在CHROM agar念珠菌显色培养基中, 仅有一个样本(菌株ZB066)呈紫色菌落为光滑念珠菌, 来自胃癌样本. 其余均呈绿色菌落为白色念珠菌, 检测结果见图1.
34个真菌菌株样本均可扩增出ITS1-ITS 2基因序列, PCR产物白色念珠菌为535 bp, 光滑念珠菌为871 bp(图2).
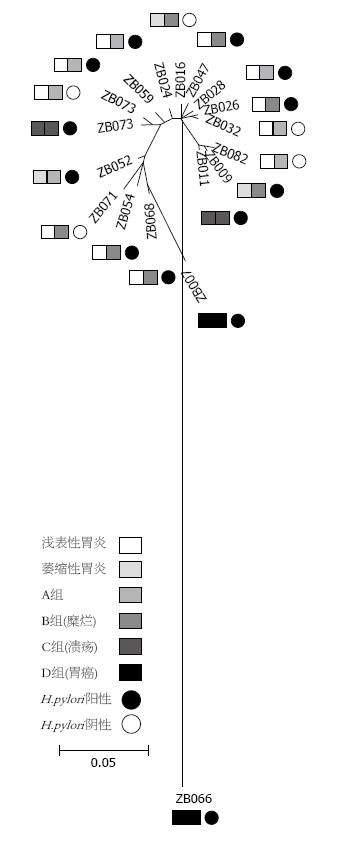
样本按照病理损害程度分为4组: A组: 病理损害达黏膜浅层的样本(包括浅表性胃炎、萎缩性胃炎), 随机取7个样本; B组: 病理损害达黏膜下层, 出现糜烂(包括浅表性胃炎、萎缩性胃炎), 随机取7个样本; C组: 病理损害达到黏膜肌层(胃溃疡), 随机取2个样本; D组: 细胞出现异型性(胃癌), 取2个样本, 进行ITS序列检测. 测序所获得DNA序列提交GenBank, 登记注册国际基因库接受号(genbank acceeeion No), 测序结果及GenBank注册号见表1. 测序结果进行序列比对分析, 建立ITS序列系统进化树见图3.
| 序号 | 菌株号 | ITS序列号 | 性别a | 年龄 | H.pylorib | 分组c | 诊断 |
| 1 | ZB066 | FJ697172d | M | 57 | 1 | D | 胃癌 |
| 2 | ZB007 | GQ280298 | M | 58 | 1 | D | 胃癌 |
| 3 | ZB009 | GQ280300 | F | 78 | 1 | B | 慢性萎缩性胃炎伴糜烂, 十二指肠溃疡 |
| 4 | ZB011 | GQ280302 | M | 39 | 1 | C | 胃溃疡, 糜烂性胃炎 |
| 5 | ZB016 | GQ280304 | F | 56 | 0 | B | 慢性萎缩性胃炎伴糜烂 |
| 6 | ZB024 | GQ280307 | F | 23 | 1 | A | 慢性浅表性胃炎伴胆汁反流 |
| 7 | ZB026 | GQ280309 | M | 30 | 1 | B | 慢性浅表性胃炎伴糜烂 |
| 8 | ZB028 | GQ280311 | M | 55 | 1 | A | 慢性浅表性胃炎伴胆汁反流, 十二指肠球溃疡 |
| 9 | ZB032 | GQ280314 | F | 42 | 0 | A | 慢性浅表性胃炎 |
| 10 | ZB047 | GQ280319 | M | 44 | 1 | B | 慢性浅表性胃炎伴糜烂、胆汁反流 |
| 11 | ZB052 | GQ280321 | M | 65 | 1 | A | 慢性萎缩性胃炎伴肠化生 |
| 12 | ZB054 | GQ280323 | M | 71 | 1 | B | 慢性浅表性胃炎伴糜烂 |
| 13 | ZB056 | GQ280324 | M | 40 | 0 | A | 浅表性胃炎, 十二指肠球炎 |
| 14 | ZB059 | GQ280325 | F | 31 | 1 | A | 慢性浅表性胃炎伴胆汁反流 |
| 15 | ZB068 | GQ280328 | F | 25 | 1 | B | 慢性浅表性胃炎伴糜烂、 |
| 16 | ZB071 | GQ280330 | F | 43 | 0 | B | 慢性浅表性胃炎伴糜烂、胆汁反流 |
| 17 | ZB073 | GQ280332 | M | 30 | 1 | C | 胃溃疡S期, 伴胆汁反流 |
| 18 | ZB082 | GQ280334 | F | 27 | 0 | A | 慢性浅表性胃炎 |
按照病理诊断分组, 真菌阳性率在慢性胃炎、胃溃疡、胃癌样本中分别为44.2%(23/52), 81.8%(9/11), 100%(2/2), 差异有统计学意义(χ2 = 7.023, P = 0.030). 经Kendall等级相关分析, 白色念珠菌阳性率与H.pylori阳性、性别、年龄、吸烟、饮酒、学历的相关性, 均无统计学意义(P>0.05).
50年前已有真菌与胃病密切相关的研究报道[8], 也发现白色念珠菌作为最常见的寄居于人体的深部真菌, 有较强的致病性[9], 因其也多见于无症状的黏膜表面, 长期以来被认为是条件致病菌. 随着遗传学和表观遗传学的发展, 现有研究发现真菌在宿主黏膜表面形成黏附时, 涉及染色体重排(chromosomal rearrangements)、组蛋白编码相关的SIR2(Silent information regulator 2), 及Cph1p、Tup1p、Rbp1p等多种转录因子参与调控[10]. 真菌的多样性和基因多态性造成真菌不同菌株间毒性的巨大差异, 这也解释了同为白色念珠菌为什么有的致病性强, 而有的无明显致病性. 因此, 通过对真菌的遗传学分类和进化方式的研究, 可以对致病性真菌进行早期筛查和预防, 也成为胃病的预防学研究的一个发展方向.
本实验选取ITS序列作为对真菌多样性的检测方法, 因真核细胞核糖体rRNA基因编码DNA序列为18S rRNA-ITS1-58S rRNA-ITS2-28S rRNA的串联重复, 其中ITS1(internal transcribed spacer region 1)和ITS2(internal transcribed spacer region 2)为内含子转录间隔区, ITS1-ITS2部分受自然选择压力小, 进化速度较快,从中可以获得较多的进化信息. 同时, 5S rRNA-58S rRNA rRNA-28S rRNA高度保守, 具有种间特异性和种内保守性. 对真菌的ITS区进行分析, 可以获得真菌种类鉴定和进化方式的可靠遗传信息, 将ITS序列提交GenBank, 可以与全球各地提交的真菌ITS序列进行序列比对, 从而了解相关真菌菌种和菌株的同源性关系、进化分支方向和分布情况, 已经广泛应用于真菌的分类进化方面的研究[11].
本实验将来自胃黏膜的18个真菌菌株建立系统进化树, 从同源序列对比分析中, 可见菌株ZB024、ZB056、ZB059进化分支对黏膜的损伤程度最小, 即便合并H.pylori感染, 病损仍局限在黏膜浅层. 菌株ZB007、ZB052、ZB054、ZB068、ZB071、ZB073进化分支, 对黏膜损伤最重, 不合并H.pylori感染的情况下即可出现胃黏膜糜烂, 如果合并H.pylori感染, 可出现腺体萎缩、肠化生、溃疡和肿瘤, 也可合并十二指肠溃疡. 菌株ZB009、ZB011、ZB016、ZB026、ZB028、ZB032、ZB047、ZB066、ZB082进化分支, 需与H.pylori联合, 才能对黏膜产生较重的损伤. 其中ZB016、ZB032和ZB082的宿主都是女性、H.pylori阴性, 病损则局限在黏膜浅层和下层. 该进化分支在合并H.pylori感染的情况下, 对黏膜损伤较重, 其中ZB009和ZB028宿主虽胃黏膜病损较轻, 但十二指肠出现溃疡. 该进化分支也可出现肿瘤, 但是进化距离较远的光滑念珠菌. 由此推测, 这一进化分支的真菌菌株对黏膜的损伤程度, 受宿主性别、H.pylori感染等多因素影响.
本实验分离培养出的34个胃黏膜真菌菌株中, 为33例白色念珠菌, 1例光滑念珠菌, 与已有的报道不尽相同. Zwolinska等学者用API系统检测检测了293个消化不良和胃溃疡患者的胃黏膜活检样本, 分离培养出的真菌菌种中, 光滑念珠菌占42.4%, 白色念珠菌占38.7%[12]. 本实验的光滑念珠菌检出率低可能与样本选取和检测方法有关.
本实验的胃黏膜样本真菌检出率为52.3%, 在胃炎样本中为44.2%, 胃溃疡为81.8%, 与已有的研究报道相近, Karkowska-Kuleta报道在54.2%的胃溃疡患者和10.3%慢性胃炎患者的胃黏膜样本中分离培养出真菌[4]. 本实验中胃炎和胃溃疡患者的真菌检出率较高, 可能与样本选取情况有关, 如: 地域、季节、饮食习惯、患者就医习惯等因素. 我国进行胃镜检查的患者均为胃不适症状较重的患者, 这可能对其真菌检出率有所影响. 现有研究发现胃溃疡合并真菌感染者溃疡口愈合进程明显延长, 溃疡面积明显大于单纯性溃疡, 应用抗真菌治疗4 wk后, 溃疡面积显著减小, 症状减轻[4]. 用大鼠动物模型实验发现白色念珠菌可加重胃溃疡面积, 减少胃血流量[13]. Ramaswamy等也报道难治性胃溃疡与白色念珠菌感染有关, 采用抗真菌治疗, 并去除离子泵抑制剂后, 溃疡愈合[14]. 已有的研究发现白色念珠菌产生分泌性蛋白酶和细胞外磷脂酶, 可以对黏膜产生破坏作用, 也是白色念珠菌附着于宿主黏膜的毒力因子[10]. 在本实验也发现白色念珠菌可能参与胃黏膜炎症破坏, 与胃黏膜损伤密切相关. 本实验胃癌样本仅为2例, 分别检出白色念珠菌和光滑念珠菌, 其进化分支与其他胃黏膜破坏密切的菌株进化距离很近, 已有研究也认为关于真菌产生的毒素与细胞转化密切相关[15], 胃癌与真菌进化分支的关系尚需扩大样本量进一步研究.
总之, 本实验发现胃黏膜真菌感染可加重黏膜炎症破坏. 白色念珠菌的ITS序列同源性对比分析发现, 某些进化分支的菌株在没有H.pylori合并感染的情况下, 可导致较重的胃黏膜和固有腺体破坏. 某些进化分支的白色念珠菌菌株, 需与H.pylori合并感染的情况下, 参与胃黏膜破坏. 另一些致病性弱的白色念珠菌菌株, 即便是与H.pylori合并感染, 也不会对胃黏膜产生显著的破坏. 因此, 对白色念珠菌致病菌株的进一步研究, 可以成为胃溃疡防治的一个发展方向.
现有研究认为导致胃黏膜炎症损伤及转化的机制与幽门螺杆菌(H.pylori)等微生物感染有密切关系, 且有研究发现, 胃溃疡合并真菌感染者溃疡口愈合进程明显延长, 溃疡面积明显大于单纯性溃疡. 在胃癌组织样本中也常可检出真菌, 且真菌产生的毒素与肿瘤发生密切相关. 目前对胃黏膜真菌多样性及进化方向与病损程度的关系, 尚缺乏研究.
杨江华, 副教授, 安徽省芜湖市皖南医学院弋矶山医院感染科
对白色念珠菌致病菌株的进一步研究, 可以成为胃溃疡防治的一个发展方向.
随着遗传学和表观遗传学的发展, 现有研究发现真菌在宿主黏膜表面形成黏附时, 涉及染色体重排、组蛋白编码相关的SIR2, 及Cph1p、Tup1p、Rbp1p等多种转录因子参与调控.
本研究内容重要, 有一定新颖性.
编辑 李军亮 电编 吴鹏朕
| 1. | Correa P. Human gastric carcinogenesis: a multistep and multifactorial process--First American Cancer Society Award Lecture on Cancer Epidemiology and Prevention. Cancer Res. 1992;52:6735-6740. [PubMed] |
| 2. | Shirin H, Hibshoosh H, Kawabata Y, Weinstein IB, Moss SF. p16Ink4a is overexpressed in H. pylori-associated gastritis and is correlated with increased epithelial apoptosis. Helicobacter. 2003;8:66-71. [PubMed] [DOI] |
| 3. | Houghton J, Korah RM, Condon MR, Kim KH. Apoptosis in Helicobacter pylori-associated gastric and duodenal ulcer disease is mediated via the Fas antigen pathway. Dig Dis Sci. 1999;44:465-478. [PubMed] [DOI] |
| 4. | Zwolińska-Wcisło M, Budak A, Trojanowska D, Bogdał J, Stachura J. Fungal colonization of the stomach and its clinical relevance. Mycoses. 1998;41:327-334. [PubMed] [DOI] |
| 6. | Morace G, Pagano L, Sanguinetti M, Posteraro B, Mele L, Equitani F, D'Amore G, Leone G, Fadda G. PCR-restriction enzyme analysis for detection of Candida DNA in blood from febrile patients with hematological malignancies. J Clin Microbiol. 1999;37:1871-1875. [PubMed] |
| 7. | Mirhendi H, Makimura K, Khoramizadeh M, Yamaguchi H. A one-enzyme PCR-RFLP assay for identification of six medically important Candida species. Nihon Ishinkin Gakkai Zasshi. 2006;47:225-229. [PubMed] [DOI] |
| 8. | Ahnlund HO, Pallin B, Peterhoff R, Sch汁nebeck J. Mycosis of the stomach. Acta Chir Scand. 1967;133:555-562. [PubMed] |
| 9. | Blank F, Chin O, Just G, Meranze DR, Shimkin MB, Wieder R. Carcinogens from fungi pathogenic for man. Cancer Res. 1968;28:2276-2281. [PubMed] |
| 10. | Karkowska-Kuleta J, Rapala-Kozik M, Kozik A. Fungi pathogenic to humans: molecular bases of virulence of Candida albicans, Cryptococcus neoformans and Aspergillus fumigatus. Acta Biochim Pol. 2009;56:211-224. [PubMed] |
| 12. | Zwolińska-Wcisło M, Brzozowski T, Mach T, Budak A, Trojanowska D, Konturek PC, Pajdo R, Drozdowicz D, Kwiecień S. Are probiotics effective in the treatment of fungal colonization of the gastrointestinal tract? Experimental and clinical studies. J Physiol Pharmacol. 2006;57 Suppl 9:35-49. [PubMed] |
| 13. | Zwolinska-Wcisło M, Budak A, Bogdał J, Trojanowska D, Stachura J. Fungal colonization of gastric mucosa and its clinical relevance. Med Sci Monit. 2001;7:982-988. [PubMed] |
| 14. | Ramaswamy K, Correa M, Koshy A. Non-healing gastric ulcer associated with Candida infection. Indian J Med Microbiol. 2007;25:57-58. [PubMed] [DOI] |
| 15. | O'Grady JF, Reade PC. Candida albicans as a promoter of oral mucosal neoplasia. Carcinogenesis. 1992;13:783-786. [PubMed] [DOI] |