修回日期: 2010-06-13
接受日期: 2010-06-22
在线出版日期: 2010-07-08
目的: 构建一种稳定的非人灵长类大动物急性肝衰竭模型.
方法: 将15只食蟹猴随机分成3组, 经颈外静脉分别注射0.45、0.3和0.15 g/kg D-氨基半乳糖胺, 构建食蟹猴肝衰竭动物模型. 动态检测给药前(0 h)、给药后12、24、36、48、60、72、96 h生命体征、颅内压(ICP)及血清丙氨酸转氨酶(ALT)、凝血酶原时间(PT)、总胆红素(TBIL)、血氨(NH3)的变化. 观察动物临床表现及病程进展情况, 记录动物生存时间, 动物死亡后行组织病理学检查.
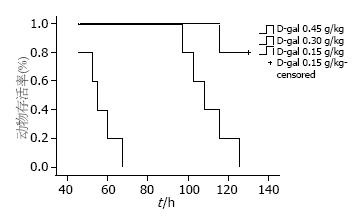
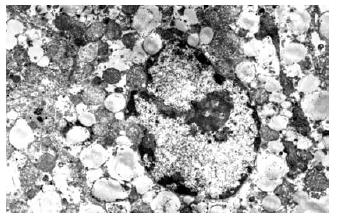
结果: 0.45 g/kg和0.3 g/kg组动物全部死亡, 生存时间分别为56.1 h±8.1 h和109.8 h±11.2 h, 0.15 g/kg实验猴除1只98 h死亡外其余全部存活. 0.45 g/kg和0.3 g/kg组动物各时点的ALT、TBIL、PT、NH3及ICP均明显高于基线值(0 h), 差异有统计学意义(P<0.05), 0.15 g/kg实验猴各指标在60 h后渐恢复正常. 死亡动物组织病理检查见肝细胞坏死, 肝内炎性细胞浸润.
结论: 以0.3 g/kg的D-氨基半乳糖胺诱发食蟹猴急性肝功能衰竭动物模型, 符合急性肝功能衰竭的临床表现、病理变化, 可用于急性肝功能衰竭的动物实验研究.
引文著录: 徐玉振, 薛琨, 高毅, 潘明新, 简国登, 刘晓明, 饶军华. 非人灵长类动物急性肝功能衰竭模型的建立. 世界华人消化杂志 2010; 18(19): 1985-1989
Revised: June 13, 2010
Accepted: June 22, 2010
Published online: July 8, 2010
AIM: To establish a non-human primate model of acute liver failure (ALF).
METHODS: Fifteen healthy cynomolgus monkeys (Macaca fascicularis) were randomly divided into three groups, which were administered with D-galactosamine via the jugular vein at doses of 0.45 (high-dose group), 0.3 (medium-dose group) and 0.15 g/kg (low-dose group), respectively, to induce ALF. At 0, 12, 24, 36, 48, 60, 72 and 96 h after administration, clinical and intracranial pressure (ICP) data were recorded, and blood samples were collected for measurement of alanine aminotransferase (ALT), prothrombin time (PT), total bilirubin (TBIL), and ammonia (NH3). Animal survival time was recorded to compare the survival rates among the three groups. Postmortem examination was performed in dead cynomolgus monkeys.
RESULTS: All animals were dead in the high- and medium-dose groups, and the mean survival time was 56.1 h ± 8.1 h and 109.8 h ± 11.2 h, respectively. Only one animal died at 98 h after treatment in the low-dose group. In the high- and medium-dose groups, serum levels of ALT, PT, TBIL and NH3, and ICP were significantly higher at all time points than at baseline (0 h) (all P < 0.05). All these parameters were normal at 60 h in the low-dose group. Inflammatory cell infiltration and hepatic cell necrosis were observed in dead cynomolgus monkeys.
CONCLUSION: A cynomolgus monkey model of AHF has been successfully established and can be used for future ALF research.
- Citation: Xu YZ, Xue K, Gao Y, Pan MX, Jian GD, Liu XM, Rao JH. Establishment of a non-human primate model of acute liver failure. Shijie Huaren Xiaohua Zazhi 2010; 18(19): 1985-1989
- URL: https://www.wjgnet.com/1009-3079/full/v18/i19/1985.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i19.1985
急性肝功能衰竭(acute liver failure, ALF)病情复杂、影响因素多、缺乏对照而难以确切判断疗效. 临床上为研究ALF的发病机制和治疗多以啮齿类、犬类动物建立ALF模型, 目前国内外尚未见以非人灵长类动物建立的ALF模型的报道.
食蟹猴(Macaca Faiscularis)15只, 均为♂, 年龄7.1岁±1.2岁, 体质量6.4 kg±1.1 kg, 由广东省昆虫研究所华南灵长类研究开发中心提供[合格证号SCXK(粤)2009-2010], 达到《国标14925-94》要求的实验用猴质量标准(本实验已通过南方医科大学伦理委员会审核).
1.2.1 分组及造模: 将15只食蟹猴随机分为3组, 每组5只. 给药剂量分别为0.45 g/kg(高剂量组)、0.3 g/kg(中剂量组)及0.15 g/kg(低剂量组). D-氨基半乳糖(D-galactosamine, D-gal)盐酸盐购自江苏省南京博源医药科技有限公司, 药物纯度为98%, 溶于5%的葡萄糖溶液中, 配制药物的浓度为0.5 kg/L, 调节pH值为6.8, 配好的溶液2 h内应用. 动物术前12 h禁食, 自由饮水. 速眠新Ⅱ(0.1 mL/kg)和氯胺酮(0.1 mL/kg)麻醉, 10 min内将配制好的D-gal溶液经颈外静脉一次性输入实验猴体内. 颅顶钻一小洞, 插入Codman微传感器测量颅内压(intracranial pressure, ICP). 实验后给予常规饲料, 辅以新鲜水果, 提供充足饮水, 增加营养支持.
1.2.2指标观察: 记录动物的存活时间. 计时从D-gal完全输入体内开始, 时间精确到分钟, 存活动物观察到130 h. 给药前(0 h)、给药后12、24、36、48、60、72、96 h测量体温、血压、心率等生命体征及ICP, 肝功能检测由南方医科大学附属南方医院临床检验中心按常规方法检测. 动物死后由南方医科大学司法鉴定中心行尸检, 动物死后取肝脏、肾脏、脾脏、肺、肠组织, 并行光镜及电镜观察.
统计学处理 采用SPSS13.0统计学软件处理. 计量资料采用mean±SD表示. 组间计量资料比较采用t检验及单因素方差分析, 组间动物生存率的比较采用KaPlan-Meier法进行分析.
各组动物的生命体征在给药前后无明显变化, 给药后12 h开始出现进食量减少. 0.45 g/kg组动物病情发展迅速, 死亡前出现肝昏迷; 0.3 g/kg组中1只实验猴术后26 h出现剧烈恶心呕吐, 所有猴后期发生抽搐并在短时间内出现肝昏迷死亡. 0.45 g/kg组存活时间为56.1 h±8.1 h, 0.3 g/kg组存活时间为109.8 h±11.2 h. 0.15 g/kg组除1只猴在98 h不明原因死亡外其余全部存活. 经Log-rank检验, 三组生存率曲线有显著差别, 统计量为21.933(P = 0.000, 图1).
注射D-gal后, 15只动物均出现肝功能异常, 各时间点血清凝血酶原时间(prothrombin time, PT)、ICP平均明显高于基线值(0 h)(P<0.05或0.01), 0.45 g/kg D-gal组动物48 h时PT升至84.28 s±5.47 s, 约为基线值的9倍, ICP水平为19.40 mmHg±1.34 mmHg, 约为基线值的2倍, 所有实验动物血清丙氨酸转氨酶(alanine aminotransferase, ALT)、血氨(blood ammonia, NH3)、总胆红素(total bilirubin, TBIL)水平逐渐升高, 其中给予0.45 g/kg D-gal的动物注射48 h时ALT、NH3、TBIL水平分别为1 026.60 U/L±84.78 U/L、196.80 mmol/L±9.26 mmol/L、27.74 mmol/L±2.34 mmol/L, 约为基线值的31、6、6倍, 给予0.3 g/kg动物ALT、NH3、TBIL水平亦进行性升高, 96 h时分别达1 032.00 U/L±92.41 U/L、296.12 mmol/L±18.17 mmol/L、115.86 mmol/L±6.84 mmol/L, 约为基线值的31、9、120倍, 而给予0.15 g/kg D-gal的动物ALT、NH3、TBIL水平在60 h达到峰值, 后逐渐下降至96 h时约为基线值的6、2、20倍, 为206.60 U/L±41.64 U/L、64.56 mmol/L±4.03 mmol/L、18.84 mmol/L±0.94 mmol/L(表1).
| 分组 | ALT(U/L) | TBIL(mmol/L) | PT(s) | NH3(g/dL) | ICP(mmHg) |
| 高剂量组 | |||||
| 0 h | 32.68±2.35 | 0.85±0.17 | 9.63±0.32 | 33.60±2.71 | 7.94±0.65 |
| 12 h | 200.80±22.61 | 1.81±0.24 | 13.20±1.75 | 81.58±5.39 | 10.96±0.56 |
| 24 h | 608.40±39.75 | 13.60±1.60 | 34.24±3.28 | 102.04±6.48 | 12.00±0.37 |
| 36 h | 787.40±47.47 | 19.80±1.01 | 55.90±5.19 | 132.56±8.47 | 12.98±0.49 |
| 48 h | 1 026.60±84.78 | 27.74±2.34 | 84.28±5.47 | 196.80±9.26 | 19.40±1.34 |
| 60 h | |||||
| 72 h | |||||
| 96 h | |||||
| 中剂量组 | |||||
| 0 h | 32.00±2.55 | 0.88±0.15 | 9.30±0.24 | 31.68±2.47 | 7.80±0.39 |
| 12 h | 150.00±9.19a | 1.64±0.29 | 13.12±0.96 | 51.36±2.59a | 10.14±0.71a |
| 24 h | 377.20±34.33a | 11.53±1.35 | 27.00±2.08a | 70.82±3.46a | 10.40±0.52a |
| 36 h | 338.60±24.12a | 14.22±0.70a | 41.16±3.20a | 98.02±6.77a | 11.94±0.74a |
| 48 h | 493.60±46.49a | 18.24±1.39a | 63.96±4.69a | 161.60±11.68a | 14.06±1.02a |
| 60 h | 710.60±29.18 | 59.80±2.26 | 109.38±8.90 | 201.98±9.86 | 19.58±1.09a |
| 72 h | 907.20±42.46 | 85.36±4.04 | 139.96±11.58 | 261.98±9.86 | |
| 96 h | 1 032.00±92.41 | 115.86±6.84 | 296.12±18.17 | ||
| 低剂量组 | |||||
| 0 h | 31.20±2.59 | 0.97±0.20 | 9.52±0.36 | 31.32±1.99 | 7.48±0.40 |
| 12 h | 100.40±22.64ac | 1.46±0.28 | 10.22±0.66ac | 32.66±3.00a | 7.88±0.40a |
| 24 h | 152.00±17.45ac | 11.30±0.79a | 20.90±1.60ac | 36.92±4.11ac | 8.02±0.18a |
| 36 h | 221.00±23.32ac | 12.40±1.60a | 32.88±2.92ac | 57.24±3.20ac | 8.32±0.44ac |
| 48 h | 331.00±36.33ac | 16.92±1.02a | 51.00±2.85ac | 79.70±3.19ac | 10.22±0.70ac |
| 60 h | 409.00±27.95c | 34.54±1.73c | 61.48±6.22c | 100.66±6.69c | 10.16±0.69c |
| 72 h | 336.60±50.92c | 21.44±1.44c | 64.18±5.40c | 87.66±4.79c | |
| 96 h | 206.60±41.64c | 18.84±0.94c | 65.56±4.03c |
ALF的特征是起病急, 发病2 wk内出现Ⅱ度以上肝性脑病的肝衰竭症候群[1]. 实验动物的选择要遵从选用与研究对象结构、机能、代谢及疾病特征相类似的实验动物这一原则[2]. 查阅国内外文献, 大部分以鼠、兔、猪、犬类建立ALF模型[3-7], 与啮齿类、犬类动物相比, 非人灵长类动物(non-human primate, NHP)的生理特征以及免疫系统与人类相似, 98%的基因与人类相同[8].
D-gal在肝内通过半乳糖途径代谢, 具有较强的肝特异性毒性作用, 可在短时间内引起严重肝损害, 其作用机制是: (1)通过抑制肝细胞的RNA和浆膜蛋白合成造成肝细胞坏死; (2)肝细胞坏死与细胞外Ca2+大量进人细胞内有关[9]; (3)近年来, 人们对此动物模型所引发的门脉内毒素血症, 进入肝脏使库普弗细胞(kupffer cells, KCs)过度激活, KCs释放细胞因子, 介导炎症级联反应(inflammatory cascade), 在ALF模型的形成过程中所起的重要作用特别关注[10-12]. D-gal诱发肝损伤有剂量依赖性, 我们的研究也证实了这一点. 所有实验动物血清天冬氨酸转氨酶水平逐渐升高, 表明给予不同剂量的D-gal都可以造成急性肝损伤, 且损伤程度与剂量成正相关. 低剂量组转氨酶在60 h后开始下降, 表明肝功能有所恢复, 这也与观察的实际情况相符.
本实验中发现动物注射D-gal后TBIL进行性升高, 0.45 g/kg及0.3 g/kg的动物至死亡时并未见降低, 我们研究中发现有两只0.3 g/Kg的食蟹猴在110 h检测转氨酶急剧降低, 而胆红素仍处于高位, 呈现所谓"胆酶分离", 动物很快死亡这也与文献报道的一致[13].
PT是反映肝脏合成功能、储备功能、病变严重程度及预后的一个非常重要的指标. 注射D-gal后各时间点血清PT明显高于基线值, 表明肝脏功能严重受损.
ALF患者发生肝性脑病是判断其预后的关键. 肝性脑病以意识水平的快速恶化, ICP增高和中枢灌注压降低为特征, 神经病理学改变为脑水肿. 研究表明, 血氨在ALF肝性脑病的发病过程中起着重要作用, 可以直接抑制兴奋性及抑制性突触后电位产生, 进而改变神经电活动[14]. 我们在本研究中发现在注射D-gal后血氨水平逐渐升高, 在高、中剂量两组中动物死亡前血氨达到基线值的9和6倍. 微传感器检测颅内压发现注射D-gal 48 h后高、中剂量组动物颅内压升高到基线值的两倍左右. 结合动物死亡前存在昏睡, 不能唤醒, 对疼痛刺激不敏感, 直至各种反射消失, 肌张力由增强变为降低, 表明动物死亡前发生了肝昏迷.
总之, 我们认为0.3 g/kg组所建模型符合理想的ALF模型要求[15], 一是从临床表现、生理生化指标及组织病理学改变证实发生了肝功能衰竭; 二是与临床上患者的肝衰竭进程相似, 后期发生肝性脑病的表现; 三是高剂量组生存时间太短, 没有治疗的时间窗, 动物就很快死亡. 而低剂量组除一只猴在98 h不明原因死亡外, 其他均存活, 且在60 h左右各项指标逐渐恢复, 这可能与肝脏的强大再生及恢复能力有关.
急性肝功能衰竭(ALF)因为病情复杂、影响因素多、缺乏对照而难以确切判断疗效. 建立理想的ALF动物模型, 是进行ALF研究的基础. 目前的ALF动物模型多是鼠、兔、猪、犬类.
张进祥, 副教授, 华中科技大学同济医学院附属协和医院
本研究是肝胆科对于终末期肝病处理方面的难点及急需解决的问题, 属本学科的研究热点. 目前生物人工肝的开发研究中大动物模型多采用猪、犬, 与人类的差异很大, 急需建立与人类似的动物模型, 为生物人工肝的临床应用奠定基础.
国内外的报道ALF模型甚多, 动物模型主要有两大类: 即药物肝损伤和外科手术模型.
本研究以非人灵长类动物雄性食蟹猴作为模型动物, 通过颈外静脉注射不同剂量的D-gal, 观察动物的临床、生化、及组织学变化特征, 成功建立了食蟹猴ALF模型并摸索出最佳药物剂量, 为国内外首次报道.
本研究选题较好, 设计合理, 具有很好的参考价值.
编辑 曹丽鸥 电编 吴鹏朕
| 3. | Rahman TM, Hodgson HJ. Animal models of acute hepatic failure. Int J Exp Pathol. 2000;81:145-157. [PubMed] [DOI] |
| 4. | García-Moreno LM, Conejo NM, González-Pardo H, Aller MA, Nava MP, Arias J, Arias JL. Evaluation of two experimental models of hepatic encephalopathy in rats. Braz J Med Biol Res. 2005;38:127-132. [PubMed] [DOI] |
| 5. | Uchida Y, Kaibori M, Hijikawa T, Ishizaki M, Ozaki T, Tanaka H, Matsui K, Tokuhara K, Kwon AH, Kamiyama Y. Protective effect of neutrophil elastase inhibitor (FR136706) in lethal acute liver failure induced by D-galactosamine and lipopolysaccharide in rats. J Surg Res. 2008;145:57-65. [PubMed] [DOI] |
| 6. | Totsugawa T, Yong C, Rivas-Carrillo JD, Soto-Gutierrez A, Navarro-Alvarez N, Noguchi H, Okitsu T, Westerman KA, Kohara M, Reth M. Survival of liver failure pigs by transplantation of reversibly immortalized human hepatocytes with Tamoxifen-mediated self-recombination. J Hepatol. 2007;47:74-82. [PubMed] [DOI] |
| 7. | Patzer JF, Block GD, Khanna A, Yin WY, Molmenti E, Gerber D, Kramer DJ, Scott VL, Aggarwal S, Wagner RA. D-galactosamine based canine acute liver failure model. Hepatobiliary Pancreat Dis Int. 2002;1:354-367. [PubMed] |
| 9. | McMillan JM, Jollow DJ. Galactosamine hepatotoxicity: effect of galactosamine on glutathione resynthesis in rat primary hepatocyte cultures. Toxicol Appl Pharmacol. 1992;115:234-240. [PubMed] [DOI] |
| 10. | Sass G, Heinlein S, Agli A, Bang R, Schümann J, Tiegs G. Cytokine expression in three mouse models of experimental hepatitis. Cytokine. 2002;19:115-120. [PubMed] [DOI] |
| 11. | Nakayama Y, Shimizu Y, Hirano K, Ebata K, Minemura M, Watanabe A, Sugiyama T. CTLA-4Ig suppresses liver injury by inhibiting acquired immune responses in a mouse model of fulminant hepatitis. Hepatology. 2005;42:915-924. [DOI] |
| 12. | Kitazawa T, Tsujimoto T, Kawaratani H, Fujimoto M, Fukui H. Expression of Toll-like receptor 4 in various organs in rats with D-galactosamine-induced acute hepatic failure. J Gastroenterol Hepatol. 2008;23:e494-e498. [PubMed] [DOI] |
| 13. | Giannini EG, Testa R, Savarino V. Liver enzyme alteration: a guide for clinicians. CMAJ. 2005;172:367-379. [PubMed] [DOI] |
| 14. | Ferenci P. Brain dysfunction in fulminant hepatic failure. J Hepatol. 1994;21:487-490. [PubMed] [DOI] |
| 15. | Terblanche J, Hickman R. Animal models of fulminant hepatic failure. Dig Dis Sci. 1991;36:770-774. [PubMed] [DOI] |