修回日期: 2010-04-25
接受日期: 2010-04-27
在线出版日期: 2010-06-28
目的: 探讨胃转移性恶性黑色素瘤的临床病理特征、鉴别诊断及治疗与预后.
方法: 报道1例胃转移性恶性黑色素瘤, 取胃活检经HE染色及免疫组织化学染色诊断. 并复习国内外相关文献.
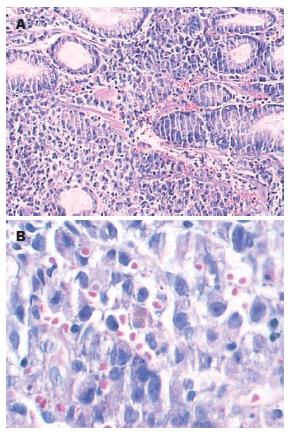
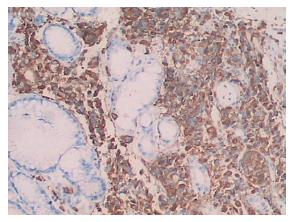
结果: 活检组织切片光镜下见胃黏膜固有层弥漫浸润的小细胞, 部分呈巢状排列, 细胞胞质较丰富, 核偏位, 核仁大而明显, 仅少部分细胞的胞质内可见黑色素颗粒. 免疫组织化学染色显示vimentin(+), S-100(+), HMB45(+), AE1/AE3(-). 病理诊断为胃(底、体交界)恶性黑色素瘤, 结合病史考虑为转移性.
结论: 恶性黑色素瘤转移到胃时没有典型临床表现, 若出现与原发肿瘤不相关的症状, 要高度怀疑转移. 主要与胃原发性肿瘤鉴别. 预后差. 对远处转移的最初部位为胃的患者, 进行根治性手术能有效缓解症状, 并可能对延长生存期有帮助.
引文著录: 孙静阳, 胡波, 于晶功, 裴笑月. 胃转移性恶性黑色素瘤1例. 世界华人消化杂志 2010; 18(18): 1928-1931
Revised: April 25, 2010
Accepted: April 27, 2010
Published online: June 28, 2010
AIM: To investigate the clinicopathologic characteristics, differential diagnosis, treatment and prognosis of metastatic malignant melanoma of the stomach.
METHODS: We reported a case of metastatic malignant melanoma of the stomach that was diagnosed by HE and immunohistochemistry staining. A literature review was also performed to summarize the clinicopathologic characteristics, diagnosis, treatment and prognosis of the disease.
RESULTS: Microscopic examination of the biopsy specimen revealed that a number of small cells, some of which were organized in nests, were scattered in gastric lamina propria. These neoplastic cells had relatively rich cytoplasm, eccentric nucleus and large and clear nucleolus. Few of these cells had melanin granules in the cytoplasm. Immunohistochemistry analysis showed that these neoplastic cells were positive for vimentin, S-100 and HMB45, but negative for AE1/AE3. The patient was finally diagnosed with metastatic malignant melanoma of the stomach at the borderline between the fundus and body.
CONCLUSION: Metastatic malignant melanoma of the stomach has no typical symptoms. A high index of suspicion for metastasis must be maintained when patients with a history of melanoma present with seemingly unrelated symptoms. The metastatic malignant melanoma of the stomach should mainly be distinguished from primary neoplasms of the stomach. The prognosis of metastatic malignant melanoma of the stomach is poor. A complete resection can be effective for palliation and may result in long-term survival in patients whose stomach is the initial site of distant metastases.
- Citation: Sun JY, Hu B, Yu JG, Pei XY. Metastatic malignant melanoma of the stomach: a case report and literature review. Shijie Huaren Xiaohua Zazhi 2010; 18(18): 1928-1931
- URL: https://www.wjgnet.com/1009-3079/full/v18/i18/1928.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i18.1928
恶性黑色素瘤(malignant melanoma)是一种高度恶性的肿瘤. 一般经淋巴道转移, 也可经血道转移, 多转移至肺、肝、脑等器官, 国内外均只见个案胃转移的报道, 现将我院遇到的1例恶性黑色素瘤伴有胃转移的病例报道如下, 并结合国内外文献探讨其临床病理特征及鉴别诊断.
女, 53岁, 2002-11于外院行右腹股沟肿物切除, 病理回报黑色素瘤, 因患者无法提供详细资料, 遂未能借阅当时病理切片. 2006-11发现右腹股沟区肿大结节, 于我院切除, 病理: (右腹股沟)淋巴结转移性恶性黑色素瘤, 免疫组织化学: CK(-), LCA(-), vimentin(+), HMB45(+), desmin(-). 患者拒绝任何治疗. 2008-05发现颈部、下腹部、右上臂内侧及左侧背部肿大结节, 于我院切除后病理诊断: (颈部、下腹部、右上臂内侧)淋巴结转移性恶性黑色素瘤; (左侧背部)增生纤维组织中见恶性黑色素瘤细胞; 免疫组织化学: vimentin(+), S-100(+), HMB45(+), AE1/AE3(-), desmin(-). 遂于我院住院化疗. 2008-10影像学检查发现双侧腋下、双侧锁骨上、纵隔、腹膜后淋巴结肿大, 甲状腺、肺、左肾、体内软组织均见软组织肿块影. 2008-11出现上消化道出血, 行胃镜检查, 取活检标本送病理. 并发现肝内占位, 全身多处皮下结节, 后继又出现双肾上腺及左眼球后占位.
标本经40 g/L中性甲醛固定, 常规脱水, 石蜡包埋, 3 μm厚切片, HE染色, 光镜观察. 免疫组织化学标记采用SP法, 所用试剂及抗体vimentin, S-100, HMB45, AE1/AE3均购自福州迈新生物技术开发有限公司.
胃镜显示胃底、体交界处4处隆起溃疡型占位, 最大一处约5 cm×3 cm大小, 周边环堤, 基底硬, 中心凹陷糜烂, 取病理三块. 另外三处病变大小均约为0.6 cm×0.5 cm. 病理巨检: 胃镜活检组织三小块, 灰白色质软, 大小均为0.2 cm×0.2 cm×0.2 cm.
胃黏膜固有层可见弥漫浸润的小细胞, 部分呈巢状排列, 瘤细胞胞质较丰富, 核偏位, 核仁大而明显, 仅少部分细胞的胞质内可见黑色素颗粒(图1). 调阅该患者2006-11及2008-05两次组织病理切片, 肿瘤细胞形态与此次活检组织瘤细胞形态相似, 只是前两次病理切片中胞质内含有黑色素颗粒的瘤细胞较本次略多.
免疫组织化学染色显示肿瘤细胞vimentin(+), S-100(+), HMB45(+)(图2), AE1/AE3(-).
胃(底、体交界)恶性黑色素瘤, 结合病史考虑为转移性. 该患者于胃转移确诊后5 mo(2009-04)死亡.
恶性黑色素瘤根据发生部位的不同可分为皮肤及黏膜恶性黑色素瘤两大类[1], 影响预后最重要的因素是美国癌症联合会(AJC)分级[2]. 恶性黑色素瘤转移至胃者少见, 经由中国知网、万方数据、Pubmed搜索, 国外报道20余例, 国内报道15例.
恶性黑色素瘤的恶性度高, 容易发生转移, 转移可发生于原发病变确诊时, 也可发生于几十年以后[3]. 主要通过淋巴道播散, 也可经血行转移, 较为特殊的是恶性黑色素瘤周围卫星结节形成, 可能通过血行或淋巴道转移所致, 后者即称为中途转移[4]. 发生血行转移时, 以肺、肝、脑多见, 胃罕见. 216例尸检病例中, 最常见的转移部位为淋巴结(73.6%)和肺(71.3%), 其他部位依次为肝(58.3%), 脑(54.6%), 骨(48.6%)和肾上腺(46.8%), 多器官转移常见(95%)[5]. 恶性黑色素瘤发生广泛转移时, 偶尔累及到胃.
恶性黑色素瘤转移至胃肠道常见的部位为小肠50%(8/16), 结肠31.3%(5/16), 直肠肛门25%(4/16)[6]. 临床上恶性黑色素瘤转移至胃肠道的确诊率仅为2%, 而在因恶性黑色素瘤广泛转移而死亡的患者尸检中, 检出率却达到60%[7]. 这可能是由于其没有典型的临床表现, 与胃肠道其他疾病的临床表现相似, 包括腹痛, 乏力, 恶心, 小肠梗阻, 便秘, 呕血, 黑便, 贫血等. 因此对于有恶性黑色素瘤病史的患者, 若出现腹痛、腹胀、贫血或黑便等与原发肿瘤不相关的症状, 要高度警惕胃肠道转移的可能性, 及时安排内镜检查.
恶性黑色素瘤转移至胃, 病灶可无明显色素沉着. 大体类型多表现为3种: 单个隆起型, 表面可形成溃疡; 多发隆起型, 呈多个单个隆起型表现; 弥漫型. 多发隆起型较多见, 国内报道15例中9例为多发隆起型, 本例也为多发隆起型, 隆起中心凹陷糜烂. 吴志强等[8]报道1例胃窦后壁带蒂息肉样转移, 形态较为特殊. 转移部位以胃体, 胃底多见, 国内报道15例中12例发生于胃底、体, 其中胃底、体均有6例, 只胃体5例, 胃底、体交界处1例, 本例发生于胃底、体交界处.
胃的转移性肿瘤不常见, 尸检证实小于2%(17/1010[9], 92/7165[10]), 文献报道多数转移自乳腺癌, 其次是恶性黑色素瘤和肺癌[11]. 因此胃的转移性恶性黑色素瘤主要与胃的原发性肿瘤进行鉴别. (1)低分化腺癌: 胃的活检标本中, 黑色素瘤细胞常弥散分布, 部分可呈巢状排列, 胞质丰富, 核仁大而明显, 黑色素颗粒少, 不易观察到, 易误诊为低分化腺癌. 本例初诊时即考虑为低分化腺癌, 后经详细询问临床病史及免疫组织化学标记HMB45(+), S-100(+), AE1/AE3(-), 证实为转移性恶性黑色素瘤. (2)胃原发性恶性黑色素瘤: 极为少见, 形态学上与转移性恶性黑色素瘤很难鉴别, 因此应仔细询问病史、查找原发灶. 胃原发性恶性黑色素瘤可能来源于贲门鳞状上皮内的黑色素细胞[12], 如果发现瘤旁黏膜内存在交界性病变如黑色素细胞异常增生活跃, 患者没有皮肤等其他部位的原发黑色素瘤, 只有胃内独立的病灶, 没有发现其他部位的转移灶, 这些特点可能提示为胃的原发性恶性黑色素瘤. (3)恶性淋巴瘤: 胃的恶性淋巴瘤细胞也多为小细胞, 呈弥散分布, 但其胞质内无黑色素颗粒, 免疫组织化学标记HMB45, S-100为阴性. (4)当瘤细胞形态以梭形细胞为主时, 还要注意与胃GIST, 恶性神经鞘瘤, 平滑肌肉瘤等胃的肉瘤进行鉴别, 免疫组织化学标志物HMB45, CD117, S-100, SMA, Desmin等能有效地帮助鉴别诊断. (5)胃的其他转移性肿瘤: 有原发病史, 通过形态学多数比较容易鉴别.
治疗方法包括外科手术、化疗、免疫治疗、生物化学疗法等. 出现恶性肿瘤胃转移的患者预后非常差, 平均生存时间为11 mo[13]. 国内外较多文献中均提及对胃肠道转移性恶性黑色素瘤患者有选择性地进行根治性手术可以减轻症状, 延长生存期. 国内报道的文献中, 1例鼻腔恶性黑色素瘤转移到胃的患者, 经胃大部分切除术后存活18 mo死亡[14], 其余有随访资料的均未活过6 mo. Ollila等[15]在其回顾性的文献报道中指出, 胃肠道转移性恶性黑色素瘤的患者, 进行根治性切除术的中位生存期为48.9 mo, 进行姑息性手术和未进行手术的患者分别为5.4 mo和5.7 mo, 最初的远处转移部位为胃肠道, 并进行转移灶的彻底清除, 是能够延长生存期的2个最重要的因素. Ricaniadis等[16]在其研究报道中提出, 恶性黑色素瘤胃肠道转移的患者不适合做手术的中位生存期为2.9 mo, 进行胃肠道转移灶的彻底清除, 并且无其他部位转移灶的中位生存期为27.6 mo, 伴有其他部位转移灶的为5.1 mo. 综合这些研究报道可见对于最初远处转移部位为胃的恶性黑色素瘤患者, 进行根治性手术能有效地缓解症状, 并很可能对延长生存期有帮助. 本例患者为皮肤恶性黑色素瘤切除后6年全身广泛转移, 后累及到胃, 无手术适应证, 于发现胃转移后存活5 mo死亡.
恶性黑色素瘤(malignant melanoma)是一种高度恶性的肿瘤. 一般经淋巴道转移, 也可经血道转移, 多转移至肺、肝、脑等器官, 国内外均只见个案胃转移的报道.
朴云峰, 教授, 吉林大学第一临床医院消化科; 陈钟, 主任医师, 南通大学附属医院普外科; 刘勇钢, 副主任医师, 天津市传染病医院病理科
国内报道的文献中, 1例鼻腔恶性黑色素瘤转移到胃的患者, 经胃大部分切除术后存活18 mo死亡, 其余有随访资料的均未活过6 mo.
对于最初远处转移部位为胃的恶性黑色素瘤患者, 进行根治性手术能有效地缓解症状, 并很可能对延长生存期有帮助.
本文报道了1例黑色素瘤胃转移并复习国内外文献, 对其临床病理特征、诊断及治疗进行了综述, 使临床医师对其发生与转归有了进一步的认识.
编辑 曹丽鸥 电编 何基才
| 3. | Pommer B, Probst A, Messmann H. Gastric metastases from malignant melanoma. Endoscopy. 2008;40 Suppl 2:E30-E31. [PubMed] [DOI] |
| 5. | Liang KV, Sanderson SO, Nowakowski GS, Arora AS. Metastatic malignant melanoma of the gastrointestinal tract. Mayo Clin Proc. 2006;81:511-516. [PubMed] [DOI] |
| 6. | Blecker D, Abraham S, Furth EE, Kochman ML. Melanoma in the gastrointestinal tract. Am J Gastroenterol. 1999;94:3427-3433. [PubMed] [DOI] |
| 7. | Stukavec J, Horák L. [The malignant melanoma metastasis into the stomach corpus]. Rozhl Chir. 2005;84:148-150. [PubMed] |
| 8. | Schmoldt A, Benthe HF, Haberland G. Digitoxin metabolism by rat liver microsomes. Biochem Pharmacol. 1975;24:1639-1641. [PubMed] |
| 9. | Menuck LS, Amberg JR. Metastatic disease involving the stomach. Am J Dig Dis. 1975;20:903-913. [PubMed] [DOI] |
| 10. | Berge T, Lundberg S. Cancer in Malmö 1958-1969. An autopsy study. Acta Pathol Microbiol Scand Suppl. 1977;1-235. [PubMed] |
| 11. | Kanthan R, Sharanowski K, Senger JL, Fesser J, Chibbar R, Kanthan SC. Uncommon mucosal metastases to the stomach. World J Surg Oncol. 2009;7:62. [PubMed] [DOI] |
| 13. | Hamlilton SR, Aaltonen LA, 虞 积耀, 崔 全才. 消化系统肿瘤病理学和遗传学. 第1版. 北京: 人民卫生出版社 2006; 77. |
| 15. | Ollila DW, Essner R, Wanek LA, Morton DL. Surgical resection for melanoma metastatic to the gastrointestinal tract. Arch Surg. 1996;131:975-99; 975-99;. [PubMed] |
| 16. | Ricaniadis N, Konstadoulakis MM, Walsh D, Karakousis CP. Gastrointestinal metastases from malignant melanoma. Surg Oncol. 1995;4:105-110. [PubMed] [DOI] |