修回日期: 2010-06-09
接受日期: 2010-06-12
在线出版日期: 2010-06-28
目的: 研究放疗联合热疗对肝癌细胞有无协同杀伤作用, 为临床应用提供实验依据.
方法: 以人肝癌细胞株HepG2为研究对象, 实验分成4组: (1)对照组; (2)单纯热疗组; (3)单纯放疗组; (4)放疗与热疗联合组. 各组分别进行实验. 采用流式细胞术检测细胞凋亡情况, 电镜观察肝癌细胞的超微结构, 免疫组织化学检测P53蛋白表达变化.
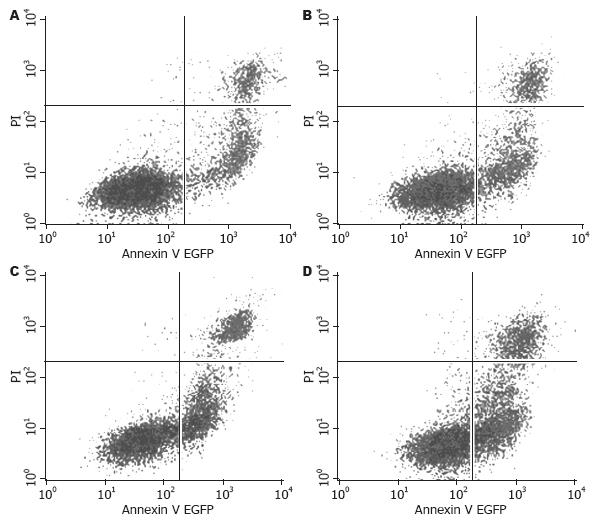
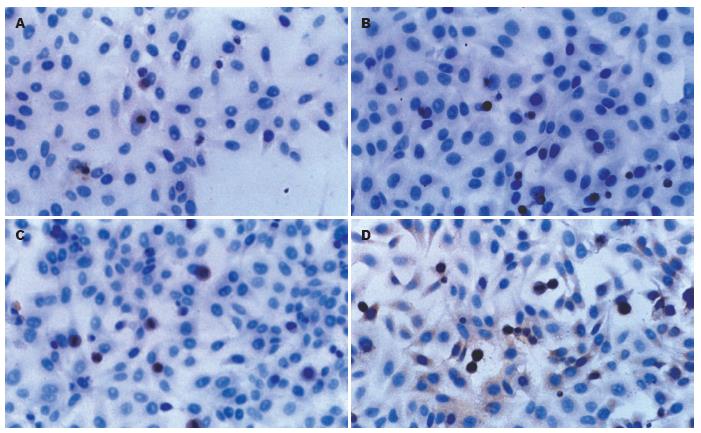
结果: 与对照组相比, 3个治疗组的肿瘤细胞的凋亡率均增加(19.98%±1.76%, 20.83%±1.84%, 32.16%±2.03% vs 16.47%±1.24%, P<0.05或0.01), 细胞超微结构损伤, P53蛋白的表达增加(34.98%±1.16%, 35.21%±1.23%, 45.50%±1.55% vs 32.00%±1.05%, P<0.05或0.01); 与单纯的放疗或热疗组相比, 放疗与热疗联合组的肝癌细胞凋亡率明显增高(P<0.01), 超微结构损伤更显著, P53蛋白的表达显著增加(P<0.01).
结论: 放疗联合热疗对肝癌细胞的杀伤有协同作用, 其机制可能通过上调P53蛋白表达, 诱导细胞凋亡实现的.
引文著录: 张力, 马立辉, 龚明玉, 王宁, 王广, 杨玉香, 柳逢春. 放疗联合热疗对肝癌细胞的协同杀伤作用. 世界华人消化杂志 2010; 18(18): 1879-1884
Revised: June 9, 2010
Accepted: June 12, 2010
Published online: June 28, 2010
AIM: To investigate whether radiotherapy (RT) and thermotherapy (TT) have a synergistic killing effect on hepatoma cells (HepG2) in vitro.
METHODS: Human HepG2 cells were divided into four groups: control group, TT group, RT group, and RT plus TT group. Cell apoptosis was determined by flow cytometry (FCM) assay. The ultrastructural alterations of HepG2 cells were observed under a transmission electron microscope. The expression of P53 protein was detected by immunohistochemistry.
RESULTS: Compared with the control group, the apoptosis rate significantly increased (19.98% ± 1.76%, 20.83% ± 1.84% and 32.16% ± 2.03% vs 16.47% ± 1.24%, all P < 0.05 or 0.01), cell ultrastructural alterations were more significant, and the expression of P53 protein was significantly up-regulated (34.98% ± 1.16%, 35.21% ± 1.23%, 45.50% ± 1.55% vs 32.00% ± 1.05%, all P < 0.05 or 0.01) in the TT group, RT group, and RT plus TT group, which were most prominent in the RT plus TT group.
CONCLUSION: RT and TT exert a synergistic killing effect on hepatoma cells possibly by up-regulating P53 expression and inducing apoptosis.
- Citation: Zhang L, Ma LH, Gong MY, Wang N, Wang G, Yang YX, Liu FC. Synergistic killing effect of radiotherapy and thermotherapy on hepatoma cells in vitro. Shijie Huaren Xiaohua Zazhi 2010; 18(18): 1879-1884
- URL: https://www.wjgnet.com/1009-3079/full/v18/i18/1879.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i18.1879
原发性肝癌是严重危害人类生命健康的重大疾病之一, 据统计, 每年全球肝癌发病率位居恶性肿瘤发病率的第5位, 死亡率居第3位[1], 而其中55%的病例发生在中国[2]. 由于我国肝癌大部分伴有肝硬化或慢性肝炎, 按大范围的规则肝切除可导致并发症的发生率及病死率增加[3]. 而局部小范围切除虽可以降低病死率, 但往往导致肿瘤切除不彻底, 术后复发率升高. 而对于不能手术的肝癌患者目前较为常用的有介入治疗、放射治疗、聚焦超声[4]、射频[5]、微波、冷冻[6]等方法, 但单一的治疗方法, 效果并不显著. 临床证明, 肿瘤的各种治疗手段合理综合利用, 可明显提高治愈率, 热疗与放疗联合作用较为常见, 是提高肿瘤疗效的主要途径和肿瘤临床研究的主要方向之一. 但放疗与热疗联合作用对肝癌细胞HepG2的影响未见报道. 本文探讨放疗联合热疗对肝癌细胞有无协同杀伤作用, 并探讨其可能的作用机制, 为临床进行放疗、热疗综合治疗肝癌提供实验依据.
RPMI 1640培养基(Gibco公司), 肝癌细胞株HepG2、Annexin V-EGFP凋亡试剂盒(南京凯基生物科技有限公司), 野生型P53单克隆抗体(福州迈新公司).
1.2.1 细胞培养: 人肝癌细胞株HepG2: 为单层贴壁生长, 置于培养液为RPMI 1640培养基, 内含10%新生牛血清, 100 kU/L青霉素, 100 mg/L链霉素, 37 ℃, 50 mL/L CO2培养箱内培养至指数生长期进行实验, 隔2-3 d传代1次, 细胞消化液为0.25%的胰酶. 按每瓶5 μL(1×104)细胞悬液接种于培养瓶内, 于37 ℃, 50 mL/L CO2培养箱内培养24 h后(细胞已贴壁), 用于实验.
1.2.2 分组: (1)对照组: 不做任何处理, 一直在培养箱内; (2)单纯热疗组: 随机取4瓶细胞, 分别置于温度为43 ℃±0.1 ℃水浴箱内, 加热1.5 h, 再放回37 ℃, 50 mL/L CO2培养箱内继续培养24 h; (3)单纯放疗组: 随机取4瓶细胞, 应用6 MV-X线, 源皮距100 cm, 剂量率350 cGy/min, 照射野面积10 cm×10 cm, 培养皿上下各加1.5 cm的蜡膜. 照射剂量为4 Gy, 照射后再放回37 ℃, 50 mL/L CO2培养箱内继续培养24 h; (4)放疗联合热疗组: 随机取4瓶细胞, 先放疗后再热疗, 条件同前, 然后再放回37 ℃, 50 mL/L CO2培养箱内继续培养24 h.
1.2.3 Annexin V/PI双染法检测细胞凋亡: 取各组HepG2细胞, 用0.25%胰酶消化, 1 000 r/min离心10 min, 弃上清. 加入1 mL冷的PBS, 轻轻震荡使细胞悬浮, 重复上述步骤. 将细胞重悬于250 μL Binding Buffer, 加入10 μL Annexin V-EGFP和5 μL PI, 轻轻混匀, 室温避光反应15 min, 上机检测. 自动检测出肝癌细胞凋亡率. 结果判定: Annexin V-/PI-为正常细胞, Annexin V+/PI-为凋亡细胞, Annexin V+/PI+为坏死细胞.
1.2.4 电镜观察肝癌细胞超微结构: 取各处理组细胞, 用0.25%胰酶消化, 高速离心1 min, 弃上清, 取离心细胞团, 常规电镜样品包埋, 半薄切片, 光镜选区定位, 超薄切片, 铀、铅双染, 透射电镜(JEOL 100CX2Ⅱ)下观察肝癌细胞超微结构变化.
1.2.5 SP免疫组织化学检测P53蛋白的表达: 滴片法制作细胞涂片, 冰丙酮固定, 将固定的细胞涂片用3% H2O2室温孵育10 min消除内源性过氧化氢酶的活性, PBS洗5 min×3; 置于0.01%枸橼酸盐缓冲液中, 微波炉抗原修复; PBS洗5 min×3, 滴加非免疫血清封闭液, 室温孵育20 min; 倾去血清后直接滴加1∶100的P53一抗, 于4 ℃下过夜; PBS洗5 min×3, 滴加生物素标记二抗, 室温下1 h; PBS洗5 min×3, 滴加HRP-SA, 于室温下放置1 h; PBS洗5 min×3, 滴加DAB进行显色; 苏木素复染细胞核, 脱水、透明、封片. 常规设立阴性对照. 结果判定: 阳性信号呈棕黄色颗粒, P53表达于胞核. 定量分析: 在光学显微镜400倍视野下, 每张切片随机选取阳性细胞分布均匀的5个视野, 计数着色细胞占视野细胞总数的百分数, 取平均值.
统计学处理 采用SPSS10.0统计软件, 实验数据用mean±SD表示, 计量资料多组间的比较用方差分析, 采用q检验.
与对照组相比, 3个治疗组(分别是单纯热疗组、单纯放疗组、放疗联合热疗组)的肿瘤细胞的凋亡率均增加(19.98%±1.76%、20.83%±1.84%、32.16%±2.03% vs 16.47%±1.24%, P<0.05, <0.01), 与单纯的放疗或热疗组相比, 放疗与热疗联合组的肝癌细胞凋亡率明显增高(32.16%±2.03% vs 19.98%±1.76%、20.83%±1.84%, P<0.01), 提示放疗与热疗联合应用可明显提高肝癌细胞的凋亡(图1).
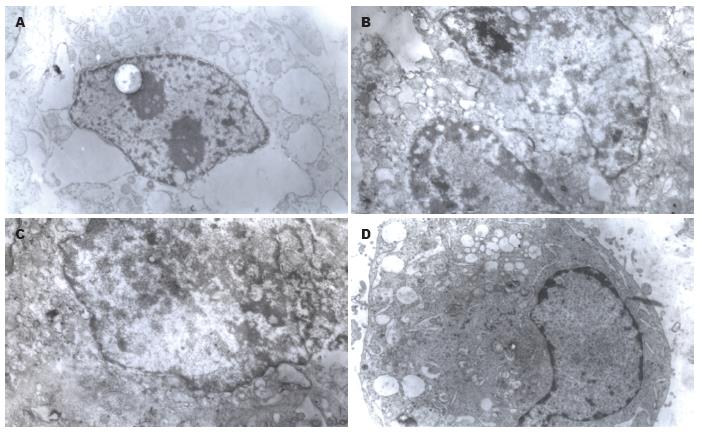
透射电镜下, 对照组细胞形态正常, 边界清楚, 细胞表面有着丰富的微绒毛, 细胞器正常, 常染色质丰富, 异染色质少; 3个治疗组的细胞表面微绒毛消失, 常染色质溶解, 异染色质增多, 部分核染色质固缩、边集, 呈新月形, 胞质内有很多空泡形成, 以放疗联合热疗组细胞超微结构损伤更明显(图2).
与对照组比较, 3个治疗组(分别是单纯热疗组、单纯放疗组、放疗联合热疗组)HepG2细胞中凋亡相关基因P53蛋白表达阳性百分率明显增加(34.98%±1.16%, 35.21%±1.23%, 45.50%±1.55% vs 32.00%±1.05%, P<0.05, <0.01), 与单纯的放疗或热疗组相比, 放疗与热疗联合组的P53基因的表达明显增高(45.50%±1.55% vs 34.98%±1.16%, 35.21%±1.23%, P<0.01, 图3).
恶性肿瘤是危害人类健康的严重疾病之一, 治疗方式主要有手术、化疗、放疗和生物治疗等, 而肿瘤热疗是继上述方法后出现的第5种肿瘤治疗方法[7,8]. 目前肿瘤热疗在临床上已得到较广泛的应用, 并显出较好的疗效[9,10]. 基础和临床均表明, 单一的肿瘤治疗方法疗效并不满意. 大量的随机临床试验验证了热疗是一种有效的治疗肿瘤方法, 与放疗和化疗联合有很好的协同增效作用[11]. 美国NCCN指南也把热疗写入某些肿瘤的综合治疗方案[12,13]. 热疗与单独放疗相比, 热疗和放疗联合应用, 可使许多难以控制的转移性肿瘤、复发性肿瘤、局部晚期肿瘤的局部控制率得到明显提高, 且不增加其急性或晚期并发症[14]. 据报道, 热疗与放疗并用强于单纯热疗或放疗, 两者有协同增效作用[15]. 其协同作用主要体现在三方面: (1)抑制放射诱导的DNA损伤的修复. 放射线可以引起细胞DNA链断裂, 单链断裂可以在DNA修复酶的作用下得到修复, 而双链断裂常会导致细胞死亡, 是诱导细胞死亡的关键[16,17]. Xu等[18,19]经研究发现, 细胞核内双链断裂修复蛋白MRE11是热放射增敏的主要靶蛋白, 加热可使MRE11分布水平的改变而引起与细胞死亡相关的微核变化, 从而引起细胞对放射敏感性的提高. (2)热疗和放疗对细胞周期各时相的敏感性不同, 射线对G2后期和M期最敏感, 而S期对放射线抗拒, 对热疗最敏感. Zölzer等[20]对人类恶性黑色素瘤细胞的研究表明, 43 ℃ 1 h的加热可使G2-M期由6 h延长至13 h, G2期阻滞达48 h, S期阻滞则更久. 可见加热可使细胞周期再分布, 并使多数细胞停滞在S期和G2期, 增强了热和射线对细胞损伤的互补作用, 提高了细胞的放射敏感性. (3)降低乏氧细胞比例. Feyerabend等[21]研究发现, 适当温度的热疗(41.5 ℃)增加了肿瘤的血流量和氧化程度, 热疗与放疗相结合在一定程度上提高了肿瘤的辐射敏感度. 有许多基础和临床试验均对热放疗的疗效给以肯定, Abe等[22]报道, 在直肠癌治疗中, 采用热疗、放疗、热放疗, 结果显示热放疗组疗效最好. Maluta等[23]用适形放疗联合热疗治疗了144例局部晚期前列腺癌患者, 结果5年总生存率为87%. 近年来, 细胞凋亡在肿瘤治疗中的重要作用引起了广泛关注. 本实验中, 流式细胞仪显示, 热疗、放疗及热放疗都可以诱导肿瘤细胞凋亡, 而热放疗组的细胞凋亡比例最高; 超微结构证实, 热放疗组的肝癌细胞超微结构损伤更明显, 呈新月体样改变. 这说明热疗、放疗均可诱导HepG2细胞凋亡, 且热放疗对肝癌细胞HepG2的杀伤具有协同效应.
细胞凋亡是细胞自身一种主动死亡方式, 近年来对他的研究十分活跃, 广泛涉及到肿瘤、衰老及退行性变等一系列疾病[24], 细胞凋亡受一系列相关基因的调控, 其中Bcl-2家族、ICE家族、Myc、P53、Rb等基因与之关系密切[25]. P53状态是热敏感性的一个决定性因素, 为影响热诱导肿瘤细胞凋亡的主要因子. 在野生型P53(P53wt)的肿瘤细胞比P53缺失或突变的热敏性高, P53wt的表达可增加20%的肿瘤热敏感性, 所以P53可以作为判断肿瘤热疗疗效的指标[26,27]. 当P53功能正常, 热疗后, 经P53信号传导, 激活caspase-3, 经过一系列级联反应引起PARP(多聚核糖ADP聚合酶)、肌动蛋白等蛋白的分解, DNA分解, 肿瘤细胞凋亡. 野生型P53可抑制HSP70诱导的抗凋亡信号的产生, 增加凋亡[28]. Yasumoto等[29]报道热疗能诱导舌鳞状上皮细胞癌凋亡相关的野生型P53的表达. 发现P53wt基因对热敏感, 而突变型(P53m)对热敏感性明显降低. 本实验采用免疫组化染色方法观察体外培养的肝癌细胞经不同处理后P53基因表达的变化, 3个治疗组野生型P53基因表达均较对照组增加, 而以热放疗组的野生型P53基因表达增高最显著(P<0.01), 提示放疗联合热疗对肝癌细胞的协同杀伤效应可能通过诱导野生型P53基因表达增多, 促进细胞凋亡实现的. 近年来, 肿瘤放化疗的分子生物学以及细胞和动物实验研究方面进展很快, 本实验从细胞凋亡方面探讨放疗联合热疗对肝癌细胞的协同治疗作用, 为我们进一步开展放疗联合热疗的临床试验提供了理论基础和指导.
总之, 热疗作为一种新疗法, 在与放疗或化疗的联合应用中取得的疗效是毋庸置疑的, 而且肿瘤热疗技术以其无创或微创、安全性较好的特点而备受关注. 合理、有效地利用热疗, 可以明显提高对常规放、化疗不敏感肿瘤控制率, 改善治愈率和生存率. 但是本实验是体外实验, 与动物实验和人体实验还有一定的差距, 而且受实验条件所限, 加热温度也比较单一, 所以结果有一定的局限性. 为了进一步了解热放疗治疗肿瘤的机制, 尚需大量体内外实验. 在临床上要针对不同患者的实际情况, 选择合适的照射剂量及时间、加热时间, 以达到最佳的治疗目的.
肿瘤的发生是细胞过度增殖和细胞凋亡不足引起的. 因此, 促进细胞凋亡成为治疗肿瘤的新靶点. 野生型P53蛋白在维持细胞正常生长、抑制恶性增殖以及诱导细胞凋亡中起重要作用. 近年来, 肿瘤的各种治疗方法对细胞凋亡的影响及P53蛋白表达的研究是该研究领域的热点. 本实验通过放疗联合热疗对HepG2细胞凋亡的影响及野生型P53蛋白表达的检测, 为临床放疗联合热疗治疗肝癌提供了新的理论基础.
郑鹏远, 教授, 郑州大学第二附属医院消化科; 田字彬, 教授, 青岛大学医学院附属医院消化内科
国内外有人报道单独化疗及热化疗可诱导HepG2细胞凋亡及其机制, 但放疗联合热疗对HepG2细胞凋亡的影响及具体机制未见报道.
本文通过用不同方式单纯热疗、单纯放疗及放热疗联合诱导体外培养的HepG2细胞凋亡及增加野生型P53蛋白表达的机制, 为临床上肝癌的综合治疗提供了新的思路.
本文观察不同肿瘤治疗方法通过促进野生型P53蛋白表达而诱导HepG2细胞凋亡的情况, 从而为临床综合治疗肿瘤提供了新的理论依据.
本研究从细胞凋亡方面探讨放疗联合热疗对肝癌细胞的协同治疗作用, 为临床开展放疗联合热疗提供了理论基础, 有一定临床实用价值.
编辑 李军亮 电编 何基才
| 1. | El-Serag HB, Rudolph KL. Hepatocellular carcinoma: epidemiology and molecular carcinogenesis. Gastroenterology. 2007;132:2557-2576. [PubMed] [DOI] |
| 2. | Parkin DM, Bray F, Ferlay J, Pisani P. Global cancer statistics, 2002. CA Cancer J Clin. 2005;55:74-108. [PubMed] [DOI] |
| 6. | 周 霖, 杨 永平, 刘 静, 冯 永毅, 陆 荫英, 王 春平, 王 新真, 安 林静, 张 昕, 郝 丽燕. 氩氦刀冷冻治疗早期肝癌疗效分析. 胃肠病学和肝病学杂志. 2008;17:1000-1002. |
| 8. | Prosnitz LR, Dewhirst MW. Progress toward a thermal dosimetry system. Int J Radiat Oncol Biol Phys. 1995;33:963-964. [PubMed] [DOI] |
| 9. | Zwischenberger JB, Vertrees RA, Bedell EA, McQuitty CK, Chernin JM, Woodson LC. Percutaneous venovenous perfusion-induced systemic hyperthermia for lung cancer: a phase I safety study. Ann Thorac Surg. 2004;77:1916-1924; discussion 1925. [PubMed] |
| 10. | Tranberg KG. Percutaneous ablation of liver tumours. Best Pract Res Clin Gastroenterol. 2004;18:125-145. [PubMed] [DOI] |
| 11. | Wust P, Hildebrandt B, Sreenivasa G, Rau B, Gellermann J, Riess H, Felix R, Schlag PM. Hyperthermia in combined treatment of cancer. Lancet Oncol. 2002;3:487-497. [PubMed] [DOI] |
| 12. | Yasuda M, Kondo M, Kokura S, Naito Y, Norimasa Y, Yoshikawa T. Comparison of concomitant gemcitabine chemotherapy and local hyperthermia, gemcitabine monochemotherapy, and local hyperthermia monotherapy for inoperable progressive pancreatic cancer. J Clin Oncol. 2008;26:15672-15676. |
| 13. | National Comprehensive Cancer Network. NCCN Clinical Practice Guidelines in Oncology. NCCN online, 2009-10, cited 2010-05. Available from: http: //www.nccn-asia.org/cn/Adaptation.aspx?CatorID=51. |
| 14. | Sakurai H, Hayakawa K, Mitsuhashi N, Tamaki Y, Nakayama Y, Kurosaki H, Nasu S, Ishikawa H, Saitoh JI, Akimoto T. Effect of hyperthermia combined with external radiation therapy in primary non-small cell lung cancer with direct bony invasion. Int J Hyperthermia. 2002;18:472-483. [PubMed] [DOI] |
| 15. | 刘 本春, 张 元芳. 肿瘤热疗研究进展. 国外医学•肿瘤学分册. 2004;31:758-760. |
| 16. | Kampinga HH, Dynlacht JR, Dikomey E. Mechanism of radiosensitization by hyperthermia (& gt; or = 43 degrees C) as derived from studies with DNA repair defective mutant cell lines. Int J Hyperthermia. 2004;20:131-139. [PubMed] [DOI] |
| 17. | Takahashi A, Matsumoto H, Nagayama K, Kitano M, Hirose S, Tanaka H, Mori E, Yamakawa N, Yasumoto J, Yuki K. Evidence for the involvement of double-strand breaks in heat-induced cell killing. Cancer Res. 2004;64:8839-8845. [PubMed] [DOI] |
| 18. | Xu M, Myerson RJ, Hunt C, Kumar S, Moros EG, Straube WL, Roti Roti JL. Transfection of human tumour cells with Mre11 siRNA and the increase in radiation sensitivity and the reduction in heat-induced radiosensitization. Int J Hyperthermia. 2004;20:157-162. [DOI] |
| 19. | Xu M, Myerson RJ, Straube WL, Moros EG, Lagroye I, Wang LL, Lee JT, Roti Roti JL. Radiosensitization of heat resistant human tumour cells by 1 hour at 41.1 degrees C and its effect on DNA repair. Int J Hyperthermia. 2002;18:385-403. [PubMed] [DOI] |
| 20. | Zölzer F, Streffer C. G2-phase delays after irradiation and/or heat treatment as assessed by two-parameter flow cytometry. Radiat Res. 2001;155:50-56. [PubMed] [DOI] |
| 21. | Feyerabend T, Wiedemann GJ, Steeves R. Advanced non-seminomatous germ cell cancer of the testis with brain metastases: feasibility of additional brain irradiation and whole body hyperthermia plus chemotherapy. Oncol Rep. 2001;8:219-223. [PubMed] |
| 22. | Abe T, Sakaguchi Y, Ohno S, Ikeda Y, Kitamura K, Maehara Y, Sugimachi K. Apoptosis and p53 overexpression in human rectal cancer; relationship with response to hyperthermo-chemo-radiotherapy. Anticancer Res. 2001;21:2115-2120. [PubMed] |
| 23. | Maluta S, Dall'Oglio S, Romano M, Marciai N, Pioli F, Giri MG, Benecchi PL, Comunale L, Porcaro AB. Conformal radiotherapy plus local hyperthermia in patients affected by locally advanced high risk prostate cancer: preliminary results of a prospective phase II study. Int J Hyperthermia. 2007;23:451-456. [PubMed] [DOI] |
| 24. | Grimberg A. P53 and IGFBP-3: apoptosis and cancer protection. Mol Genet Metab. 2000;70:85-98. [PubMed] [DOI] |
| 25. | Ohnishi K, Ohnishi T. Heat-induced p53-dependent signal transduction and its role in hyperthermic cancer therapy. Int J Hyperthermia. 2001;17:415-427. [PubMed] [DOI] |
| 26. | Ota I, Ohnishi K, Takahashi A, Yane K, Kanata H, Miyahara H, Ohnishi T, Hosoi H. Transfection with mutant p53 gene inhibits heat-induced apoptosis in a head and neck cell line of human squamous cell carcinoma. Int J Radiat Oncol Biol Phys. 2000;47:495-501. [PubMed] [DOI] |
| 27. | Okamoto K, Shinoura N, Egawa N, Asai A, Kirino T, Shibasaki F, Shitara N. Adenovirus-mediated transfer of p53 augments hyperthermia-induced apoptosis in U251 glioma cells. Int J Radiat Oncol Biol Phys. 2001;50:525-531. [PubMed] [DOI] |
| 28. | Qi V, Weinrib L, Ma N, Li JH, Klamut H, Liu FF. Adenoviral p53 gene therapy promotes heat-induced apoptosis in a nasopharyngeal carcinoma cell line. Int J Hyperthermia. 2001;17:38-47. [PubMed] |
| 29. | Yasumoto J, Kirita T, Takahashi A, Ohnishi K, Imai Y, Yuki K, Ohnishi T. Apoptosis-related gene expression after hyperthermia in human tongue squamous cell carcinoma cells harboring wild-type or mutated-type p53. Cancer Lett. 2004;204:41-51. [PubMed] [DOI] |