修回日期: 2010-05-17
接受日期: 2010-05-25
在线出版日期: 2010-06-18
目的: 明确肝硬化门脉高压前后VEGFR-1、2在肝脏血管的分布变化.
方法: SD♂大鼠30只, 体质量180-220 g. 动物随机分为肝硬化门脉高压模型组(n = 20)和随正常对照组(n = 10). 正常对照组正常饮水饮食, 实验组采用硫代乙酰胺皮下注射法制作肝硬化门脉高压模型. 12 wk后经组织病理学检查证实肝脏有假小叶形成和门静脉压力大于1.57 kPa的大鼠共12只纳入本研究. 采用免疫组织化学染色法, 分别观察VEGFR-1和VEGFR-2的变化特点.
结果: VEGFR-2在肝硬化门静脉高压组大鼠的小叶间动脉和静脉中的表达均显著高于正常对照组(t = 24.306, 54.776, 均P<0.05). VEGFR-1在肝硬化门静脉高压组大鼠的小叶间动脉和静脉中的表达也显著高于正常对照组(t = 20.669, 33.210, 均P<0.05). VEGFR-2在肝硬化门脉高压组大鼠的小叶间静脉的表达显著高于小叶间动脉(t = 23.424, P<0.05); 而VEGFR-1在门脉高压组大鼠的小叶间动脉和小叶间静脉的表达几乎无明显差异(t = 1.434, P>0.05).
结论: VEGFR-2可能通过促进肝内小叶间静脉的新生血管生成代偿性降低门静脉高压.
引文著录: 徐珊珊, 赵金满, 杨思贤. 门脉高压肝脏小叶间动脉与小叶间静脉血管内皮生长因子受体的分布. 世界华人消化杂志 2010; 18(17): 1756-1760
Revised: May 17, 2010
Accepted: May 25, 2010
Published online: June 18, 2010
AIM: To observe the distribution of vascular endothelial growth factor receptor-1 and -2 (VEGFR-1 and -2) in both hepatic arteries and veins of rats with portal hypertension (PHT).
METHODS: Thirty male Sprague-Dawley rats, weighing 180-220 g, were randomly divided into two groups: normal control group (n = 10), and model group (n = 20). The normal control group was given normal drinking water, while the model group was given drinking water containing thioacetamide (TAA). Twelve weeks later, 12 rats who had a portal pressure > 1.57 kPa and obvious pseudolobules were selected for subsequent experiments. The distribution of VEGFR-1 and -2 in both hepatic arteries and veins of these rats was determined by immunohistochemistry.
RESULTS: VEGFR-2 expression in both hepatic arteries and veins of PHT rats significantly increased (t = 24.306, 54.776, both P < 0.05). VEGFR-1 expression in both hepatic arteries and portal veins of PHT models also significantly increased (t = 20.669, 33.210, both P < 0.05). VEGFR-2 expression in hepatic veins was markedly higher than that in hepatic arteries in PHT rats (t = 23.424, P < 0.05). There is no difference in VEGFR-1 expression between hepatic arteries and veins in PHT models (t = 1.434, P > 0.05).
CONCLUSION: VEGFR-2 can decrease the pressure of portal veins possibly by promoting the neovascularization of hepatic veins.
- Citation: Xu SS, Zhao JM, Yang SX. Distribution of vascular endothelial growth factor receptor in hepatic arteries and veins of rats with portal hypertension. Shijie Huaren Xiaohua Zazhi 2010; 18(17): 1756-1760
- URL: https://www.wjgnet.com/1009-3079/full/v18/i17/1756.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i17.1756
门脉高压是肝硬化患者最严重的并发症, 严重威胁人类生命[1,2]. 大多数慢性门静脉高压症(portal hypertension, PHT)早期主要发病机制为门静脉系统血流阻力增加, 而肝硬化是最常见的引起门静脉阻力增加的原因之一. 血管生成是门静脉高压症的病理特征[3], PHT伴有的门静脉高压性血管病变(portal hypertension vascular lesion)在PHT的发展中起重要作用. 血管内皮生长因子(vascular endothelial growth factor, VEGF)被认为是最重要的血管生成形成的因子, 也是肝硬化过程中重要的调节因子[4-6]. VEGF通过结合并激活两个酪氨酸激酶受体, 血管内皮生长因子受体1(vascular endothelial growth factor receptor-1, VEGFR-1)(Flt-1)和VEGFR-2(KDR/FLK-1)来调节生理和病理血管生成[7]. VEGFR-1能更准确地调节血管形成和血管渗透性, 而VEGFR-2对内皮细胞增殖最终形成新生血管更为重要. 肝硬化是以缺血为特征, 肝硬化门脉高压时VEGFR的变化目前尚不清楚. 本次研究旨在明确肝硬化门脉高压前后VEGFR-1、2在肝脏血管的分布变化.
SD ♂大鼠30只, 体质量180-220 g, 购自本校实验动物中心.
1.2.1 肝硬化门脉高压动物模型的建立: 动物随机分为肝硬化模型组(n = 20)和正常对照组(n = 10). 采用硫代乙酰胺皮下注射法制作肝硬化模型[9-11]. 经组织病理学检查证实肝脏有假小叶形成和门静脉压力大于1.57 kPa的大鼠共12只纳入本研究.
1.2.2 标本处理: 于注射硫代乙酰胺第12周末处死大鼠, 取大鼠肝脏组织, 以生理盐水洗去血迹后迅速置于冰冷的多聚甲醛磷酸缓冲液内(4%, pH7.2), 在4 ℃冰箱内固定8-12 h, 然后转入20%蔗糖磷酸缓冲液内, 4 ℃冰箱内过夜. 制作石蜡切片, 每个标本连续切片3-5张.
1.2.3 SP免疫组织化学染色检测VEGFR-1、2表达: 石蜡切片脱蜡. PBS冲洗3×5 min. 每张切片滴加3% H2O2 50 μL, 室温孵育20 min, 抑制过氧化物酶. PBS冲洗3×5 min. 5%正常山羊血清封闭, 室温, 30 min, 用滤纸吸去多余血清. 滴加一抗50 μL, 4%孵育24 h, PBS冲洗3×5 min. 滴加链霉菌抗生物素蛋白-过氧化物酶溶液, 37 ℃孵育60 min, PBS冲洗3×5 min. 滴加新鲜配置的DAB 100 μL显色3-10 min, 显微镜下控制显色时间. 自来水流水冲洗, 苏木素复染. 梯度酒精脱水, 二甲苯透明, 中性树胶封片. 光镜下观察染色结果, VEGFR阳性产物为棕色, 与背景同色为阴性.
1.2.4 免疫组织化学染色图片分析: 选取肝硬化前后不同血管VEGFR-1、2染色切片各6张, 计算单位视野下阳性细胞个数.
统计学处理 测量结果以mean±SD表示、组间差异采用双侧t检验, 差异显著性水平设为P<0.05.
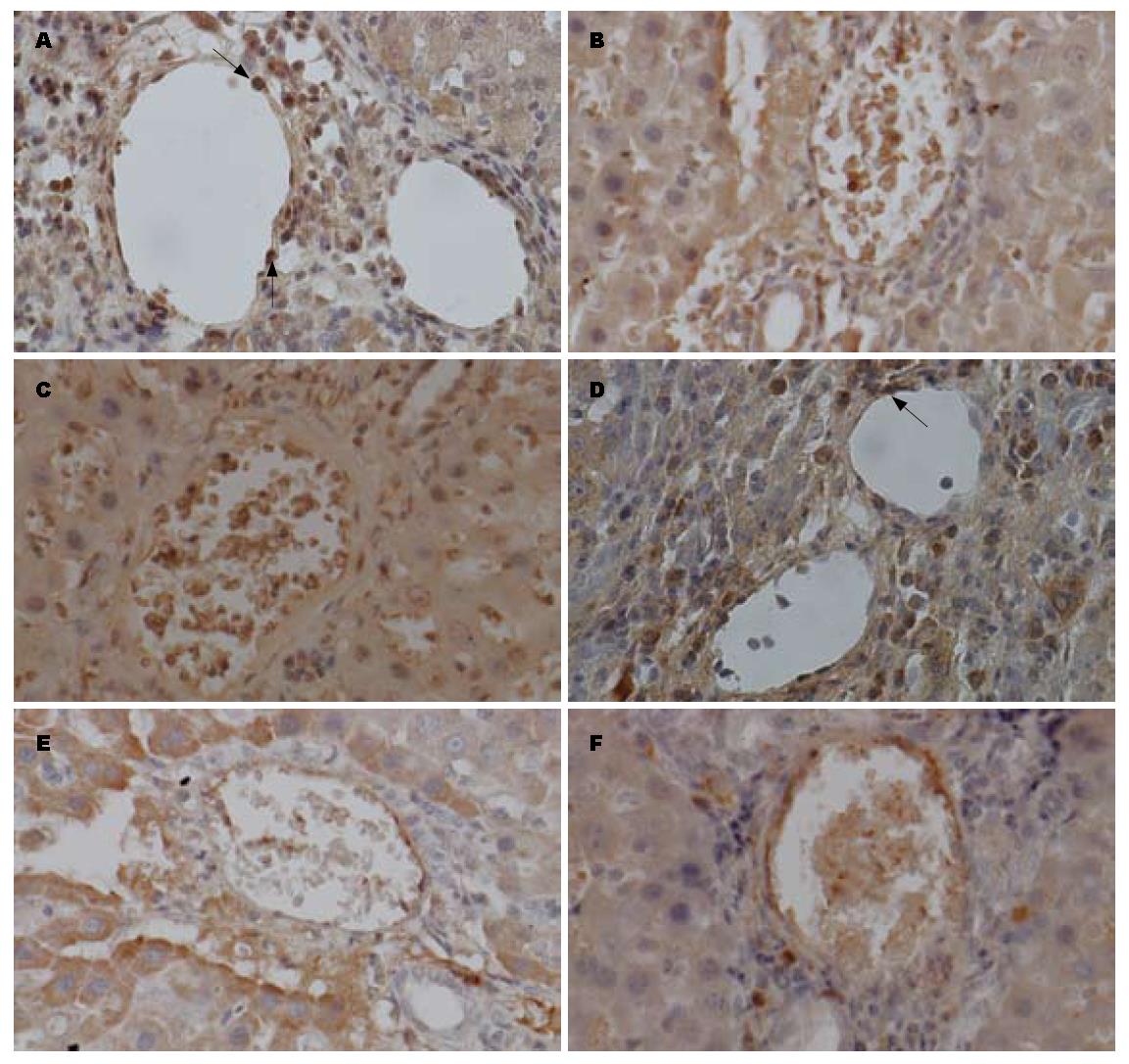
肝硬化门静脉高压组大鼠和正常对照组大鼠肝脏组织切片免疫组织化学染色. VEGFR-1和VEGFR-2免疫组织化学染色阳性产物表现为棕色颗粒状(图中箭头所指), 与背景同色为阴性. 可见VEGFR-2在肝硬化门静脉高压组大鼠的小叶间静脉和小叶间动脉的阳性表达细胞个数明显多于正常对照组(图1A, B, C). VEGFR-1在肝硬化门静脉高压组大鼠的小叶间静脉和小叶间静脉的阳性表达细胞个数明显多于正常对照组, 正常对照组几乎无阳性细胞表达(图1D, E, F). VEGFR-2在肝硬化门脉高压组大鼠的小叶间静脉的阳性表达细胞个数明显多于小叶间动脉(图1A); 而VEGFR-1在门脉高压组大鼠的小叶间动脉和小叶间静脉的阳性表达细胞个数几乎无明显差异(图1D).
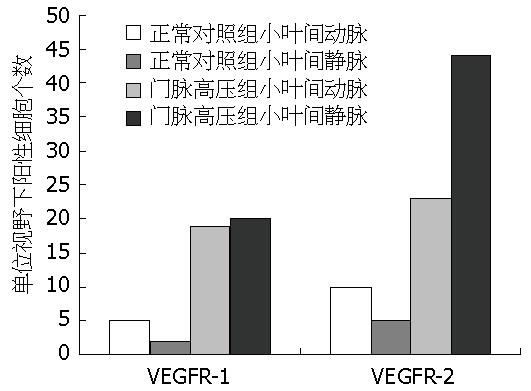
VEGFR-2在肝硬化门静脉高压组大鼠的小叶间动脉中的表达显著高于正常对照组(t = 24.306, P<0.05); VEGFR-2在肝硬化门静脉高压组大鼠的小叶间静脉中的表达显著高于正常对照组(t = 54.776, P<0.05). VEGFR-1在肝硬化门静脉高压组大鼠的小叶间动脉中的表达显著高于正常对照组(t = 20.669, P<0.05); VEGFR-1在肝硬化门静脉高压组大鼠的小叶间静脉中的表达显著高于正常对照组(t = 33.210, P<0.05). VEGFR-2在肝硬化门脉高压组大鼠的小叶间静脉的表达显著高于小叶间动脉(t = 23.424, P<0.05); 而VEGFR-1在门脉高压组大鼠的小叶间动脉和小叶间静脉的表达几乎无明显差异(t = 1.434, P>0.05, 图2).
正常对照组和肝硬化门脉高压组大鼠肝脏小叶间动脉和小叶间静脉均有VEGFR-1、2染色, 但肝硬化门脉高压组较正常对照组染色明显增强. 在肝硬化门脉高压组大鼠肝脏小叶间动脉和小叶间静脉血管壁各层均有VEGFR-2分布, 但以内皮层为主. 而正常对照组VEGFR-2染色稀少, 浅淡. 肝硬化门脉高压组大鼠和正常对照组大鼠的肝脏小叶间动脉和小叶间静脉血管壁VEGFR-1均较局限地分布于血管内皮层, 而平滑肌层则极少着色(表1, 表2).
| 小叶间动脉 | 小叶间静脉 | P值 | |
| 肝硬化组(n = 12) | 19±1.91 | 20±1.48 | >0.05 |
| 正常对照组(n = 10) | 5±1.05 | 2±0.94 | >0.05 |
| P值 | <0.05 | <0.05 |
| 小叶间动脉 | 小叶间静脉 | P值 | |
| 肝硬化组(n = 12) | 23±2.13 | 44±2.26 | <0.05 |
| 正常对照组(n = 10) | 5±1.05 | 2±0.94 | >0.05 |
| P值 | <0.05 | <0.05 |
大多数慢性PHT早期主要发病机制为门静脉系统血流阻力增加[12], 而肝硬化是最常见的引起门静脉阻力增加的原因之一. PHT伴有的门静脉高压性血管病变(portal hypertension vascular lesion)在PHT的发展中起重要作用.
VEGF是血管生成的主要调节因子[13], 结合并激活两个酪氨酸激酶受体, VEGFR-1(Flt-1)和VEGFR-2(KDR/FLK-1). 这些受体调节生理和病理血管生成[9]. VEGFR-1能更准确地调节血管形成和血管渗透性, 而VEGFR-2对内皮细胞增殖最终形成新生血管更为重要.
随着对VEGF研究的不断深入, 很多学者认识到VEGF在肝硬化门静脉高压症的发生、发展中扮演着重要的角色. 已证实肝组织中VEGF及其受体VEGFR-1、2随肝硬化门脉高压严重程度增加而增加[14,15], 而且肝组织中VEGF及其受体的表达和血管数目密切相关[16]. 本研究应用VEGFR-1和VEGFR-2的特异性抗体, 对大鼠肝脏内小叶间静脉和小叶间动脉血管壁的VEGFR的分布特点进行了观察. 结果显示, 肝硬化门脉高压组大鼠小叶间动脉和小叶间静脉血管壁各层均有VEGFR分布, 但主要位于内皮层. 这提示血管内皮细胞是产生VEGFR的主要细胞, 其即可表达VEGFR-1也可表达VEGFR-2. 本研究亦发现肝脏小叶间动脉和小叶间静脉血管壁VEGFR的表达以及对VEGFR的反应性存在差异. 这种动静脉差异可能是由血管内皮和或平滑肌细胞在结构和或功能上的不同导致. 本研究发现VEGFR-2在肝硬化门脉高压组大鼠的肝脏小叶间静脉的表达显著高于小叶间动脉, 而VEGFR-1在肝硬化门脉高压组大鼠的肝脏小叶间动脉和小叶间静脉的表达却无明显差异. VEGFR-2在肝硬化门脉高压组大鼠小叶间静脉的表达比小叶间动脉高可能是由于肝硬化时小叶间静脉缺血较小叶间动脉缺血重, 反射调节VEGFR-2活性升高促进血管生成, 而小叶间动脉相对缺血轻而出现上述结果[17,18]. 而VEGFR-2在肝硬化门脉高压组大鼠肝脏血管的表达显著高于VEGFR-1, 可能由于VEGFR-2对内皮细胞增殖最终形成新生血管更为重要; 而VEGFR-1主要起调节血管形成和血管渗透性的作用[19]. 这提示在肝硬化门脉高压发展过程中主要通过新生的小叶间静脉代偿性地改善局部硬变肝组织所处的缺血缺氧状态, 最大限度地维持肝细胞功能[20], 并且可以代偿性地降低门静脉高压. VEGFR-2在此过程中起主要作用, 而VEGFR-1则更多地参与肝硬化的形成[19,21].
目前临床用于治疗门脉高压的方法主要有外科手术、经颈静脉肝内门体分流术、药物治疗等. (1)外科手术是治疗门脉高压的传统方法, 分为分流术与断流术. 由于分流术减少了肝脏血流灌注量, 加重了肝细胞损伤. 并使肠道吸收的氨绕过肝脏, 不经肝脏解毒, 而经分流通道直接进入体循环, 引起肝性脑病. 因此, 这类手术已很少临床应用. 目前普遍采用贲门周围血管离断术, 此法克服了分流术的上述弊端, 并手术损伤减少, 但仍有较高的手术死亡率和再出血率. 此法只是解决了食管胃底静脉曲张破裂出血的危险, 并不能降低门静脉压力, 反可使门静脉压力进一步升高. 因此, 不能认为外科手术是治疗门脉高压的理想手段; (2)经颈静脉肝内门体分流术是近年来发展起来的一种介入放射学技术. 与外科手术相比经颈静脉肝内门体分流术避免了麻醉和手术风险, 但作为一种非外科门体分流术, 仍存在术后加重肝细胞损伤、引起肝性脑病的缺点, 仍有一定死亡率, 术后支架狭窄或阻塞及经济费用太高等, 致使其应用受到限制[20]; (3)药物治疗主要用于有明显食管静脉曲张的患者以预防破裂出血(如心得安、H2受体拮抗剂)和治疗食管静脉破裂出血(如生长抑素、垂体后叶素). 其主要治疗机制是减少门静脉血流和降低门静脉阻力, 使门静脉压力在药物作用下得到暂时缓解, 并不是从根本上治疗门脉高压, 而且有诸多药物不良反应. 因此近年来许多学者[8,22]将门静脉注射VEGF-2应用于临床治疗[23-26]肝硬化门脉高压, 由于门静脉入肝后分支成小叶间静脉, 肝动脉入肝后分支成小叶间动脉, 故本实验通过观察肝硬化门脉高压前后VEGFR-1、2在小叶间动脉和小叶间静脉的分布变化为此种疗法提供了一定理论基础. 但VEGF及其受体在肝硬化门脉高压病程中所起的确切作用及临床应用的确切疗效仍需大量基础及临床药理实验研究[27-29].
门静脉入肝后分支成小叶间静脉, 肝动脉入肝后分支成小叶间动脉. 肝硬化是以缺血为特征, 肝硬化门脉高压时VEGFR的变化目前尚不清楚.
董蕾, 教授, 西安交通大学第二附属医院消化内科.
叶春华等将门静脉注射VEGF-2应用于临床治疗肝硬化门脉高压取得一定的效果, 但至今对于其理论基础的研究尚未见报道.
本研究应用VEGFR-1和VEGFR-2的特异性抗体, 对大鼠肝脏内小叶间静脉和小叶间动脉血管壁的VEGFR的分布特点进行了观察. 结果显示, 肝硬化门脉高压组大鼠小叶间动脉和小叶间静脉血管壁各层均有VEGFR分布, 但主要位于内皮层.
VEGFR-1能更准确地调节血管形成和血管渗透性, 而VEGFR-2对内皮细胞增殖最终形成新生血管更为重要.
本文有一定临床价值, 而且研究了VEGF在小叶间动静脉的分布, 有一定新颖性.
编辑: 曹丽鸥 电编: 吴鹏朕
| 1. | Mejias M, Garcia-Pras E, Tiani C, Miquel R, Bosch J, Fernandez M. Beneficial effects of sorafenib on splanchnic, intrahepatic, and portocollateral circulations in portal hypertensive and cirrhotic rats. Hepatology. 2009;49:1245-1256. [PubMed] [DOI] |
| 2. | Cárdenas A, Ginès P. Portal hypertension. Curr Opin Gastroenterol. 2009;25:195-201. [PubMed] [DOI] |
| 3. | Dai J, Rabie AB. VEGF: an essential mediator of both angiogenesis and endochondral ossification. J Dent Res. 2007;86:937-950. [PubMed] [DOI] |
| 5. | 顾 驾云, 章 幼奕, 邹 美银. 肝硬化患者VEGF水平和终末期肝病模型评分的临床意义. 南通大学学报(医学版). 2009;29:242-243, 246. |
| 6. | 章 幼奕, 邹 美银, 吴 月平, 施 旦华, 陶 虎, 高 金华. 失代偿性肝硬化患者血清VEGF、TGF-β1、TNF-α检测及临床意义. 南通医学院学报. 2009;29:244-246. |
| 7. | Shibuya M. Differential roles of vascular endothelial growth factor receptor-1 and receptor-2 in angiogenesis. J Biochem Mol Biol. 2006;39:469-478. [PubMed] [DOI] |
| 8. | Xu H, Shi BM, Lu XF, Liang F, Jin X, Wu TH, Xu J. Vascular endothelial growth factor attenuates hepatic sinusoidal capillarization in thioacetamide-induced cirrhotic rats. World J Gastroenterol. 2008;14:2349-2357. [PubMed] [DOI] |
| 12. | Cichoz-Lach H, Celiński K, Słomka M, Kasztelan-Szczerbińska B. Pathophysiology of portal hypertension. J Physiol Pharmacol. 2008;59 Suppl 2:231-238. [PubMed] |
| 13. | Roy H, Bhardwaj S, Ylä-Herttuala S. Biology of vascular endothelial growth factors. FEBS Lett. 2006;580:2879-2887. [PubMed] [DOI] |
| 14. | 郭 艳萍, 杨 广英, 王 建君, 姜 黄, 李 军. 转化生长因子-β1及VEGF在肝纤维化中的表达. 中华实用诊断与治疗杂志. 2008;22:724-725. |
| 16. | Brodsky SV, Mendelev N, Melamed M, Ramaswamy G. Vascular density and VEGF expression in hepatic lesions. J Gastrointestin Liver Dis. 2007;16:373-377. [PubMed] |
| 17. | Paternostro C, David E, Novo E, Parola M. Hypoxia, angiogenesis and liver fibrogenesis in the progression of chronic liver diseases. World J Gastroenterol. 2010;16:281-288. [PubMed] [DOI] |
| 18. | Valfrè di Bonzo L, Novo E, Cannito S, Busletta C, Paternostro C, Povero D, Parola M. Angiogenesis and liver fibrogenesis. Histol Histopathol. 2009;24:1323-1341. [PubMed] |
| 19. | Wynn TA. Cellular and molecular mechanisms of fibrosis. J Pathol. 2008;214:199-210. [PubMed] [DOI] |
| 20. | Corpechot C, Barbu V, Wendum D, Kinnman N, Rey C, Poupon R, Housset C, Rosmorduc O. Hypoxia-induced VEGF and collagen I expressions are associated with angiogenesis and fibrogenesis in experimental cirrhosis. Hepatology. 2002;35:1010-1021. [PubMed] [DOI] |
| 21. | Jaroszewicz J, Januszkiewicz M, Flisiak R, Rogalska M, Kalinowska A, Wierzbicka I. Circulating vascular endothelial growth factor and its soluble receptors in patients with liver cirrhosis: possible association with hepatic function impairment. Cytokine. 2008;44:14-17. [PubMed] [DOI] |
| 23. | Perry BN, Arbiser JL. The duality of angiogenesis: implications for therapy of human disease. J Invest Dermatol. 2006;126:2160-2166. [PubMed] [DOI] |
| 24. | Poordad FF, Sigal SH, Brown RS. Pathophysiologic basis for the medical management of portal hypertension. Expert Opin Pharmacother. 2009;10:453-467. [PubMed] [DOI] |
| 25. | 马 秀现, 李 晶义. 干细胞移植联合血管内皮生长因子对门静脉高压症大鼠腹膜后交通支形成的影响. 中国组织工程研究与临床康复. 2008;12:7451-7454. |
| 26. | Ueno T, Nakamura T, Torimura T, Sata M. Angiogenic cell therapy for hepatic fibrosis. Med Mol Morphol. 2006;39:16-21. [PubMed] [DOI] |