修回日期: 2010-05-08
接受日期: 2010-05-18
在线出版日期: 2010-06-18
目的: 观察内毒素血症及内毒素耐受模型小鼠对LPS刺激的反应性, 以及肝组织中SOCS-1表达的变化, 试图从机体水平探讨SOCS-1与内毒素耐受状态之间的关系.
方法: 通过脂多糖(LPS)预处理建立内毒素血症及内毒素耐受动物模型, 并与对照组进行比较. 分时点用酶联免疫吸附试验(ELISA)检测细胞培养液中TNF-α水平, 逆转录聚合酶联反应(RT-PCR)检测肝组织中TNF-α mRNA的表达水平以及肝组织中SOCS-1 mRNA的表达, 并观察肝组织病理改变及超微结构改变, 免疫组织化学检测SOCS-1在肝脏的表达.
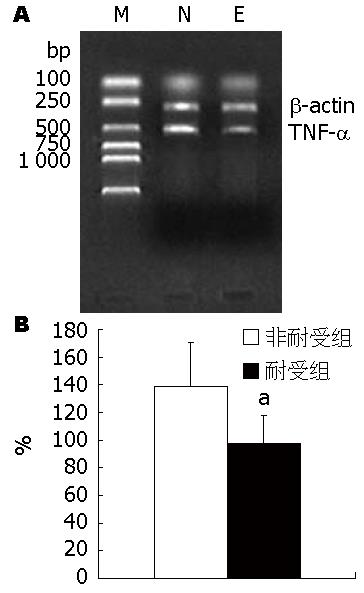
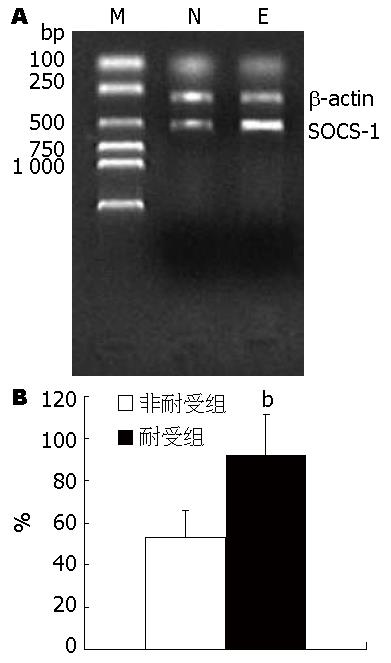
结果: 在LPS刺激后, LPS组血清TNF-α水平、TNF-α mRNA、SOCS-1 mRNA均在1 h开始升高, 至3 h时达到峰值, 随后又逐渐下降正常水平; PBS组血清TNF-α水平及TNF-α mRNA表达几乎没有明显变化, 且无SOCS-1 mRNA表达, 与LPS组比较有统计学意义(P<0.01); 但是耐受组(ETT)的3 h血清TNF-α水平较非耐受组(NETT)低(693.38 ng/L±95.2 ng/L vs 1 110.24 ng/L±164.33 ng/L, P<0.01); 3 h肝组织TNF-α mRNA表达峰值较NETT组低(97.96±19.67 vs 139.14±31.17, P<0.05); 而肝组织SOCS-1 mRNA表达峰值较NETT组高(91.58±12.94 vs 52.82±6.96, P<0.01); 肝组织可见脂肪变性、坏死等病理改变, 超微结构表现为Kupffer细胞激活, 吞噬功能增强; 免疫组织化学可见肝组织中SOCS-1的表达.
结论: 内毒素耐受状态下, 肝组织中的SOCS-1 mRNA表达却明显增强, 肝组织中的SOCS-1 mRNA表达、Kupffer细胞的激活以及机体的内毒素耐受状态三者间可能有着紧密的联系.
引文著录: 陈先锋, 李旭宏, 游海波, 刘海忠, 刘作金, 龚建平. SOCS-1在内毒素血症及耐受小鼠肝组织中的表达变化及意义. 世界华人消化杂志 2010; 18(17): 1747-1755
Revised: May 8, 2010
Accepted: May 18, 2010
Published online: June 18, 2010
AIM: To investigate SOCS-1 (suppressor of cytokine signaling-1) expression changes in the liver of endotoxemic mice and endotoxin-tolerant mice and to explore the relationship between SOCS-1 expression and endotoxin tolerance.
METHODS: The mouse models of endotoxemia and endotoxin tolerance were established by lipopolysaccharide (LPS) pretreatment. At different time points after LPS pretreatment, the level of serum TNF-α was detected by enzyme-linked immunosorbent assay (ELISA), the expression levels of TNF-α and SOCS-1 mRNAs in the liver were detected by reverse transcription-polymerase chain reaction (RT-PCR), the pathological and ultrastructural changes in liver tissue were observed, and SOCS-1 protein expression in liver tissue was detected by immunohistochemistry.
RESULTS: After LPS stimulation, the levels of serum TNF-α and hepatic TNF-α and SOCS-1 mRNAs began to increase at 1 h, peaked at 3 h, and then decreased gradually to the normal level. In contrast, serum TNF-α and hepatic TNF-α mRNA levels showed no significant changes in mice treated with PBS. No SOCS-1 mRNA expression was detected in control mice (P < 0.01). At 3 h, serum TNF-α and hepatic TNF-α mRNA levels were significantly lower in endotoxin-tolerant mice than in endotoxin-intolerant mice (693.38 ng/L ± 95.2 ng/L vs 1110.24 ng/L ± 164.33 ng/L, P < 0.01; 97.96 ± 19.67 vs 139.14 ± 31.17, P < 0.05), while hepatic SOCS-1 mRNA level was significantly higher in endotoxin-tolerant mice than in endotoxin-intolerant mice (91.58 ± 12.94 vs 52.82 ± 6.96, P < 0.01). Pathological and histological changes in the liver of endotoxemic mice included fatty degeneration and necrosis, while the major ultrastructural change was presence of activated Kupffer cells whose phagocytic function was enhanced. Hepatic SOCS-1 protein expression could be detected by immunohistochemistry.
CONCLUSION: SOCS-1 mRNA expression in liver tissue is enhanced markedly in endotoxin-tolerant mice. Close associations are noted among hepatic SOCS-1 mRNA expression, Kupffer cell activation and endotoxin tolerance.
- Citation: Chen XF, Li XH, You HB, Liu HZ, Liu ZJ, Gong JP. Significance of SOCS-1 expression changes in the liver of endotoxemic mice and endotoxin-tolerant mice. Shijie Huaren Xiaohua Zazhi 2010; 18(17): 1747-1755
- URL: https://www.wjgnet.com/1009-3079/full/v18/i17/1747.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i17.1747
临床上常见的严重创伤、烧伤、感染、休克、外科大手术等常导致肠道内G-细菌过度生长繁殖, 产生大量的内毒素(又名脂多糖, lipopolysaccaride, LPS), 加上肠壁通透性增高, 导致经门静脉吸收的内毒素增多, 从而造成不同程度的肠源性内毒素血症(intestinal endotoxemia, IETM)[1,2]. 肠源性感染导致内毒素移位首先攻击肝脏, 而肝脏又是体内内毒素的主要清除器官[3]. 因此, 肝脏对内毒素的反应直接关系到整个机体对内毒素的反应, 而Kupffer细胞(Kupffer cells, KCs)是肝脏主要起清除作用的细胞, 在机体防御特别是防御来自肠道内的细菌、病毒和毒素发挥着重要的作用[4,5]. 然而, 机体对内毒素的反应轻重不一, 表明机体存在一种耐受机制, 已知内毒素耐受(endotoxin tolerance, ET)是细胞或机体经过低剂量LPS刺激后, 对更大剂量LPS的再次刺激呈低反应性或无反应的一种状态[6-8]. 研究表明, LPS刺激巨噬细胞产生炎性介质肿瘤坏死因子-α(tumor necrosis factor α, TNF-α)、白介素6(interleukin 6, IL-6)等[9,10], 同时, 在这些炎性介质的诱导下, 促使巨噬细胞又产生一种名为细胞因子信号传导抑制因子(suppressor of cytokine signaling, SOCS)的细胞因子[11-13], SOCS家族现有8个成员, 其中SOCS-1可通过与JAKs结合, 从而抑制下游的信号传导[14]. 因此推测SOCS-1可能与内毒素耐受的产生有关. 鉴于SOCS-1在单核-巨噬细胞系统表达的特异性, 肝脏中的KCs又是体内最大的巨噬细胞群[15,16], 因此, 本实验通过诱导昆明小鼠产生内毒素耐受, 观察LPS刺激后小鼠肝组织中SOCS-1基因的表达情况, 从而从动物水平阐明SOCS-1与内毒素耐受的关系, 为下一步细胞实验提供实验基础.
健康清洁级成年昆明小鼠, 体质量20-25 g, 购自重庆医科大学实验动物中心. 所有动物均达到了由重庆医科大学实验动物管理委员会制定的实验动物管理要求. LPS(E.coli O111:B4)购自美国Sigma公司. SOCS-1山羊多克隆抗体购自美国Santa Cruz公司. SA-1023即用型免疫组织化学染色试剂盒购自武汉博士德公司. 小鼠TNF-α ELISA试剂盒购自武汉博士德. 小量组织/细胞总RNA快速抽提纯化试剂盒购自上海华舜公司. 两步法RT-PCR试剂盒购自大连TaKaRa公司. PCR引物由上海鼎安生物科技有限公司设计并合成.
1.2.1 分组及造模: (1)内毒素血症模型: 将昆明小鼠66只随机分为2组(n = 30): 内毒素血症组(LPS组), 以5 mg/kg的LPS腹腔注射建立内毒素血症模型; PBS组, 以等体积的0.01 mol/L PBS液注射. 各组动物分别于注射后1 h、3 h、6 h、12 h、24 h活杀取材, 每组每时点选动物6只, 另外6只小鼠作为0时点. (2)内毒素耐受模型: 将昆明小鼠72只随机分为2组(n = 36): 非耐受组(NETT组), 先腹腔注射等体积0.01 mol/L PBS液, 24 h后注射5 mg/kg体质量的LPS; LPS诱导耐受组(ETT组), 先腹腔注射0.5 mg/kg的LPS, 24 h后注射5 mg/kg体质量的LPS. 各组动物分别于注射后0、1、3、6、12、24 h活杀取材, 每组每时点选动物6只.
1.2.2 血清TNF-α的含量测定: 小鼠采用眼球摘除法取血, 于4 ℃下250 g离心15 min, 取血清于-70 ℃保存备用. 采用博士德公司的夹心法ELISA试剂盒检测, 操作步骤祥见试剂盒说明书.
1.2.3 肝组织中TNF-α及SOCS-1的mRNA表达: 取30 mg肝组织, 采用上海华舜生物工程有限公司的小量组织/细胞总RNA快速抽提纯化试剂盒, 室温离心, 离心速度均为8 000-10 000 g. RNA样品的纯度用分光光度计根据在260 nm及280 nm吸光度的比值(A260/A280)来判断, 确保比值为1.8-2.0. 电泳验证部分总RNA完整性并照相. RT-PCR反应: PCR引物由上海鼎安生物科技有限公司设计并合成, 如下所示: SOCS-1, sense 5'-GCC GAC AAT GCG ATC TCC-3', antisense 5'-GAT GCG CTG GCG ACA CA-3', 产物大小528 bp; TNF-α, sense 5'-TCT ACT GAA CTT CGG GGT GA-3', antisense 5'-AGT AGA CCT GCC CGG ACT C-3'产物大小542 bp, β-actin, sense 5'-CAT TGT GAT GGA CTC CGG AG-3', antisense 5'-ATA GTG ATG ACC TGG CCG TC -3', 产物大小300 bp, 逆转录反应条件: 30 ℃ 10 min, 42 ℃ 30 min, 99 ℃ 5 min, 5 ℃ 5 min; PCR反应条件: 94 ℃ 2 min, 94 ℃ 30 s, 55 ℃ 45 s, 72 ℃ 1 min, 40个循环, 72 ℃延伸5 min, 4 ℃保存. 反应结束后, 制备1.5%琼脂糖凝胶并取样80 V电泳30 min. 在Gel Doc 2000凝胶成像系统下成像并以Bio-Image Analysis System进行半定量分析, 结果以相对吸光度值(relative absorption ratio, RA)×面积(mm2)表示. mRNA相对含量 = (目的基因条带RA×mm2)/(β-actin条带RA×mm2).
1.2.4 形态学的变化的观察: 光镜标本用100 g/L甲醛固定, 石蜡包埋, 4 μm厚连续切片并进行苏木精-伊红(HE)染色, 作组织病理学观察; 电镜标本用3%戊二醛固定, 常规电镜制样, 于透射电镜下观察肝脏细胞超微结构改变.
1.2.5 免疫组织化学检测肝组织中SOCS-1基因的表达: 将保存于40 g/L的多聚甲醛中的肝组织取出, 石蜡包埋, 切片(厚约4 μm); 载玻片用多聚赖氨酸(Poly-Lysine)防脱片处理, 烘干, 切片常规脱蜡至水; 参照武汉博士德公司SA-1023即用型免疫组织化学染色试剂盒说明书操作, 苏木素轻度复染, 脱水, 透明, 封片, 拍照.
统计学处理 实验所得数据以mean±SD表示, 采用SPSS13.0统计软件包进行统计分析, 各组间均数的比较采用方差分析, 两组间均数的比较采用t检验, P<0.05表示差异有显著性; P<0.01表示差异性非常显著.
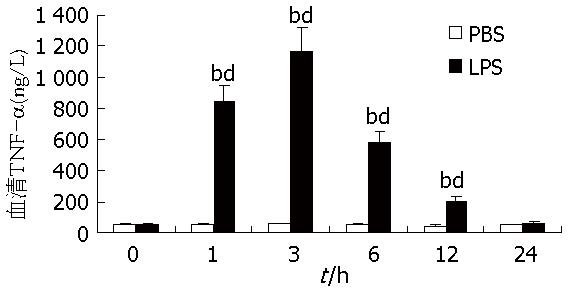
观察经LPS(5 mg/kg)和PBS(0.01 mol/L)处理后预定时相小鼠血清TNF-α含量水平的变化, PBS组在各时相的TNF-α值几乎没有明显变化, 各时点比较, 没有显著性统计学意义(P>0.05); LPS组可见其TNF-α值有一个起伏波动的变化, 在LPS刺激后1 h开始升高, 至3 h时达到峰值1 168.84 ng/L±154.49 ng/L, 随后又逐渐下降, 至24 h大概降至正常水平, 其1、3、6、12 h之值与0 h比较, 统计学意义显著(P<0.01), 而1、3、6、12 h之值分别与PBS组对应的1、3、6、12 h之值作比较, 各组统计学意义显著(P<0.01, 图1).
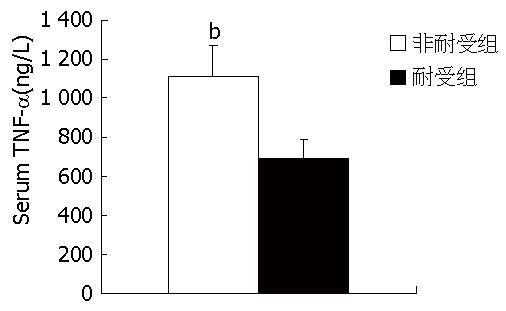
预先以PBS(0.01 mol/L)刺激24 h的非耐受组小鼠, 当再次给予LPS(5 mg/kg)刺激, 其3 h的血清TNF-α平均值为1 110.24 ng/L±164.33 ng/L; 而预先以LPS(0.5 mg/kg)诱导耐受的耐受组小鼠, 在诱导24 h后再次给予LPS(5 mg/kg)刺激, 其3 h的血清TNF-α平均值为693.38 ng/L±95.2 ng/L, 可见, 耐受组的血清TNF-α值明显较非耐受组低, 两者比较统计学意义非常显著(P<0.01, 图2).
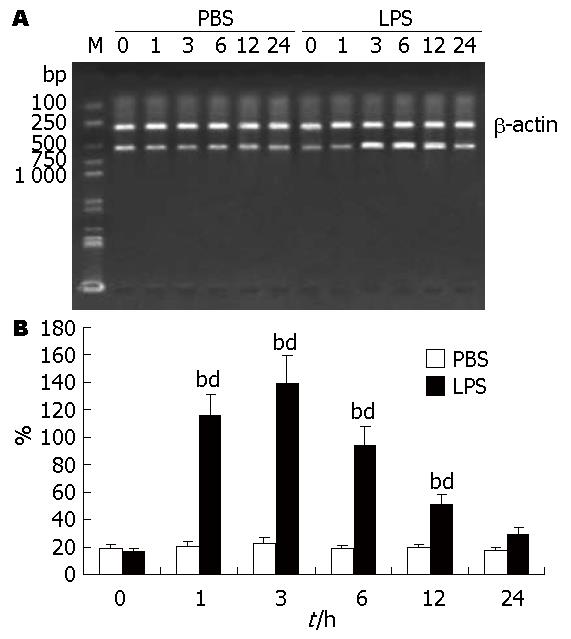
TNF-α mRNA的PCR产物大小为542 bp, 半定量分析显示: PBS组TNF-α mRNA的表达在各预定时相没有显著性变化, 与其0 h比较没有显著性意义(P>0.05); 而LPS组TNF-α mRNA的表达在1 h时表达开始增强, 3 h达到高峰, 随后又逐渐下降, 至24 h基本降至正常水平, 其1、3、6、12 h之值较0 h之值统计学意义显著(P<0.01), 与PBS组对应的1、3、6、12 h之值比较统计学意义显著(P<0.01, 图4); 非耐受组和耐受组的TNF-α mRNA表达在LPS(5 mg/kg)再刺激后均再次升高, 但耐受组在3 h的峰值(97.96±19.67)较非耐受组组(139.14±31.17)明显低, 两者比较统计学意义显著(P<0.05, 图5).
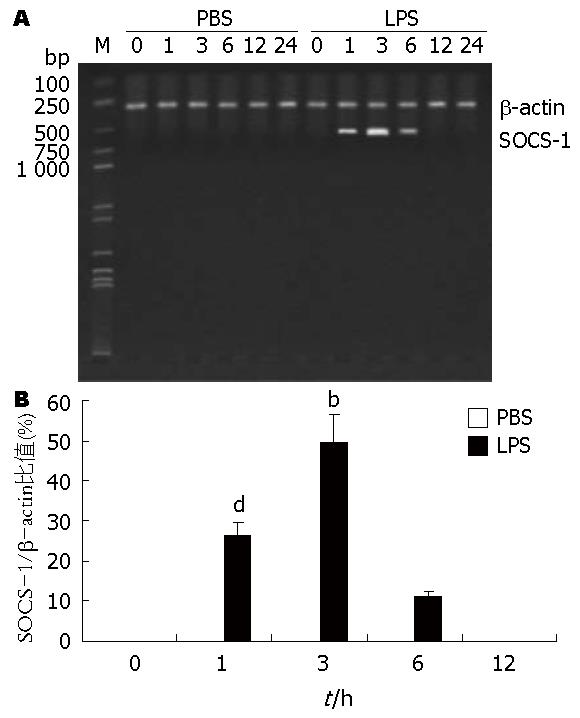
PBS组SOCS-1 mRNA在各时相点均没有表达, 而LPS组在LPS(5 mg/kg)刺激后1 h SOCS-1 mRNA开始表达, 3 h其表达达到高峰, 随后逐渐降低, 至12 h后则不再表达, 其3 h之值与1 h和6 h之值比较统计学意义非常显著(P<0.01), 其1 h之值与6 h之值比较统计学意义非常显著(P<0.01, 图6). 非耐受组小鼠当再次给予LPS(5 mg/kg)注射后, 半定量分析其3 h后的SOCS-1 mRNA表达的平均值为52.82±6.96, 而耐受组小鼠当再次给予LPS(5 mg/kg)刺激后, 半定量分析其3 h后的SOCS-1 mRNA表达的平均值为91.58±12.94. 可见, 耐受组的SOCS-1 mRNA值明显较非耐受组高, 两者比较统计学意义非常显著(P<0.01, 图7).
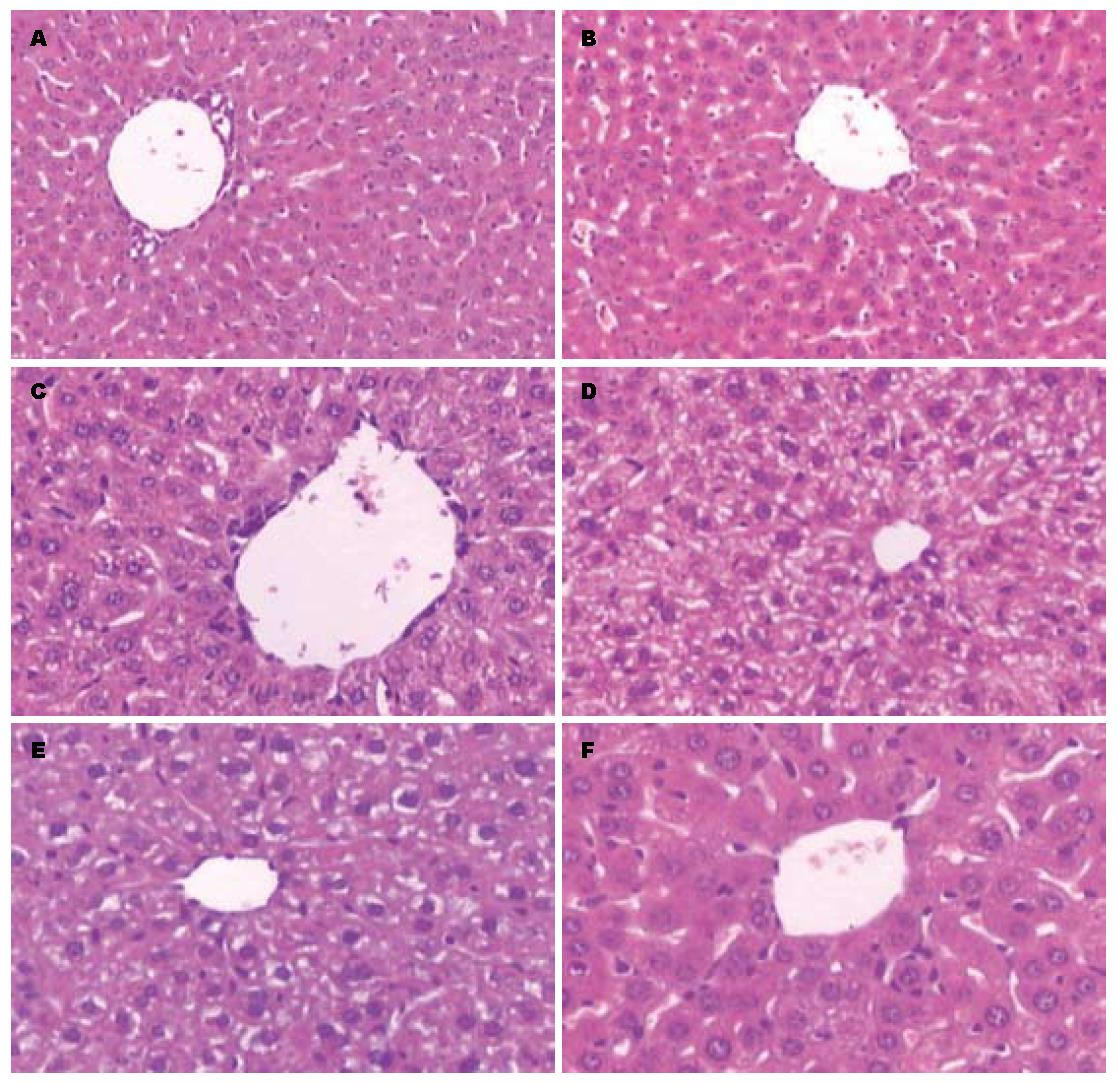
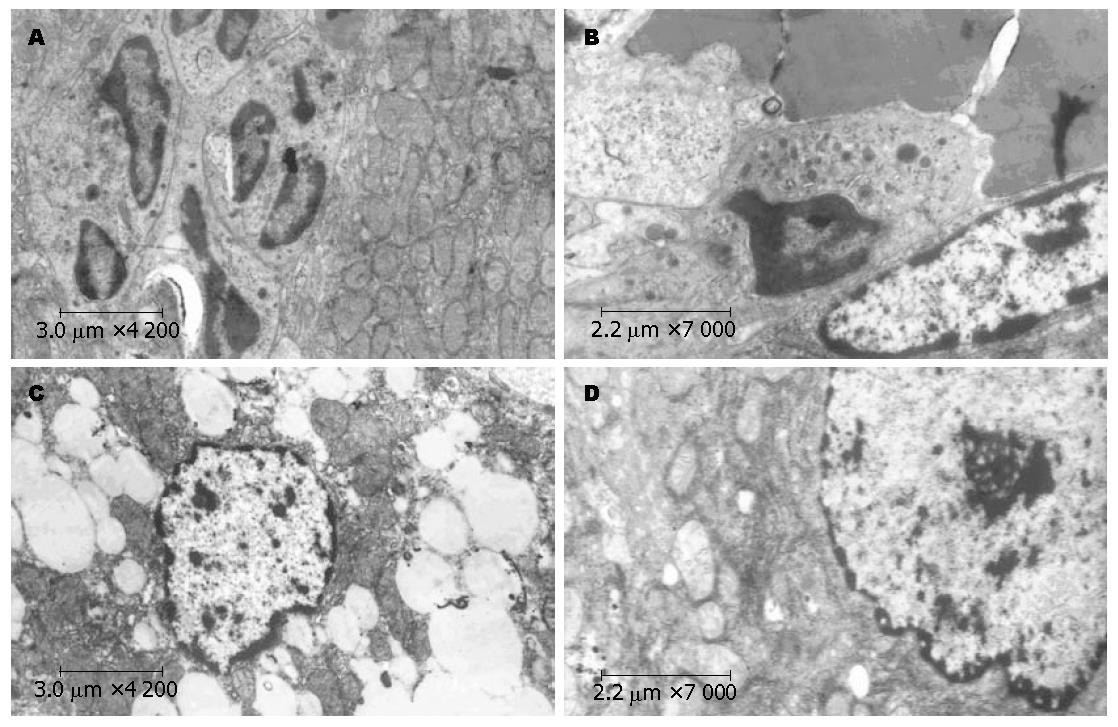
PBS组肝组织形态、结构较正常肝组织没有明显变化; LPS组表现为: 肝细胞索结构紊乱, 肝窦扩张, 充血, 肝细胞空泡变性明显, 呈网状, 并有局灶性坏死, 汇管区有炎性细胞浸润; 耐受组与非耐受组比较, 同一时点的肝脏的形态以及肝细胞的变性、坏死均较非耐受组轻(图8).
LPS刺激3 h后的肝组织可见炎性细胞浸润明显, 以嗜中性粒细胞为主, 线粒体轻微肿胀, 并可见少量脂滴; LPS刺激12 h的肝组织可见肝窦内的KCs, 其吞噬功能活跃, 胞质内可见较多的吞噬溶酶体, 并且内皮细胞肿胀, 体积增大, 肝细胞脂肪变, 线粒体肿胀; 非耐受组24 h的肝组织可见肝细胞脂肪变, 有较多大小不一的脂滴, 肝细胞核染色质边集, 线粒体减少; 而耐受组肝组织24 h的超微结构变化较非耐受组损害较轻, 表现为肝细胞轻微脂肪变, 线粒体微肿胀(图9).
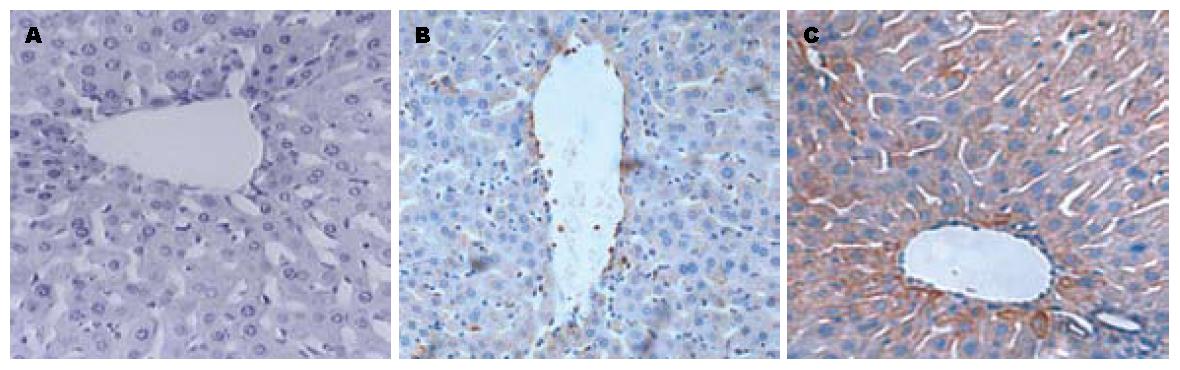
免疫组织化学染色显示, PBS组肝组织SOCS-1表达呈阴性(-); LPS组1 h可见在肝组织的中央静脉区周围有较淡的黄色染色区域, SOCS-1表达呈阳性(+); LPS组3 h可见肝组织的中央静脉区周围有明显黄染区域, SOCS-1表达呈强阳性(++)(图10).
肝脏作为机体内一个功能颇为复杂的器官, 能不断地解毒、清除门静脉血流中源于胃肠道吸收的外源性物质或毒素, 因而在维持机体内环境的稳定处于关键的地位[17,18]. 随着现代医学的迅猛发展, 人们越来越清楚认识到源于胃肠道的内毒素血症(endotoxemia, ETM)及其所诱发的多器官功能不全综合征(multiple organ dysfunction syndrome, MODS)是临床常见的创伤和感染患者死亡的主要原因, 其中G-细菌细胞壁的LPS成分在其发生发展中起着举足轻重的作用[19,20]. 其主要致病机制是由于机体严重的创伤、感染等导致肠道内的G-杆菌过度增殖, 产生大量的内毒素, 加上此时肠壁通透性增高, 造成内毒素移位, 从而经门静脉入血增多[21,22]; 抑或肝内KCs吞噬功能下降, 过量的内毒素超过了肝脏的清除能力, 从而进入血循环引发ETM或脓毒症[23,24].
脓毒症一直是临床治疗中的一个难点, 其中一个重要原因就是临床抗生素的应用, 已知抗生素杀灭细菌的同时也促使大量LPS从菌体中释放, 这些释放的LPS将在体内继续发挥其生物毒性作用[25,26]. 因此对内毒素的研究是自然成为科研的热点, 研究表明, 机体对G-菌感染后的临床表现轻重不一, 表明机体对LPS存在一定的耐受差异性[27-29]. 内毒素耐受是细胞或机体经低剂量LPS刺激后, 对更大剂量LPS的再次刺激呈低反应性或无反应的一种状态[30], 他是生物在长期进化过程中形成的一种保守的负性调节机制, 是一种适应性应答, 也是机体防御机制的重要组成部分[31,32]. LPS耐受的机制比较复杂, 目前还不完全清楚. 目前认为, LPS结合蛋白(lipopolysaccharide binding protein, LBP)、CD14、Toll样受体-4(toll-like receptor, TLR4)、以及清道夫受体(scavenger receptor, SR)对内毒素在体内的生物学效应上发挥着重要的作用[33-35]. 另外, LPS耐受机制可能与一些细胞因子的表达, 其中不乏可通过下调LPS信号传导受体TLR4/MD2的表达, 以及降低NF-κB的活性等有关, 但是, 其潜在的机制仍未明了[36]. 最近在研究JAK/STAT信号传导途径时, 发现在经LPS或CpG-DNA刺激的巨噬细胞能够产生一种名为细胞信号传导因子的抑制因子SOCS-1的细胞因子, 又名STAT诱导的STAT抑制因子-1(STAT-induced STAT inhibitor-1, SSI-1)或JAK结合蛋白-1(JAK binding protein-1, JAK-1), 他作为JAK/STAT信号传导途径的特异性内源性抑制物, 能够抑制一些炎性因子如IFN-γ、IL-4、IL-6等刺激所产生的JAK-STAT介导的信号级联反应的过度激活[11-13]. SOCS家族现已有8个成员, 其中SOCS-1的表达较早, 可能与内毒素耐受的早期机制有关[14]. 因此, SOCS-1可能在内毒素耐受的形成中发挥着重要的作用. 本部分实验通过建立ETM及内毒素耐受小鼠模型, 观察模型动物对更LPS刺激的反应性, 以及肝组织中SOCS-1表达的变化, 试图从机体水平探讨SOCS-1与内毒素耐受状态之间的关系, 得到的主要结果和结论如下: (1)综合观察分析ETM和内毒素耐受小鼠的实验结果, 发现经低剂量LPS预处理的小鼠对更大剂量LPS的刺激呈低反应性, 表现为肝组织中的TNF-α mRNA表达减少及其血清TNF-α水平降低、以及肝脏组织病理学和细胞超微结构学上的损害减轻; 因而从前炎性细胞因子的表达和释放以及肝脏的损害等多方面证实本实验中的内毒素耐受动物模型建立成功. (2)实验动物在表现出对内毒素耐受的同时, 其肝组织中SOCS-1基因的表达明显增强, 提示SOCS-1基因的表达与内毒素耐受的形成有密切关系.
鉴于KCs是肝脏乃至机体重要的免疫细胞, 其在LPS介导的肝损害中发挥着重要的作用, 结合本实验内毒素刺激状态下KCs激活, 以及内毒素耐受状态下前炎性细胞因子释放减少以及肝脏病理损害较轻等表现, 提示SOCS-1表达、KCs活性与内毒素耐受三者间可能存在紧密联系, 前两者的变化可能与内毒素耐受的形成有关. 因此, 本实验将为以KCs作为研究对象, 从细胞水平研究SOCS-1表达与内毒素耐受之间的关系提供了实验依据.
内毒素又名脂多糖, 是G-菌的主要致病成分, 临床上常见的严重创伤、烧伤、感染、休克、外科大手术等常导致肠道内G-细菌过度生长繁殖, 从而产生大量的内毒素, 进而造成多器官功能损害; 而内毒素耐受是生物在长期进化过程中形成的一种负反馈调节机制, 可以避免机体产生对内毒素持续过度的反应, 其调节机制极其复杂.
王德盛, 副主任医师, 中国人民解放军第四军医大学西京医院肝胆外科.
SOCS-1主要在单核巨噬细胞系统中表达, Kupffer细胞是机体中最大的巨噬细胞群, 目前就SOCS-1如何参与内毒素耐受的形成和调节相关文献报道较少.
研究表明, 机体对G-菌感染后的临床表现轻重不一, 表明机体对LPS存在一定的耐受差异性.
本实验通过诱导昆明小鼠产生内毒素耐受, 观察LPS刺激后小鼠肝组织中SOCS-1基因的表达情况, 从而从动物水平阐明SOCS-1与内毒素耐受的关系, 为下一步细胞实验提供实验基础.
本研究表明内毒素状态下, 肝组织中的SOCS-1 mRNA表达明显增强; 肝组织中的SOCS-1 mRNA表达、Kupffer细胞的激活以及机体的内毒素耐受状态三者间可能有着紧密的联系, 为内毒素血症的临床研究提供了潜在的应用研究基础.
本文设计较好, 创新性强, 统计合理, 可信度较高, 学术价值较好.
编辑: 李军亮 电编: 吴鹏朕
| 1. | Han DW. Intestinal endotoxemia as a pathogenetic mechanism in liver failure. World J Gastroenterol. 2002;8:961-965. [PubMed] [DOI] |
| 2. | Sukhotnik I, Agam M, Shamir R, Shehadeh N, Lurie M, Coran AG, Shiloni E, Mogilner J. Oral glutamine prevents gut mucosal injury and improves mucosal recovery following lipopolysaccharide endotoxemia in a rat. J Surg Res. 2007;143:379-384. [PubMed] [DOI] |
| 3. | Kono H, Fujii H, Asakawa M, Yamamoto M, Matsuda M, Maki A, Matsumoto Y. Protective effects of medium-chain triglycerides on the liver and gut in rats administered endotoxin. Ann Surg. 2003;237:246-255. [PubMed] [DOI] |
| 4. | Schlegel L, Coudray-Lucas C, Barbut F, Le Boucher J, Jardel A, Zarrabian S, Cynober L. Bacterial dissemination and metabolic changes in rats induced by endotoxemia following intestinal E. coli overgrowth are reduced by ornithine alpha-ketoglutarate administration. J Nutr. 2000;130:2897-2902. [PubMed] |
| 5. | Ito Y, Lukita-Atmadja W, Machen NW, Baker GL, McCuskey RS. High doses of intravenous immunoglobulin G enhance Kupffer cell phagocytic function during the late phase of sepsis and endotoxemia in rats. Shock. 2000;13:485-491. [PubMed] [DOI] |
| 6. | Onzuka T, Tomita Y, Shimizu I, Okano S, Yamada H, Yoshikai Y, Tominaga R. Effects of lipopolysaccharide on the induction of mixed chimerism in cyclophosphamide-induced tolerance. Scand J Immunol. 2009;70:423-430. [PubMed] [DOI] |
| 7. | Biswas SK, Lopez-Collazo E. Endotoxin tolerance: new mechanisms, molecules and clinical significance. Trends Immunol. 2009;30:475-487. [PubMed] [DOI] |
| 8. | Zacharioudaki V, Androulidaki A, Arranz A, Vrentzos G, Margioris AN, Tsatsanis C. Adiponectin promotes endotoxin tolerance in macrophages by inducing IRAK-M expression. J Immunol. 2009;182:6444-6451. [PubMed] [DOI] |
| 9. | Lipopolysaccharide (LPS) of Porphyromonas gingivalis induces IL-1beta, TNF-alpha and IL-6 production by THP-1 cells in a way different from that of Escherichia coli LPS. Innate Immun. 2008;14:99-107. [PubMed] [DOI] |
| 10. | Abrahám S, Szabó A, Kaszaki J, Varga R, Eder K, Duda E, Lázár G, Tiszlavicz L, Boros M, Lázár G. Kupffer cell blockade improves the endotoxin-induced microcirculatory inflammatory response in obstructive jaundice. Shock. 2008;30:69-74. [PubMed] |
| 11. | Starr R, Willson TA, Viney EM, Murray LJ, Rayner JR, Jenkins BJ, Gonda TJ, Alexander WS, Metcalf D, Nicola NA. A family of cytokine-inducible inhibitors of signalling. Nature. 1997;387:917-921. [PubMed] [DOI] |
| 12. | Endo TA, Masuhara M, Yokouchi M, Suzuki R, Sakamoto H, Mitsui K, Matsumoto A, Tanimura S, Ohtsubo M, Misawa H. A new protein containing an SH2 domain that inhibits JAK kinases. Nature. 1997;387:921-924. [PubMed] [DOI] |
| 13. | Naka T, Narazaki M, Hirata M, Matsumoto T, Minamoto S, Aono A, Nishimoto N, Kajita T, Taga T, Yoshizaki K. Structure and function of a new STAT-induced STAT inhibitor. Nature. 1997;387:924-929. [PubMed] [DOI] |
| 14. | Dalpke A, Heeg K, Bartz H, Baetz A. Regulation of innate immunity by suppressor of cytokine signaling (SOCS) proteins. Immunobiology. 2008;213:225-235. [PubMed] [DOI] |
| 15. | Liu ZJ, Liu XL, Zhao J, Shi YJ, Yan LN, Chen XF, Li XH, You HB, Xu FL, Gong JP. The effects of SOCS-1 on liver endotoxin tolerance development induced by a low dose of lipopolysaccharide are related to dampen NF-kappaB-mediated pathway. Dig Liver Dis. 2008;40:568-577. [PubMed] [DOI] |
| 16. | Sakuda S, Tamura S, Yamada A, Miyagawa Ji, Yamamoto K, Kiso S, Ito N, Imanaka K, Wada A, Naka T, Kishimoto T, Kawata S, Matsuzawa Y. Activation of signal transducer and activator transcription 3 and expression of suppressor of cytokine signal 1 during liver regeneration in rats. J Hepatol. 2002;36:378-384. [PubMed] [DOI] |
| 17. | Döll S, Schrickx JA, Dänicke S, Fink-Gremmels J. Interactions of deoxynivalenol and lipopolysaccharides on cytokine excretion and mRNA expression in porcine hepatocytes and Kupffer cell enriched hepatocyte cultures. Toxicol Lett. 2009;190:96-105. [PubMed] [DOI] |
| 18. | Huang H, Park PH, McMullen MR, Nagy LE. Mechanisms for the anti-inflammatory effects of adiponectin in macrophages. J Gastroenterol Hepatol. 2008;23 Suppl 1:S50-S53. [PubMed] [DOI] |
| 19. | Marzocco S, Di Paola R, Ribecco MT, Sorrentino R, Domenico B, Genesio M, Pinto A, Autore G, Cuzzocrea S. Effect of methylguanidine in a model of septic shock induced by LPS. Free Radic Res. 2004;38:1143-1153. [PubMed] [DOI] |
| 20. | Yamamoto M, Akira S. Lipid A receptor TLR4-mediated signaling pathways. Adv Exp Med Biol. 2010;667:59-68. [PubMed] [DOI] |
| 21. | Wong KF, Luk JM. Endotoxin-neutralizing peptides as gram-negative sepsis therapeutics. Protein Pept Lett. 2009;16:539-542. [PubMed] [DOI] |
| 22. | Ng SW, Zhang H, Hegde A, Bhatia M. Role of preprotachykinin-A gene products on multiple organ injury in LPS-induced endotoxemia. J Leukoc Biol. 2008;83:288-295. [PubMed] [DOI] |
| 23. | Maitra U, Chang S, Singh N, Li L. Molecular mechanism underlying the suppression of lipid oxidation during endotoxemia. Mol Immunol. 2009;47:420-425. [PubMed] [DOI] |
| 24. | Kamimoto M, Mizuno S, Nakamura T. Reciprocal regulation of IL-6 and IL-10 balance by HGF via recruitment of heme oxygenase-1 in macrophages for attenuation of liver injury in a mouse model of endotoxemia. Int J Mol Med. 2009;24:161-170. [PubMed] |
| 25. | Aoshiba K, Onizawa S, Tsuji T, Nagai A. Therapeutic effects of erythropoietin in murine models of endotoxin shock. Crit Care Med. 2009;37:889-898. [PubMed] [DOI] |
| 26. | Tsai WH, Cheng PY, Lee YM, Chiu MC, Jiau SS, Wu ES, Yen MH. Anti-inflammatory effects of LK-3, on LPS-induced sepsis in rats. Chin J Physiol. 2008;51:292-300. [PubMed] |
| 27. | Cornell RP. Endogenous gut-derived bacterial endotoxin tonically primes pancreatic secretion of insulin in normal rats. Diabetes. 1985;34:1253-1259. [PubMed] [DOI] |
| 28. | Zhou BR, Gumenscheimer M, Freudenberg MA, Galanos C. Lethal effect and apoptotic DNA fragmentation in response of D-GalN-treated mice to bacterial LPS can be suppressed by pre-exposure to minute amount of bacterial LPS: dual role of TNF receptor 1. World J Gastroenterol. 2005;11:3398-3404. [PubMed] [DOI] |
| 29. | Piao W, Song C, Chen H, Diaz MA, Wahl LM, Fitzgerald KA, Li L, Medvedev AE. Endotoxin tolerance dysregulates MyD88- and Toll/IL-1R domain-containing adapter inducing IFN-beta-dependent pathways and increases expression of negative regulators of TLR signaling. J Leukoc Biol. 2009;86:863-875. [PubMed] [DOI] |
| 30. | West MA, Koons A. Endotoxin tolerance in sepsis: concentration-dependent augmentation or inhibition of LPS-stimulated macrophage TNF secretion by LPS pretreatment. J Trauma. 2008;65:893-900 discussion 893-898;. [PubMed] |
| 31. | Staikos L, Malellari L, Chang SL. Lipopolysaccharide-induced pro-inflammatory cytokines in the brain of rats in the morphine-tolerant state. J Neuroimmune Pharmacol. 2008;3:236-240. [PubMed] [DOI] |
| 32. | Gerhold K, Avagyan A, Reichert E, Blumchen K, Wahn U, Hamelmann E. Lipopolysaccharides modulate allergen-specific immune regulation in a murine model of mucosal tolerance induction. Int Arch Allergy Immunol. 2008;147:25-34. [PubMed] [DOI] |
| 33. | Gamble L, Bagby GJ, Quinton LJ, Happel KI, Mizgerd JP, Zhang P, Nelson S. The systemic and pulmonary LPS binding protein response to intratracheal lipopolysaccharide. Shock. 2009;31:212-217. [PubMed] [DOI] |
| 34. | Berbée JF, Coomans CP, Westerterp M, Romijn JA, Havekes LM, Rensen PC. Apolipoprotein CI enhances the biological response to LPS via the CD14/TLR4 pathway by LPS-binding elements in both its N- and C-terminal helix. J Lipid Res. 2010;51:1943-1952. [PubMed] [DOI] |
| 35. | Amiel E, Acker JL, Collins RM, Berwin B. Uncoupling scavenger receptor A-mediated phagocytosis of bacteria from endotoxic shock resistance. Infect Immun. 2009;77:4567-4573. [PubMed] [DOI] |
| 36. | Schnabl B, Brandl K, Fink M, Gross P, Taura K, Gäbele E, Hellerbrand C, Falk W. A TLR4/MD2 fusion protein inhibits LPS-induced pro-inflammatory signaling in hepatic stellate cells. Biochem Biophys Res Commun. 2008;375:210-214. [PubMed] [DOI] |