修回日期: 2010-04-28
接受日期: 2010-05-10
在线出版日期: 2010-06-08
目的: 分析硒代甲硫氨酸对胃癌AGS细胞蛋白表达谱的影响.
方法: 应用Hoechst荧光染色法及流式细胞术观察硒代甲硫氨酸对胃癌AGS细胞凋亡的影响; 应用双向凝胶电泳技术分析硒代甲硫氨酸对胃癌AGS细胞蛋白表达的影响.
结果: 胃癌AGS细胞在含硒代甲硫氨酸培养液中培养5 d后, 部分细胞的细胞核内出现凋亡小体, 含硒代甲硫氨酸培养液中AGS细胞的凋亡率显著高于正常培养液组(53.98%±9.88% vs 15.76%±9.03%, P<0.01). 双向电泳技术筛选出12个表达差异的蛋白.
结论: 硒代甲硫氨酸可以影响胃癌AGS细胞蛋白的表达. 这些差异表达的蛋白可能与胃癌细胞凋亡有关.
引文著录: 辛林, 朱培谦, 曹家庆, 沈威. 硒代甲硫氨酸对胃癌细胞蛋白表达谱的影响. 世界华人消化杂志 2010; 18(16): 1701-1704
Revised: April 28, 2010
Accepted: May 10, 2010
Published online: June 8, 2010
AIM: To analyze the effects of selenomethionine on the protein expression profile of human gastric carcinoma AGS cells.
METHODS: The effects of selenomethionine on AGS cell apoptosis were determined by Hoechst fluorescent staining and flow cytometry. The effects of selenomethionine on the protein expression profile of AGS cells were analyzed by two-dimensional gel electrophoresis.
RESULTS: Apoptotic bodies were found in many AGS cells cultured for 5 d in medium containing selenomethionine. The proportion of apoptotic cells was significantly higher in AGS cells cultured in medium containing selenomethionine than those cultured in control medium (53.98% ± 9.88% vs 15.76% ± 9.03%, P < 0.01). A total of 12 differentially expressed proteins were identified by two-dimensional electrophoresis.
CONCLUSION: Selenomethionine can influence the protein expression of gastric carcinoma AGS cells. Differentially expressed proteins may be related to the apoptosis of AGS cells.
- Citation: Xin L, Zhu PQ, Cao JQ, Shen W. Selenomethionine alters the protein expression profile of human gastric carcinoma AGS cells. Shijie Huaren Xiaohua Zazhi 2010; 18(16): 1701-1704
- URL: https://www.wjgnet.com/1009-3079/full/v18/i16/1701.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i16.1701
硒是人体所必需的一种微量元素, 硒代甲硫氨酸是一种含硒的有机化合物, 有研究表明硒代甲硫氨酸具有抑制肿瘤生长的作用, 由于其毒性较低, 并且与其他抗肿瘤药物存在协同作用, 有望成为一种有效的化疗药物增敏剂[1]. 以往的研究虽然揭示了一些硒代甲硫氨酸抑制肿瘤细胞生长的分子机制, 但是这些研究多数是针对肿瘤细胞信号传导途径中某个或某几个基因[2,3]. 硒代甲硫氨酸抑制肿瘤细胞生长的分子机制远未阐明. 本实验拟通过双向凝胶电泳(two-dimensional gel electrophoresis, 2-DE)技术直接分析硒代甲硫氨酸诱导胃癌细胞凋亡后蛋白质表达谱的变化, 为阐明硒代甲硫氨酸抑制胃癌细胞生长的分子机制提供线索.
人胃癌细胞株AGS购自中国科学院上海细胞生物研究所; PRMI 1640培养液(Gibco公司); 小牛血清(杭州四季青生物工程公司); 硒代甲硫氨酸、碘乙酰胺、二硫苏糖醇(DTT)、牛血清白蛋白(BSA, Sigma公司); DMSO、尿素、SDS、CHAPS、Tris、甘油、甘氨酸、溴酚蓝、丙烯酰胺、甲叉双丙烯酰胺、过硫酸铵、四甲基乙二胺(TEMED)、低分子质量蛋白(Amreco公司); 固相pH梯度干胶条(pH5-8 17 cm BIO-RAD公司)、IPG Buffer、覆盖液、PMSF; Hoechst 33342染色液(Molecular Probes, 美国); Annexin V-FITC Apoptosis Detection KitⅠ(Becton Dickinson, 美国); 其余试剂为国产分析纯.
1.2.1 分组: 将AGS细胞分别置于正常的RPMI 1640培养液(对照组)和20 mmol/L含硒代甲硫氨酸的RPMI 1640培养液(实验组)中培养.
1.2.2 Hoechst染色法观测胃癌细胞的形态变化: 将处于对数增殖期的胃癌AGS细胞用PBS洗2次, 以终浓度1×104/mL接种于铺有盖玻片的六孔板内, 再分别加入上述2种培养液培养5 d. 加入Hoechst 33342染色液, 调节染液的终浓度为10 mg/L, 37 ℃避光孵育10 min. PBS洗涤后, 放在载玻片上用荧光显微镜观察细胞凋亡并摄片.
1.2.3 流式细胞仪检测胃癌细胞的凋亡率: 将处于对数增殖期的胃癌AGS细胞用PBS洗2次, 以终浓度1×104/mL接种于培养瓶中, 再分别加入上述2种培养液培养5 d. 每个样本设置3个复管. 分别收集两组胃癌细胞, 将各待测样本中的细胞数调至(1-2)×105, PBS洗涤离心, 弃上清. 同时设3个仪器校正管, 加入与样本待测管等量的相应细胞; 各样本中加入100 μL结合缓冲液, 混匀; 然后加入FITC标记的Annexin V和碘化丙啶各5 μL, 其中第1个仪器校正管不加染液, 第2个仪器校正管加入5 μL Annexin V, 第3个仪器校正管加入5 μL PI; 混匀, 室温避光轻摇15 min; 最后加入400 μL结合缓冲液, 混匀. 用FACs Calibur流式细胞仪检测细胞凋亡率, 并用CellQuest软件处理数据.
1.2.4 双向凝胶电泳及银染显色: 分别收集实验组和对照组培养液中连续培养5 d的胃癌AGS细胞并离心, 预冷的PBS洗涤3次后离心收集于1.5 mL EP管, 重悬于100 μL裂解液中(8 mol/L Urea, 4% CHAPS, 40 mmol/L Tris, 1% DTT, 1 mmol/L PMSF, 0.5% IPG Buffer), 振荡裂解1 h, 4 ℃、12 000 r/min离心15 min, 取上清, Bradford法测定蛋白质含量. 分别取实验组和对照组胃癌AGS细胞120 μg的总蛋白与水化缓冲液(8 mol/L尿素、2% CHAPS、25 mmol/L DTT、0.2% Bio-Lyte pH3-10、0.002%溴酚蓝)充分混合, 上样总体积为320 μL, 选用线性、17 cm、pH5-8的IPG胶条. 等电聚焦、平衡、SDS-PAGE电泳、银染[4].
1.2.5 图像采集和分析: 银染显色的凝胶经GS- 800 calibrated densitometry凝胶图像扫描仪扫描获取凝胶图像后, 用PDQuest7.1软件对图像进行背景消减、斑点检测、匹配、量化.
统计学处理 采用SPSS10.0统计分析软件进行t检验.
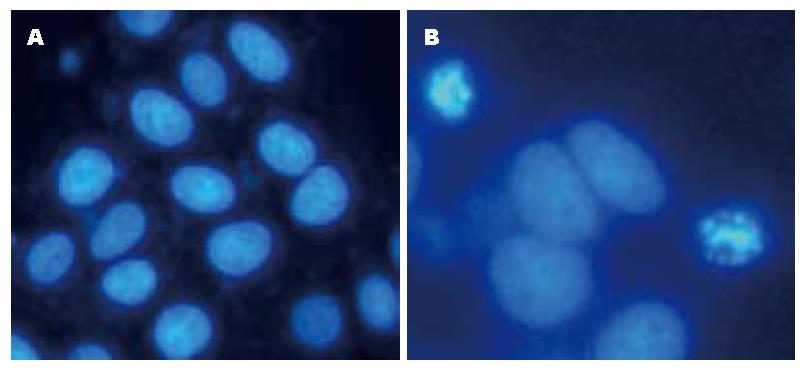
胃癌AGS细胞分别在实验组和对照组培养液中连续培养5 d, Hoechst荧光染色显示: 实验组培养液中大多数胃癌细胞核内均出现高荧光亮度的凋亡小体, 而对照组培养液中多数胃癌细胞胞膜完整, 核染色均匀, 未见凋亡小体(图1).
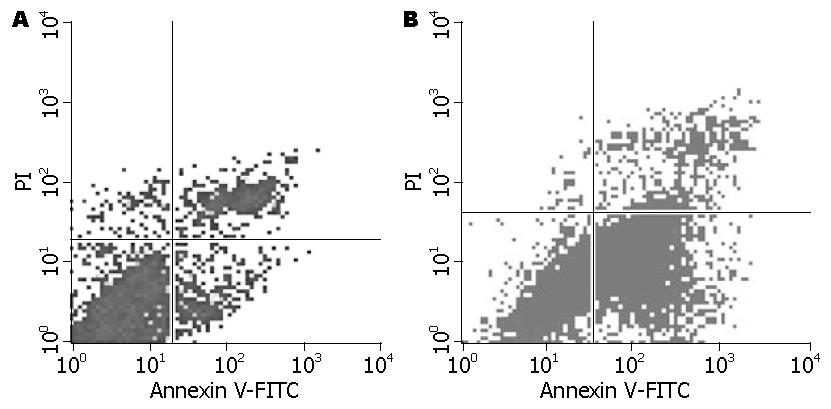
胃癌AGS细胞分别在实验组和对照组培养液中培养5 d, 流式细胞仪检测发现. 胃癌AGS细胞在实验组培养液中的凋亡率显著高于对照组培养液组(53.98%±9.88% vs 15.76%±9.03%, P<0.01, 图2).
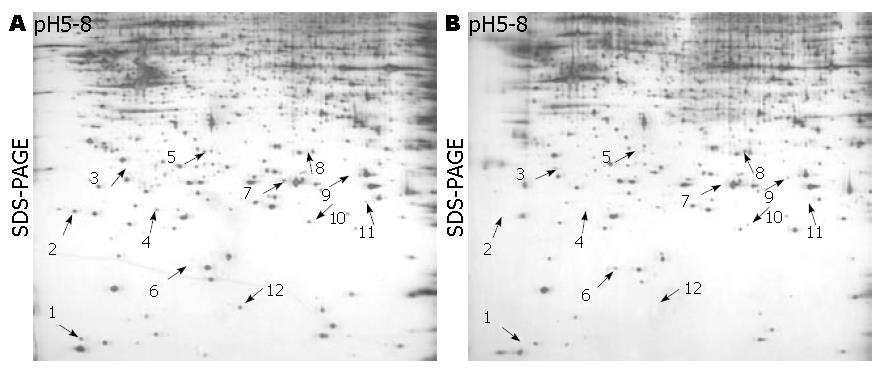
采用GS-800 calibrated densitometry系统扫描银染的2-D胶, 利用PDQuest软件分析, 在自动点检测、 背景消除、均一化处理后, 对照组细胞检测到1 049±56个蛋白点, 实验组细胞检测到1 011±45个蛋白点. 所有步骤重复3次, 实验组和对照组分别获得3块2D胶. 以平均胶为标准, 实验组内3块胶的匹配率是90.5%, 对照组是88.4%, 说明组内各胶的重复性好. 根据蛋白点有或无的判断标准, 应用PDQuest 2-D分析软件, 比较对照组与实验组组AGS细胞双向电泳图谱, 发现12个蛋白点差异特别明显(差异蛋白点用箭头标出, 图3).
近年来, 随着肿瘤流行病学的深入研究和对肿瘤发生机制的进一步探讨, 特别是发现不少食物来源的化合物和食物微量成分可影响肿瘤的发生的发展[5]. 目前营养与肿瘤关系主要集中在流行病学资料的分析上, 营养素在肿瘤治疗方面的研究尚未受到足够的重视, 营养素对肿瘤影响的作用机制, 特别是分子机制了解不够. 硒与癌的关系是微量元素硒研究中最为关注的领域之一. 食物和补剂中的硒大多以有机物(硒代甲硫氨酸、硒半胱氨酸)和无机物(亚硒酸钠或硒酸钠)的形式存在, 与硒的无机盐相比, 硒代甲硫氨酸不仅生物学活性高出许多, 而且更容易被吸收, 从尿、粪中丢失得少, 在体内保留时间长, 因此有机硒补剂形式代替无机硒补剂形式是必然趋势[6-8].
近年来, 硒在肿瘤治疗中的作用及其机制引起人们的重视, 取得了很大进展. 硒抗肿瘤作用机制的研究有不少报道, 目前一般认为其抗癌机制可能为以下几个方面: 通过激活P53、P38信号通路, 诱导肿瘤细胞凋亡[9]; 通过抑制有丝分裂细胞周期蛋白cyclin B表达和cdc2激酶活性或增加丝氨酸/苏氨酸蛋白质磷酸酶活性来诱导肿瘤细胞细胞凋亡、抑制细胞的生长[10,11]; 抑制Akt基因的磷酸化诱导癌细胞凋亡[12]. 国内还有学者报道硒代甲硫氨酸可抑制多药耐药基因编码的糖蛋白的表达, 在一定程度上逆转了肿瘤细胞耐药性[13]. 但总的来说, 其防癌、抗癌的机制仍不十分清楚. 国外有学者用微阵列技术分析了硒代甲硫氨酸对肿瘤细胞基因表达谱的影响, 发现硒代甲硫氨酸对多种基因的表达均具有调节作用[14,15]. 本研究应用蛋白质组学的技术研究了硒代甲硫氨酸对胃癌AGS细胞蛋白表达谱的影响. 蛋白质组学是继功能基因组学后兴起的学科, 其目的是从整体角度分析细胞内动态变化的蛋白质组成成分, 了解蛋白质之间的相互作用和相互联系, 揭示蛋白质功能和生命活动规律. 与以往的研究技术相比, 蛋白质组学技术有着无法比拟的优越性. 生物体功能的主要体现者或执行者是蛋白质, 蛋白质的表达水平、存在方式和相互作用等直接与生物功能相关, 因此研究蛋白质能直接达到阐明生命物质功能机制的目的.
目前蛋白质组学研究中蛋白质分离的核心技术仍然是双向凝胶电泳. 本研究运用高分辨率的双向电泳技术得到了重复性较好的含硒代甲硫氨酸环境中胃癌细胞蛋白表达图谱, 通过对对照组及实验组胃癌细胞蛋白表达图谱的分析, 初步筛选出12个差异表达的蛋白质. 本实验结果提示硒代甲硫氨酸在诱导胃癌细胞凋亡的同时, 细胞中部分蛋白表达发生了明显变化, 这些差异表达的蛋白质可能与细胞凋亡有关, 通过对这些差异表达的蛋白进一步的分析鉴定, 有望找出硒代甲硫氨酸诱导胃癌细胞凋亡的相关蛋白, 为探讨硒代甲硫氨酸抑制胃癌细胞生长的分子机制奠定基础.
硒是人体所必需的一种微量元素, 硒代甲硫氨酸是一种含硒的有机化合物, 有研究表明硒代甲硫氨酸具有抑制肿瘤生长的作用. 以往的研究虽然揭示了一些硒代甲硫氨酸抑制肿瘤细胞生长的分子机制, 但是这些研究多数是针对肿瘤细胞信号传导途径中某个或某几个基因. 硒代甲硫氨酸抑制肿瘤细胞生长的分子机制远未阐明.
肖文华, 主任医师, 中国人民解放军总医院第一附属医院肿瘤科
目前营养素在肿瘤治疗方面的研究逐步受到重视. 硒与癌的关系是微量元素硒研究中最为关注的领域之一. 营养素对肿瘤影响的作用机制, 特别是分子机制目前成为亟待研究的热点.
国外有学者用微阵列技术分析了硒代甲硫氨酸对肿瘤细胞基因表达谱的影响, 发现硒代甲硫氨酸对多种基因的表达均具有调节作用.
本文采用双向电泳技术分析硒代甲硫氨酸抑制胃癌细胞生长的分子机制, 能够了解硒代甲硫氨酸作用下胃癌细胞蛋白表达的整体变化水平.
本研究选题新颖, 设计合理, 结果可靠, 为阐明有机硒抗癌机制提供了实验依据.
编辑: 曹丽鸥 电编: 何基才
| 1. | Zeng H, Combs GF. Selenium as an anticancer nutrient: roles in cell proliferation and tumor cell invasion. J Nutr Biochem. 2008;19:1-7. [PubMed] [DOI] |
| 2. | Rooprai HK, Kyriazis I, Nuttall RK, Edwards DR, Zicha D, Aubyn D, Davies D, Gullan R, Pilkington GJ. Inhibition of invasion and induction of apoptosis by selenium in human malignant brain tumour cells in vitro. Int J Oncol. 2007;30:1263-1271. [PubMed] [DOI] |
| 3. | Jüliger S, Goenaga-Infante H, Lister TA, Fitzgibbon J, Joel SP. Chemosensitization of B-cell lymphomas by methylseleninic acid involves nuclear factor-kappaB inhibition and the rapid generation of other selenium species. Cancer Res. 2007;67:10984-10992. [PubMed] [DOI] |
| 4. | Yan JX, Wait R, Berkelman T, Harry RA, Westbrook JA, Wheeler CH, Dunn MJ. A modified silver staining protocol for visualization of proteins compatible with matrix-assisted laser desorption/ionization and electrospray ionization-mass spectrometry. Electrophoresis. 2000;21:3666-3672. [PubMed] [DOI] |
| 5. | van den Brandt PA, Goldbohm RA. Nutrition in the prevention of gastrointestinal cancer. Best Pract Res Clin Gastroenterol. 2006;20:589-603. [PubMed] [DOI] |
| 6. | Sahin N, Onderci M, Sahin K, Kucuk O. Supplementation with organic or inorganic selenium in heat-distressed quail. Biol Trace Elem Res. 2008;122:229-237. [PubMed] [DOI] |
| 7. | Fairweather-Tait SJ, Collings R, Hurst R. Selenium bioavailability: current knowledge and future research requirements. Am J Clin Nutr. 2010;91:1484S-1491S. [PubMed] |
| 8. | Ebeid TA. Organic selenium enhances the antioxidative status and quality of cockerel semen under high ambient temperature. Br Poult Sci. 2009;50:641-647. [PubMed] [DOI] |
| 9. | Rudolf E, Rudolf K, Cervinka M. Selenium activates p53 and p38 pathways and induces caspase-independent cell death in cervical cancer cells. Cell Biol Toxicol. 2008;24:123-141. [PubMed] [DOI] |
| 10. | Goulet AC, Chigbrow M, Frisk P, Nelson MA. Selenomethionine induces sustained ERK phosphorylation leading to cell-cycle arrest in human colon cancer cells. Carcinogenesis. 2005;26:109-117. [PubMed] [DOI] |
| 11. | Celik HA, Kircelli F, Saydam G, Aydin HH. Potential involvement of serine/threonine protein phosphatases in apoptosis of HepG2 cells during selenite treatment. Biol Trace Elem Res. 2007;117:65-75. [PubMed] [DOI] |
| 12. | Li S, Zhou Y, Wang R, Zhang H, Dong Y, Ip C. Selenium sensitizes MCF-7 breast cancer cells to doxorubicin-induced apoptosis through modulation of phospho-Akt and its downstream substrates. Mol Cancer Ther. 2007;6:1031-1038. [PubMed] [DOI] |
| 14. | Zhao H, Brooks JD. Selenomethionine induced transcriptional programs in human prostate cancer cells. J Urol. 2007;177:743-750. [PubMed] [DOI] |
| 15. | Goulet AC, Watts G, Lord JL, Nelson MA. Profiling of selenomethionine responsive genes in colon cancer by microarray analysis. Cancer Biol Ther. 2007;6:494-503. [PubMed] [DOI] |